3.1: Гелевий електрофорез
- Page ID
- 7449
Гелевий електрофорез використовується для характеристики одного з найголовніших властивостей - молекулярної маси - як полінуклеотидів, так і поліпептидів. Гелевий електрофорез також може бути використаний для визначення: (1) чистоти цих зразків, (2) неоднорідності/ступеня деградації та (3) складу субодиниці.
ДНК
Найбільш поширеними матеріалами гелевого електрофорезу для молекул ДНК є агароза і акриламід.
Гелі ДНК агарози
Швидкість електрофоретичної міграції ДНК через агарозні гелі залежить від чотирьох основних параметрів:
1. Молекулярний розмір ДНК. Молекули лінійної дуплексної ДНК переміщаються через агарозні гелі зі швидкістю, яка обернено пропорційна журналу їх молекулярної маси.
\[M_r \propto 1/log (Mw)\]
Приклад: Порівняйте молекулярну масу та очікувану швидкість міграції:
|
Молекулярна маса (Da) |
Колод (Молец. Маса) |
1/журнал (Молец. Маса), |
|---|---|---|
|
100 000 |
5.0 |
0,20 |
|
50 000 |
4.7 |
0,21 |
|
10 000 |
4.0 |
0,25 |
|
5 000 |
3.7 |
0,27 |
|
1 000 |
3.0 |
0,33 |
.png)
Малюнок 3.1.1: Відносна швидкість міграції з молекулярною масою
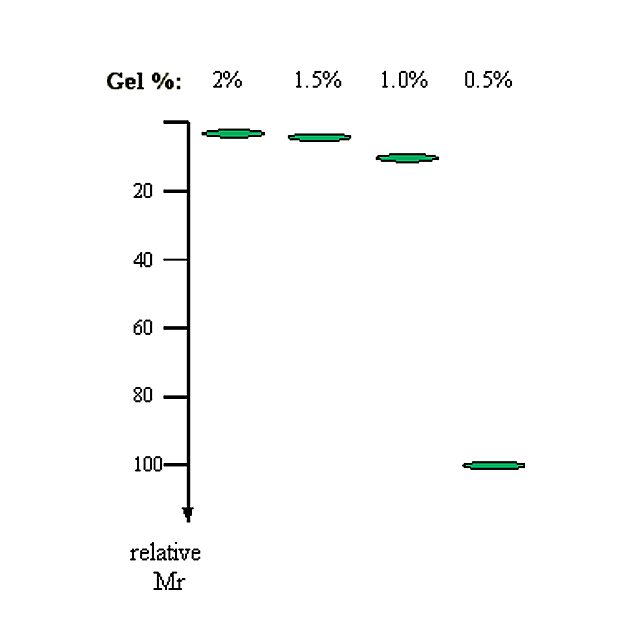
2. Концентрація агарози. Існує зворотна лінійна залежність між логарифмом електрофоретичної рухливості і концентрацією гелю.
\[\log (M_r) \propto 1/[gel]\]
|
Гель% |
1/Гель% |
Журнал інв (1/Gel%) (тобто відносний Mr) |
|---|---|---|
|
2.0 |
0,50 |
3.2 |
|
1.5 |
0,67 |
4.6 |
|
1.0 |
1.00 |
10.0 |
|
0.5 |
2.00 |
100.0 |
.png)
Малюнок 3.1.2: Відносна швидкість міграції з концентрацією гелю
3. Конформація ДНК.
- замкнута кругова ДНК (Form-I) - типово суперзгорнута
- вирізаний циркулярний (Форма-II)
- лінійна ДНК (форма III)
Ці різні форми однієї і тієї ж ДНК мігрують з різною швидкістю через агарозний гель. Практично завжди лінійна форма (Form-III) мігрує з найповільнішою швидкістю з трьох форм і суперспіральна ДНК (Form-I) зазвичай мігрує найшвидше.
4. Прикладений напруга.
- Типове значення для запуску агарозного гелю становить 5 вольт на см (довжина гелю).
|
Агароза (%) |
Діапазон поділу лінійної ДНК (в кілобазах) |
|---|---|
|
0.3 |
60 - 5 |
|
0.6 |
20 - 1 |
|
0.7 |
10 - 0,8 |
|
0.9 |
7 - 0,5 |
|
1.2 |
6 - 0,4 |
|
1.5 |
4 - 0,2 |
|
2.0 |
3 - 0,1 |
- Агарозні гелі зазвичай заливають і проводять горизонтально.
Нарешті, ДНК, будучи кислою молекулою, мігрує до позитивно зарядженого електрода (катода).
.png)
Малюнок 3.1.3: Установка гелевого електрофорезу
ДНК акриламід гелі
Акриламідні гелі корисні для поділу дрібних фрагментів ДНК, як правило, олігонуклеотидів <100 пар основ. Ці гелі, як правило, мають низьку концентрацію акриламіду (<= 6%) і містять неіонний денатурующий агент сечовини (6M). Денатуруючий засіб перешкоджає утворенню вторинної структури в олігонуклеотидах і дозволяє відносно точно визначити молекулярну масу.
Гелевий електрофорез для білків
Гелевий електрофорез білків практично виключно використовує поліакриламід. Розчин акриламіду зазвичай містить два компоненти: акриламід і біс акриламід. Типове значення для співвідношення акриламід:біс - 19:1. Біс акриламід по суті є зшивальним компонентом акриламідного полімеру. Загальна концентрація акриламіду в гелі впливає на міграцію білків через матрикс (як при концентрації агарози).
Білкові гелі зазвичай виконуються в денатуруючих умовах в присутності миючого засобу додецилсульфат натрію (SDS). Білки денатуруються теплом в присутності СДС. SDS зв'язується за допомогою гідрофобних взаємодій з білками в кількості, приблизно пропорційній розміру білка. Завдяки зарядженій природі молекули SDS білки, таким чином, мають дещо постійне відношення заряду до маси і мігрують через гель зі швидкістю, пропорційною їх молекулярній масі, Білки мігрують до анода.
|
Акриламід (%) |
Діапазон поділу поліпептидів (в кілодальтонах) |
|---|---|
|
8 |
200 - 25 |
|
10 |
100 - 15 |
|
12.5 |
70 - 10 |
|
15 |
60 - 6 |
|
20 |
40 - 4 |
Оскільки лікування SDS буде дисоціювати нековалентні білкові комплекси, вони можуть, таким чином, виявляти набагато менше, ніж очікувалося, молекулярна маса на електрофорезі поліакриламідного гелю SDS (SDS PAGE). Протеїнові гелі PAGE зазвичай полімеризуються між двома скляними пластинами і проходять у вертикальному напрямку.
.png)
Малюнок 3.1.4: Ефект лікування SDS
PAGE також може бути запущений в присутності відновників, таких як b -меркаптоетанол (BME). BME є відновником, який зменшить будь-які дисульфідні зв'язки (наприклад, як існує між деякими парами залишків цистеїну в білку). Це допомагає видалити залишкову вторинну структуру в обробленому SDS білка, але це також може дозволити відокремлення поліпептидних фрагментів один від одного (тобто їх ковалентна взаємодія повністю складалася з однієї або декількох дисульфідних зв'язків). Таким чином, очевидно, один білок може проявляти набір дрібних фрагментів в умовах зменшення PAGE.
Плями для ДНК
Етидіум
Найбільш зручним методом візуалізації ДНК в гелевому електрофорезі є фарбування флуоресцентним барвником бромід етидію. Ця сполука містить плоску групу, яка інтеркалюється між складені основами ДНК. Орієнтація та близькість етідію з укладеними основами змушує барвник проявляти підвищену цвітіння порівняно з вільним барвником (у розчині). УФ-випромінювання при 254 нм поглинається ДНК і передається пов'язаному барвнику, а енергія повторно випромінюється при 590 нм в червоно-помаранчевій області спектра.
.png)
Малюнок 3.1.5: Етидій
Бромід етідію зазвичай готують у вигляді вихідного розчину 10 мг/мл у воді, зберігають при кімнатній температурі і захищають від світла. Барвник зазвичай вводять в гель і працює буфер, або, навпаки, гель фарбують після прогону шляхом замочування в розчині броміду етідію (0,5 мкг/мл протягом 30 хв). Плівка візуалізується шляхом опромінення джерелом ультрафіолетового світла (тобто за допомогою транзилюмінатора) та фотографування поляроїдною плівкою. Звичайна чутливість виявлення краще 0,1 мкг ДНК.
Оскільки етидій є агентом інтеркаляції ДНК, він є потужним мутагеном. Включення етидію в ДНК живих організмів (тобто ви і я) може спричинити (небажані) мутації.
Примітка:
- Інтеркаляція броміду етідію викликає зменшення кількості ефективних пар основи на скручування.
- Таким чином, ДНК хоче прийняти конформацію з меншою кількістю пар основ на скручування.
- Кількість поворотів збільшиться для заданої довжини ДНК
- Writhe зменшиться, якщо число зв'язків залишиться незмінним
- Кінцевим результатом є те, що додавання броміду етидію введе негативні суперкойли в ДНК.
- Додавання броміду етидію до зразка ДНК перед електрофорезом може спричинити позитивну суперспіральну ДНК мігрувати як розслаблену (ніксовану або форму II) ДНК
- Після реплікації ДНК, як правило, підмотується (негативні суперкойли), таким чином, вона стане більш підмотаною при лікуванні eTBR (швидкість міграції може фактично збільшитися через більш компактний стан)
Затінення флюоресценції:
- Фрагменти ДНК, дозволені на поліакриламідних гелі, також можуть бути візуалізовані методом УФ-тіні.
- У цьому методі гель поміщається поверх флуоресцентного матеріалу, як правило, флуоресцентної пластини TLC кремнезему.
- Потім гель висвітлюється джерелом ультрафіолетового світла.
- ДНК-смуги в гелі блокують пропускання ультрафіолетового світла до субстрату.
- Це призведе до появи темної області (тобто не флуоресцентної) області на підкладці.
- Цей метод зазвичай використовується при гелевому очищенні олігонуклеотидів (тобто темні смуги можна вирізати лезом бритви та витягти олігонуклеотид)
Плями для протеїнів
Кумассі блискучий синій
- Coomassie blue є трифенілметановим текстильним барвником, який здатний фарбувати білки.
- Після запуску поліакриламідного гелю його зазвичай «фіксують», поміщаючи в 50% розчин метанолу/10 оцтової кислоти на 30 хвилин (для осаду білків і запобігання дифузії з гелю).
- Фіксований гель потім замочують у розчині метанолу/оцтової кислоти, що містить 2,5 г/літр Coosmassie blue.
- Затримка фону гелю здійснюється шляхом замочування в зміні 10% метанолу/7% оцтової кислоти. Цей метод, як правило, може виявити зразки білка 0,1 мкг або більше.
Срібна морилка
- Срібне фарбування - це метод, який використовує розчин нітрату срібла для фарбування білків в акриламідному гелі.
- Метод схожий за своєю природою з використанням срібла в фотопластин.
- Чутливість приблизно на два порядки більш чутлива, ніж фарбування кумассієм (тобто можна виявити приблизно 1 нг білка).
- Завдяки високій чутливості цей метод зазвичай використовується для визначення наявності слідових забруднень в зразках білка.
Стандарти молекулярної ваги
- Як ДНК, так і білковий гель-електрофорез використовують стандарти молекулярної маси для калібрування розміру (ів) аналізованих зразків
- Стандарти молекулярної маси ДНК будуть складатися з суміші фрагментів ДНК відомих розмірів (молекулярної маси)
- Один зручний стандарт молекулярної маси ДНК будується шляхом часткового лігування 100-базисного парного фрагмента дуплексної ДНК.
- Часткове лігування призведе до утворення димерів (200 б.п.), тримерів (300 б.п.) і так далі, а також деякої кількості вихідного (100 б.п.) фрагмента
- Це виробляє ДНК «драбинка» після гелевого електрофорезу
- Іншим стандартом фрагмента ДНК може бути відома послідовність ДНК, така як плазміда PBr322, яка була перетравлена з чотирма різаками рестрикційної ендонуклеази (наприклад, Alu I).
- При цьому виходять різноманітні фрагменти з різними розмірами.
- Він легко відтворюється (просто виріжте більше PBR322)
- Один зручний стандарт молекулярної маси ДНК будується шляхом часткового лігування 100-базисного парного фрагмента дуплексної ДНК.
- Білкові молекулярно-масові маркери зазвичай складаються з суміші півтора десятка або близько того чистих білків з відомими молекулярними масами.
|
Протеїн |
Молекулярна маса (Da) |
|---|---|
|
Фосфорилаза B |
94 000 |
|
Бичачий сироватковий альбумін |
67 000 |
|
овальбумін |
43 000 |
|
Вуглекислий ангідрази |
30 000 |
|
Соєвий інгібітор трипсину |
20 100 |
|
А-лактальбумін |
14 400 |
- Як в ДНК, так і в білкових гелі маркери молекулярної маси запускаються в смузі на одному кінці гелю
.png)
Малюнок 3.1.6: Стандарти розміру ДНК
