3: Критичні властивості та ацентричний фактор
- Page ID
- 29383
Дистиляція науки (суміш хімії та хімічної інженерії)
Це частина III, критичні властивості та ацентричний фактор із десяти частин серії технічних статей з дистиляції науки, як це зараз практикується на промисловому рівні. Див. також Частина I, Огляд вступних коментарів, обсяг серії статей та номенклатури. Мета цієї статті - пояснити, як використовуються критичні властивості та ацентричний фактор, і як їх можна оцінити, коли достовірні значення недоступні.
Як обговорювалося в частині II, більш основні рівняння тиску пари мають обмеження, які перешкоджають їх використанню в багатьох сучасних промислових дистиляційних системах, зокрема при більш високих тисках. Поняття в цій статті будуть використані в частині IV, щоб ввести вдосконалене рівняння тиску пари, яке знімає обмеження основних рівнянь тиску пари.
Для реалізації більш складних зв'язків ВП і взаємопорівняння констант в частині IV, експериментально виміряні P vs T дані повинні бути введені в зменшену форму. Це робиться тільки при знанні критичної точки, яка полягає в тій сингулярності на лінії насичення, де рідка і парова фази стають одним цілим. Критичні температури і тиску ідентифікуються як T c і P c. У критичній точці питомий молярний об'єм дорівнює V c.
\[T_{r} = T/T_{c} \label{3-1} \]
\(P_{r} = P/P_{c} \nonumber\)
\(V_{r} = V/V_{c} \nonumber\)
(Зверніть увагу, що знижені властивості мають перевагу в тому, що вони безрозмірні)
Використання зменшених змінних T r, P r і V r з Рівняння (\ ref {3-1}) також дозволяє ввести поняття «Закон відповідних станів» (який насправді не є науковим законом як таким, але більшою мірою із загальним спостереженням). Цей «закон» висловлює узагальнення того, що ці властивості, залежні від міжмолекулярних сил, пов'язані з критичними властивостями однаково для всіх рідин. Ця концепція лежить в основі розробки декількох пізніших статей цієї серії про дистиляцію науки, включаючи частини IV - VII.
Критична стисливість - Z c, як визначено як:
\[Z_{c}= \frac {P_{c}V_{c}}{RT_{c}} \label{3-2} \]який також є безрозмірним.
Важливо відзначити ще два властивості:
- \(T_b\)визначається як температура кипіння атмосферного тиску рідини, причому\(T_{br}\) як зменшене значення атмосферної температури кипіння
- \(ω\)це ацентричний фактор, який є мірою молекулярної складності, визначеної як:
\[\omega=-\log_{10}(VP)-1 \label{3-3} \]де ВП (в атмосферах) оцінюється при T r = 0,7
Термін «ацентричний фактор» походить від спостереження Кеннета Пфайзера в 1955 році, що компактні та майже сферичні молекули мають близькі до нульових значень, коли обчислюється їх ω. Наприклад, неон, аргон і криптон мають ω значення -0,04, 0,00 і 0,00 відповідно (гелій має більш трохи негативний ω, значення в залежності від ізотопу). Метан (CH 4) має ω 0,011; а молекулярно більший силан (SiH 4) має ω 0,099. Ще більша і складніша молекула, як тетрахлорид вуглецю (CCL 4), має ω 0.193; тоді як тетрахлорид кремнію (SiCl 4) має ω 0,248. Тож оцінка ацентричного фактора за даними VP та знання критичної точки є хорошою перевіркою перевірки щодо відомих молекулярних розмірів та форми.
Для рівнянь стану (див. Частина V), які є більш просунутими, ніж Ван дер Ваальс, ацентричний коефіцієнт є необхідною властивістю поряд з критичною температурою та тиском. Він також використовується поряд з критичними властивостями при оцінці параметрів бінарної взаємодії в частині VII.
Як згадувалося в частині II, основні відносини ВП мають прийнятну точність для отримання хороших значень T b з наявних даних. Експериментальні дані часто беруться поблизу атмосферного тиску, але не точно при одному абсолютному атмосфері (тобто 760 мм рт.ст. = 760 Торр = 101,325 Па). Замість того, щоб сліпо приймати значення T b з довідника або одного веб-сайту, практикуючий вчений або інженер повинен розглянути джерело даних і надійність. Існує готовий доступ до Інтернету атмосферних точок кипіння, критичних даних про властивості та ацентричних факторів, особливо на NIST WebBook та глобальних веб-сайтах, таких як Dechema, Infotherm (нещодавно придбаний Джоном Уайлі та синами з FIZ Chemie Berlin).
Рекомендований спосіб сортування запаморочливої кількості критичних даних про властивості (тобто T c, P c, і V c) полягає у використанні кореляційних методів Лідерсона («Оцінка критичних властивостей органічних сполук», Університет Вісконсіна Коледж Інжиніринг, 1955) та інші, які спеціально орієнтовані на органічні сполуки. З деякими алгебраїчними маніпуляціями та коригуванням параметрів Лідерсона (оскільки намір використання тут стосується полярних сполук, які не є органічними, але не є іонними), і на основі даних по гомологах, такі відносини, здається, тримаються і рекомендуються як для перевірки сумнівних даних, так і для заповнення «дірок» без даних:
Для T b загальні кореляційні відносини в межах гомологу (наприклад, від силану до тетрахлориду кремнію, або від фосфіну до трихлорфосфіну):
\[(T_{b}\times MW)^n= A+B\times MW \label{3-4} \]
де МВт - молекулярна маса. Для хлоросиланів, хлорометанів, хлорофосфінів тощо це співвідношення найкраще підходить з показником «n» 0,8320. Константи A і B для гомологу, як правило, встановлюються гідридом і хлоридом, оскільки ці дані, як правило, більш достовірні. Там, де основним атомом є не просто вуглець або кремній, а суміш (тобто метилсилан), показник 0.8455 підходить для даних трохи краще. Це контрастує з органічними сполуками, дані яких, як правило, найкраще відповідають дещо нижчим показникам, які ближче до 0,80.
Для T c (критична температура) найкращою кореляцією в межах гомологу є:
\[\frac {T_{c}-T_{b}}{T_{c}}= A+B\times MW \label{3-5} \]
де MW - молекулярна маса, а константи A і B для гомологу, як правило, встановлюються гідридом і хлоридом, якщо немає органічного вмісту, а рідини мономерні.
Для P c (критична температура) використовуйте
\[(\frac {MW}{P_{c}})^n= A+B\times MW \label{3-6} \]
де MW - молекулярна маса, показник «n» = 0.5672, а константи A і B для гомологу, як правило, встановлюються гідридом і хлоридом (до тих пір, поки немає органічного вмісту і рідини мономерні). Для чистої органічної сполуки показник «n» повинен бути запропонованим Лідерсоном 0.5000; для метилсиланів (наприклад, диметилсилану) найкращим показником є 0.4550; а для III групи (димерні мостові зв'язані) сполуки найкращим показником є 1.03-1.08 (1.03 для ді-галанів та 1.08 для диборанів).
Для V c (критичний молярний об'єм) правило Лідерсона
\[V_{c}=A+B\times MW \label{3-7} \]
ймовірно, все ще найкращий, де MW - молекулярна маса, а константи A і B для гомологу, як правило, встановлюються гідридом і хлоридом. Для деяких гомологів існує ймовірність того, що співвідношення Vc проти MW не є точно лінійним, а має невелику увігнуту квадратичну природу; але дані рідко бувають достатньо хорошими, щоб визначити такі. З усіх критичних властивостей V c найважче експериментально виміряти, і часто оцінюється.
Існує спосіб обійти частину невизначеності з V c, і це перевірити (або зробити незначні V c коригування) на основі шаблону Z c значень в гомолозі, де
\[Z_{c}= \frac{P_{c}\times V_{c}}{R\times T_{c}} \label{3-8} \]
У межах кожного гомологу є характерна «контрольна позначка» до значень Z c, при нанесенні на кількість водню на хлор свопів гомологу (тобто, гідрид гомолога має нульові свопи, монохлорид один своп, дихлорид два свопи і т.д.). Див. Нижче приклад графіка даних Рисунок 3-1 для хлоросилану та хлорофосфіну гомологів.
Гідрид гомолога (який, як правило, є досить сферичною формою молекули з мінімальним дипольним моментом), як правило, має Z c в діапазоні 0,27-0,29. Перший своп замінює невеликий атом «H» більшим атомом «Cl» і переорієнтує молекулярну форму, щоб мати значний диполь, знижуючи значення Z c приблизно на 10%. Потім наступні свопи зменшують диполь, поки молекулярна форма не повернеться ближче до сферичної, хоча і значно більшої в діаметрі. Зазвичай Z c повністю хлорованої рідини гомологу має трохи більший Z c, ніж гідрид гомолога.
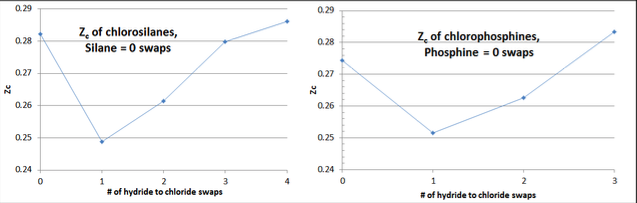
У тій мірі, в якій ця форма «галочки» не спостерігається при побудові обчислених значень Z c за рівнянням 3-8, «винуватцем» майже завжди є значення V c, що дозволяє провести деяку корекцію. Значення Z c, як відомо, має значне відношення до молекулярної форми та складності, хоча більш міцний зв'язок між Z c і ацентричним фактором, ω, не так легко узагальнюється, як в органічних сполуках.
Важливість точних значень T b, T c, P c (і ω до певної міри) полягає в розрахунку тиску пари за допомогою розширеного співвідношення частини IV. Маючи точне значення ω важливіше, поряд з T c, P c при обчисленні рівняння стану для рідини, в частині V. Наявність хороших значень для ω і V c є важливими для оцінки параметрів бінарної взаємодії в частині VII.
Коли два різних типи свопів робляться в злегка полярній молекулі, альтернативний метод використовується для найкращої кореляції властивостей рідини (T b, T c, P c, V c, і ω), причому хорошим прикладом є метилхлоросилани. За допомогою метилхлорсиланів одна або кілька метильних груп замінюються атомами водню (тобто Si-H замінені на Si-CH 3), а решта зв'язку Si-H, можливо, поміняється на Si-Cl. Іншим прикладом може бути заміна C-H на C-Cl і C-F зв'язку в хлор-фторметанах. Не існує лаконічної формули, яка б регулювала таку подвійну заміну. Замість цього використовується поняття нейронних мереж.
У цій техніці дві базові криві викладені з однієї вихідної сполуки (силан у прикладі нижче), і на кожній базовій кривій відповідні значення фізичних властивостей, показані для кожного заміщеного гомологу (хлоросилани та метилсилани є базовими кривими в наведеному нижче прикладі) проти молекулярної маси. Для кожної суми комбінованого заміщення (100%, 75% та 50% заміщення = 0%, 25% та 50% Si-H) точки даних підключаються до відповідних базових кривих. Наприклад, на 75% кількості заміщення можна з'єднати криво-трихлорсилан, метилдихлорсилан, диметилмонохлорсилан та триметилсилан.
Додаткові криві з'єднання можуть бути зроблені для значень постійної кількості хлору або метилового заміщення (наприклад, монохлорсилан, метилмонохлорсилан, диметилмонохлорсилан та триметилмонохлорсилан). Використовуючи цей метод, дані про подвійно заміщені рідини можуть бути перевірені та зроблені коригування, щоб криві з'єднання були гладкими.
У прикладі на малюнку 3-2 значення P c для метилмонохлорсилану (sic, me-mono) та диметилмонохлорсилану (sic, di-me mono) затверділи від грубих вимірювань.
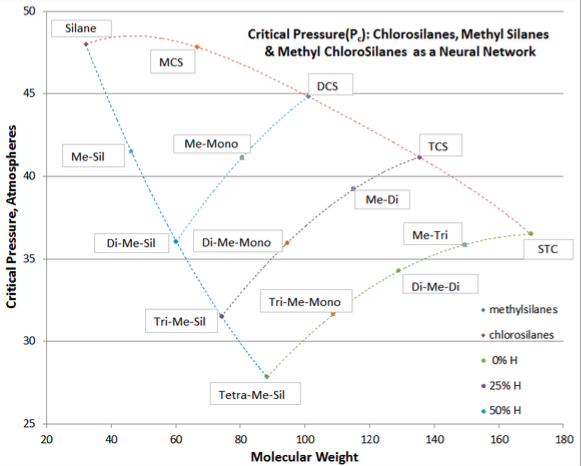
Цінність техніки нейронної мережі полягає в тому, щоб внести коригування там, де дані погані або оцінка сумнівної точності. Презумпція нейронних мереж полягає в тому, що для класу сполуки континуум структурних змін повинен бути рівномірним і внутрішньо послідовним (хоча і не обов'язково лінійним).
Нейронні мережі були побудовані для всіх відповідних властивостей метилхлорсиланів, і метод виявився досить простим для графічного вирішення за допомогою MS Excel. Отримані значення були включені в таблицю 3-3 нижче для хлорсиланів та їх загальних домішок, властивості яких були підтверджені за допомогою кореляційних методів рівняння (\ ref {3-4}) через Equation (\ ref {3-8}).
|
Рідина |
МВт |
Т б |
Т с |
П с |
В с |
Z с |
ω |
|---|---|---|---|---|---|---|---|
|
Група ІІІ (А) |
|||||||
|
Б 2 Ч 6 |
27.670 |
180.54 |
289.70 |
39.58 |
173.10 |
0,2882 |
0,1254 |
|
Б 2 Н 5 Кл |
62.119 € |
216.37 |
346.33 |
37.13 |
189.92 |
0,2481 |
0.1283 |
|
ВН 2 Кл як мономер |
42.284 |
237.72 |
379.56 |
37.10 |
206.73 |
0,2463 |
0,1315 |
|
BHCl 2 як мономер |
82.722 |
266.07 |
422.71 |
37.63 |
240.37 |
0,2608 |
0.1389 |
|
B 2 HCl 5 гіпотетичний |
199.893 € |
276.67 |
438.47 |
37.92 |
257.18 |
0,2711 |
0.1433 |
|
BCL 3 |
117.169 |
285.88 |
451,95 |
38.20 |
274.00 |
0,2822 |
0,1468 |
|
АлКл 3 як мономер |
133.341 |
466,86 * |
625.70 |
26.00 |
261.80 |
0,1326 |
0,3474 |
|
Га 2 Н 4 Сл 2 як димер |
214 383 € |
350.86 |
545.93 |
40.94 |
231.9 |
0,2120 |
0,2726 |
|
Га 2 Н 2 Сл 4 як димер |
283 273 € |
421.79 |
639,69 |
41.02 |
247.5 |
0.1943 |
0,3525 |
|
Га 2 Сл 6 як димер |
352.162 € |
473.49 |
694.00 |
37.70 |
263.0 |
0,1741 |
0,4504 |
|
Група IV (А) |
|||||||
|
Ши 4 |
32.117 |
161.75 |
269.65 |
47.99 |
130.07 |
0,2821 |
0.09860 |
|
Ши 3 Кл |
66.562 |
242.75 |
396,65 |
47.82 |
169.32 |
0,2488 |
0.1252 |
|
Ш 2 сл 2 |
101.007 |
281.45 |
449.45 |
44.83 |
215.05 |
0,2614 |
0.1589 |
|
Сикл 3 |
135.452 |
306.15 |
479.15 |
41.15 |
267.28 |
0,2797 |
0,2090 |
|
SiCl 4 |
169.896 |
330.72 |
506,95 |
36.50 |
326.00 |
0,2860 |
0,2482 |
|
Ш (3 СН 3) |
46.144 |
216.48 |
348,35 |
41.53 |
185.20 |
0,2691 |
0,1264 |
|
Сі 2 Кл (СН 3) |
80.589 |
278.82 |
439.11 |
41.16 |
233.90 |
0,2672 |
0,1793 |
|
СиНКЛ 2 (СН 3) |
115.034 |
314.17 |
489.18 |
39.25 |
287.81 |
0,2814 |
0,2269 |
|
SiCl 3 (СН 3) |
149.479 |
339.72 |
517.61 |
35.86 |
345.70 |
0,2919 |
0,2655 |
|
Ш 2 (СН 32) |
60.169 |
252.86 |
399.17 |
36.05 |
245.84 |
0,2706 |
0.1604 |
|
СиНЧ (СН 32) |
94.615 |
305.30 |
471.35 |
35.94 |
300.32 |
0,2791 |
0,2264 |
|
SiCl 2 (СН 32) |
129.061 |
342.89 |
519.21 |
34.26 |
358.20 |
0,2880 |
0,2740 |
|
Гех 4 |
76.642 |
184.93 |
307.98 |
54.77 |
128.28 |
0,2780 |
0,1270 |
|
Гех 3 Кл |
111.087 |
302.91 |
495.10 |
49.95 |
180.17 |
0,2215 |
0.1476 |
|
Гех 2 Сл 2 |
145.532 |
334.60 |
536.93 |
45.36 |
236.71 |
0,2437 |
0,1721 |
|
ГеНКЛ 3 |
179.976 |
343.54 |
541.41 |
41.42 |
283.96 |
0,2647 |
0.2012 |
|
ГеКл 4 |
214.421 |
357.28 |
553.16 |
38.10 |
335.86 |
0,2819 |
0,2334 |
|
СНН 4 |
122.742 |
221.07 |
360.20 |
51.70 |
152.90 |
0,2674 |
0,1619 |
|
SnCl 4 |
260.521 |
387.21 |
591,85 |
36.95 |
351.20 |
0,2672 |
0,2625 |
|
Група V (A) |
|||||||
|
РН 3 |
33.998 |
185.41 |
324,75 |
64.51 |
113.33 |
0,2743 |
0.03052 |
|
РН 2 Кл |
68.443 |
273.09 |
463.73 |
62.29 |
153.63 |
0,2515 |
0,0750 |
|
ПГКЛ 2 |
102.888 |
318.44 |
524.74 |
55.82 |
202.52 |
0,2625 |
0.1362 |
|
пКл 3 |
137.333 |
349,25 |
558.95 |
50.00 |
260.00 |
0,2834 |
0,2117 |
|
ОпКЛ 3 |
153.331 |
379.00 |
605.21 |
47.59 |
276.00 |
0,2645 |
0.1993 |
Таблиця 3-3, продовження
|
АШ 3 |
77.945 |
210.73 |
373.00 |
65.12 |
132.50 |
0,2819 |
0.01341 |
|
АШ 2 Кл |
112.390 |
300.41 |
515.99 |
64.33 |
174.85 |
0,2657 |
0.0573 |
|
ЯСЛ 2 |
146.835 |
359.66 |
600.00 |
61.57 |
218.29 |
0,2730 |
0.1153 |
|
АСЛ 3 |
181.281 |
403.30 |
654.00 |
58.35 |
259.56 |
0,2822 |
0,1875 |
|
СбН 3 |
124.781 |
256.09 |
446.20 |
66.61 |
157.20 |
0,2860 |
0.01659 |
|
SBCl 3 |
28.115 |
794.05 |
794.05 |
68.85 |
268.00 |
0,2832 |
0,3309 |
|
н-пентан |
72.149 |
309.16 |
470.05 |
32.86 |
310.0 |
0,2641 |
0,2393 |
|
ізо-пентан |
72.149 |
300.82 |
460.56 |
33.17 |
307.1 |
2.695 |
0,2147 |
У наведеній вище таблиці 3-3 ті записи, які позначені a, мають свою молекулярну масу, вказану як димер. Для AlCl 3 зірочка на записі T b є найкращим співвідносним значенням для рівняння VP частини IV, навіть якщо воно знаходиться нижче потрійної точки. З'єднання групи IIIA можуть мати «мостово-склеювання» і можуть бути як мономерними, так і димерними. Два пентанові записи в кінці таблиці включені через їх значення як електронні домішки, і показати, що методи можуть бути поширені на органіку.
При групі IIIA деякі сполуки не включаються в гомолог просто тому, що вони неможливі структурно або нестабільні. Прикладом може бути B 2 H 3 Cl 3, що поставило б занадто велике навантаження на мостовий зв'язок B-B. Іншим є AlH 3, який не може існувати як автономна рідина з тиском пари при нормальних умовах обробки, але має тенденцію утворювати стабільні гідриди з металами групи I, такими як LiAlH 4. Однак B 2 HCl 5 включений (але відзначається як гіпотетичний), оскільки деякі дослідники стверджують, що бачили його присутність при низьких рівнях TCS.
