12.7: Теорія Бора атома водню
- Page ID
- 74301
Цілі навчання
- Опишіть ранні атомні моделі.
- Поясніть теорію Бора про атом водню.
- Розрізняють правильні і неправильні риси моделі Бора, в світлі сучасної квантової механіки.
Великий датський фізик Нільс Бор (1885—1962) негайно використав планетарну модель атома Резерфорда. (Малюнок\(\PageIndex{1}\)). Бор переконався в його дійсності і провів частину 1912 року в лабораторії Резерфорда. У 1913 році, повернувшись до Копенгагена, він почав публікувати свою теорію найпростішого атома, водню, засновану на планетарній моделі атома. Протягом десятиліть задавалося багато питань щодо атомних характеристик. Від їх розмірів до їх спектрів було відомо багато про атоми, але мало що було пояснено з точки зору законів фізики. Теорія Бора пояснила атомний спектр водню та встановила нові та широко застосовні принципи квантової механіки.

Атомні спектри
Атомні та молекулярні емісії та поглинання спектри були відомі протягом століття, щоб бути дискретними (або квантованими). Задовго до того, як вони були зрозумілі з перших принципів, хіміки використовували спектри випромінювання та поглинання для ідентифікації елементів. \(\PageIndex{2}\)На малюнку показаний спектр випромінювання заліза, наприклад. Ніякі інші елементи не випромінюють точно такий же набір частот світла. З відкриттям субструктури атома і відкриттям фотона (а точніше, уточненого розуміння природи частинок електромагнітних хвиль, де енергія частинок пропорційна частоті електромагнітних хвиль) ці резонансні частоти світла, випромінюваного атомами, могли б бути використовується для висновку атомної моделі.

Для атома водню, найлегшого елемента з найпростішим атомом, закономірність для його лінійного спектра була помічена експериментаторами (див. Малюнок\(\PageIndex{3}\)). Усі довжини хвиль лінійного спектру можна описати наступною формулою, для відповідного вибору двох цілих чисел\(n_{i}\) і\(n_{f}\):
\[\frac{1}{\lambda}=R\left(\frac{1}{n_{\mathrm{f}}^{2}}-\frac{1}{n_{\mathrm{i}}^{2}}\right), \label{1}\]
де\(\lambda\) - довжина хвилі випромінюваного\(R\) ЕМ-випромінювання і постійна Рідберга, визначена експериментом
\[R=1.097 \times 10^{7} / \mathrm{m}\left(\text { or } \mathrm{m}^{-1}\right). \nonumber \]
The\(n_{\mathrm{f}}\) є додатним цілим числом, пов'язаним з певним рядом, які названі на честь їх першовідкривачів. Для серії Lyman,\(n_{\mathrm{f}}=1\); для серії Balmer,\(n_{\mathrm{f}}=2\); для серії Пашена,\(n_{\mathrm{f}}=3\); і так далі. Серія Lyman повністю знаходиться в УФ, тоді як частина серії Balmer видно з рештою УФ. Серія Paschen та всі інші повністю IR. Мабуть, існує необмежена кількість серій, хоча вони поступово лежать далі в інфрачервоному діапазоні і їх важко спостерігати зі\(\n_{\mathrm{f}}\) збільшенням. The\(n_{\mathrm{i}}\) є додатним числом, більшим за\(n_{\mathrm{f}}\). Так, наприклад, для серії Balmer,\(n_{\mathrm{f}}=2\) і\(n_{\mathrm{i}}=3,4,5,6, \ldots\).
Отже, до моделі Бора атома водню така була картина атомної теорії - сповнена сугестивних (і навіть добре організованих) даних і жодних об'єднуючих пояснень. Ернест Резерфорд цитується, як каже: «Вся наука - це або фізика, або збір штампів». Він мав на увазі, є галузі науки, практикуючі діячі яких були б задоволені колекцією цікавих фактів (тобто «штамп-колекціонування»). Але те, що робить фізику фізикою, - це пошук теоретичної основи, що дає пояснення, засновані на фундаментальних принципах, а не на ідіосинкратичних описах. Модель Бора привнесла науку про спектроскопію у фізику.

Модель Бора для водню
Планетарна модель атома, запропонована Резерфордом, потрапила в біду. Хоча модель надала можливу картину того, як дуже мале атомне ядро може бути організовано з електронами у стабільному розташуванні, вона не передбачала розміру електронних орбіт (що було б пов'язано з розміром атома), і розташування насправді не було стабільним - орбітальний електрон є коливальний заряд; коливальний заряд випромінює електромагнітні хвилі; електромагнітні хвилі забирають енергію; так як електрон втрачає енергію, він потрапляє в протон. За деякими оцінками, це відбудеться за короткий час, як\(10^{-7} \mathrm{~s}\)!
Відправною точкою Бора для його успішної моделі було наступне: він запропонував квантувати орбіти електронів в атомах. Щоб повністю зрозуміти це твердження, ми можемо порівняти орбіти електронів в атомах з орбітами планет Сонячної системи. Орбіти планет не квантуються. Хоча закони фізики регулюють, як рухаються планети в Сонячній системі (див., наприклад, закони Кеплера, або їх виведення Ньютоном, починаючи з зворотно-квадратного закону гравітації), не існує закону фізики, що диктує, наскільки далеко кожне тіло Сонячної системи має бути від Сонця. Таким чином, орбіти планет не квантуються.
Тож те, що пропонував Бор, було абсолютно новим законом фізики, якого ніхто не знав раніше. В одному сенсі це було не зовсім новим (Планк і Ейнштейн вже користувалися деякими успіхами, пропонуючи квантування енергії в теплових генераторах та ЕМ-випромінюванні); в іншому сенсі це був великий розрив від століть класичної механіки. Це було правило квантування Бора: кутовий імпульс електрона на його орбіті квантується. У математичній формі,
\[L=n \hbar, \nonumber \]
де nn може приймати будь-яке натуральне ціле значення (\(n=1,2,3, \ldots\)), і\(\hbar\) відомий як зменшена константа Планка (\(\hbar=h / 2 \pi\)). І кутовий момент\(L\), як ви могли б пам'ятати з попередньої глави, задається наступним для частинки на рівномірній круговій орбіті:\(L=m v r\), де\(m\) маса частинки,\(v\) - швидкість частинки на орбіті, а rr - радіус кругової орбіти. Використовуючи це як вихідну точку, напівкласичний аналіз орбітального руху дає цілий масив квантованих (тобто дозволених) значень орбітальної відстані\(\left(r_{n}\right)\), орбітальної швидкості\(\left(v_{n}\right)\) та орбітальної енергії\(\left(E_{n}\right)\), серед інших (див. Таблицю\(\PageIndex{1}\) для резюме).
З квантованими орбітальними енергіями для електрона ми маємо готове пояснення особливостей атомних спектрів. ЕМ-випромінювання випромінюється, коли електрон переходить від більш високого енергетичного рівня (\(E_{i}\)) до більш низького енергетичного рівня (\(E_{f}\)), при цьому фотон несе різницю енергій,
\[h f=\Delta E=E_{i}-E_{f}, \label{2} \]
\(f\)де - частота фотона. \(\PageIndex{4}\)На малюнку показано схематичне зображення цього співвідношення. При\(E_{n}\) дозволених лише дискретних значеннях енергії існують лише дискретні значення частоти (\(f\)) та довжини хвилі (\(\lambda\)), як показано в лінійних спектрах.
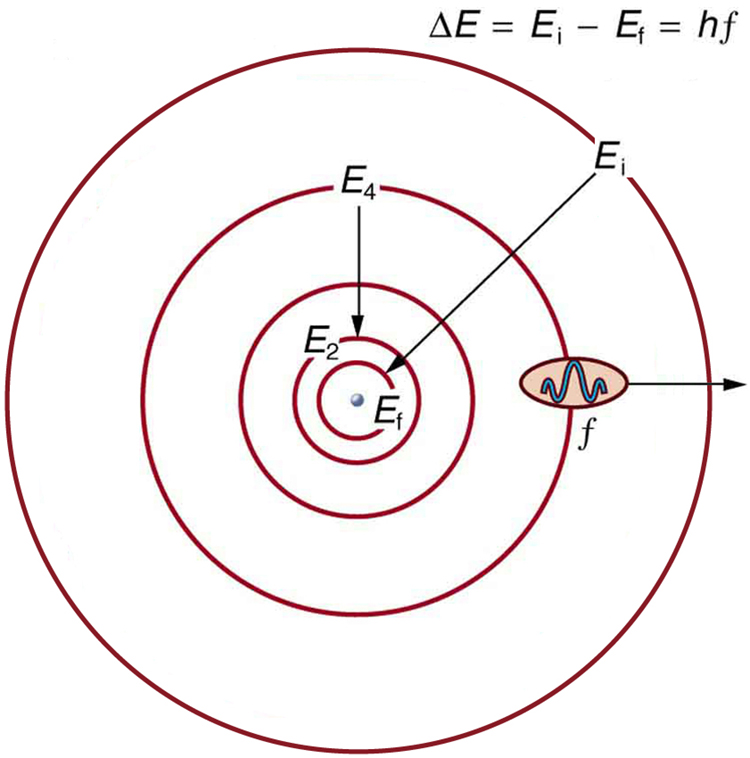

Діаграма енергетичного рівня, показана на малюнку\(\PageIndex{5}\), - ще один зручний спосіб проілюструвати ці взаємозв'язки. Дозволені рівні енергії для атома побудовані вертикально з найнижчим станом (або наземним станом) внизу і з порушеними станами вище цього. Енергії ліній в атомному спектрі відповідають відмінностям рівнів енергії на діаграмі рівнів (малюнок ілюструє перехід від\(E_{4}\) до\(E_{2}\), який би відображався в атомному спектрі як одна лінія).
| Квантована кількість | Залежність від квантового числа\(n\) | Повне вираження |
|---|---|---|
| кутовий імпульс:\(L_{n}\) | \ (n\) ">пропорційно\(n\) | \(L_{n}=n \hbar\) |
| орбітальний радіус:\(r_{n}\) | \ (n\) ">пропорційно\(n^{2}\) | \(r_{n}=\frac{n^{2} \hbar^{2}}{m k e^{2}}\) |
| орбітальна швидкість:\(v_{n}\) | \ (n\) ">пропорційно\(\frac{1}{n}\) | \(v_{n}=\frac{k e^{2}}{n \hbar}\) |
| орбітальна енергія:\(E_{n}\) | \ (n\) ">пропорційно\(\frac{1}{n^{2}}\) | \(E_{n}=-\frac{m k^{2} e^{4}}{2 n^{2} \hbar^{2}}=-\frac{13.6}{n^{2}} \mathrm{eV}\) |
Варто виділити два ключові результати. Перший - радіус Бора, або найменший орбітальний радіус\(a\), заданий для\(n=1\),
\ [\ почати {вирівнювати*}
a &=r_ {1} =\ hbar^ {2}/м k e^ {2}\\
&=0,529\ раз 10^ {-10}\ mathrm {~м}.
\ end {вирівнювати*}\]
Це прогноз моделі Бора для розміру атома, зроблений не що інше, як електричні константи, маса електрона та постійна Планка, і це теоретичне прогнозування досить добре відповідає експериментально виміряним розмірам атомів.
Другий - це виведення формули Рідберга, першої наведеної в Рівнянні\(\eqref{1}\). Щоб отримати це, ми починаємо з Рівняння\(\eqref{2}\) і підставляємо у вирази для енергій водню з таблиці\(\PageIndex{1}\):
\ [\ почати {вирівнювати*}
h f &=-\ розрив {м k^ {2} e^ {4}} {2 n_ {i} ^ {2}\ hbar^ {2}} -\ лівий (-\ frac {m k^ {2} e^ {4}}} {2 n_ {f} ^ {2}\ hbar^ {2}}\ праворуч)\
&&=\ розрив {м k^ {2} e^ {4}} {2\ hbar^ {2}}\ лівий (\ розрив {1} {n_ {f} ^ {2}}} -\ frac {1} {n_ {i} ^ {2}}\ праворуч)
\ кінець {вирівнювати*}\]
Частота\(f\) дорівнює\(c / \lambda\). Підключення цього в і рішення для в\(1 / \lambda\) той час як також заміна всіх екземплярів\(\hbar\) з\(h / 2 \pi\), ми отримуємо,
\[\frac{1}{\lambda}=\frac{2 \pi^{2} m k^{2} e^{4}}{h^{3} c}\left(\frac{1}{n_{f}}-\frac{1}{n_{i}}\right), \nonumber \]
який дає аналітичний вираз для константи Рідберга,
\[R=\frac{2 \pi^{2} m k^{2} e^{4}}{h^{3} c}=1.097 \times 10^{7} \mathrm{~m}^{-1}. \nonumber \]
На малюнку\(\PageIndex{6}\) показана діаграма енергетичного рівня для водню, яка також ілюструє, як різні спектральні ряди водню пов'язані з переходами між енергетичними рівнями.

Ми бачимо, що теорія Бора атома водню відповідає на питання, чому ця раніше відома формула описує водневий спектр. Це тому, що енергетичні рівні пропорційні\(1 / n^{2}\), де\(n\) є невід'ємне ціле число. Снизхідний перехід вивільняє енергію, і так\(n_{\mathrm{i}}\) повинно бути більше, ніж\(n_{\mathrm{f}}\). Різні серії - це ті, де переходи закінчуються на певному рівні. Для ряду Лимана\(n_{\mathrm{f}}=1\) — тобто всі переходи закінчуються в наземному стані (див. Також рисунок\(\PageIndex{6}\)). Для серії Бальмера\(n_{\mathrm{f}}=2\), або всі переходи закінчуються в першому збудженому стані; і так далі. Те, що колись було рецептом, тепер базується на фізиці, і з'являється щось нове - кутовий імпульс квантується.
Тріумфи і межі теорії Бора
Бор робив те, що ніхто не зміг зробити раніше. Він не тільки пояснив спектр водню, він правильно розрахував розмір атома з базової фізики. Деякі його ідеї широко застосовні. Електронно-орбітальні енергії квантуються у всіх атомах і молекулах. Кутовий імпульс квантується. Електрони не спіралі в ядро, як очікувалося класично. Це великі тріумфи.
Але є межі теорії Бора. Він не може бути застосований до багатоелектронних атомів, навіть таких простих, як двоелектронний атом гелію. Модель Бора - напівкласична модель. Орбіти квантуються (квантово-механічні), але вважаються простими круговими шляхами (класичними). У міру розвитку квантової механіки стало зрозуміло, що чітко визначених орбіт немає, скоріше, є «хмари» ймовірності. Теорія Бора також не пояснила, що деякі спектральні лінії є дублетами (розділеними на дві частини) при уважному розгляді. Ці недоліки розглядаються в більш пізніх, повністю квантово-механічних атомних моделей, але слід мати на увазі, що Бор не провалився. Швидше за все, він зробив дуже важливі кроки на шляху до більших знань і заклав основу.
Резюме розділу
- Планетарна модель атома зображує електрони, що обертаються навколо ядра так, як планети обертаються навколо Сонця. Бор використовував планетарну модель для розробки першої розумної теорії водню, найпростішого атома. Квантуються атомні та молекулярні спектри, а довжини хвиль водневого спектра задаються формулою
\[\frac{1}{\lambda}=R\left(\frac{1}{n_{\mathrm{f}}^{2}}-\frac{1}{n_{\mathrm{i}}^{2}}\right), \nonumber\]
де\(\lambda\) - довжина хвилі випромінюваного\(R\) ЕМ-випромінювання і постійна Рідберга, яка має значення\[R=1.097 \times 10^{7} \mathrm{~m}^{-1}. \nonumber\]
- Константи\(n_{\mathrm{i}}\) і\(n_{\mathrm{f}}\) є додатними цілими числами, і\(n_{\mathrm{i}}\) повинні бути більше ніж\(n_{\mathrm{f}}\).
- Бор правильно припустив, що енергія і радіуси орбіт електронів в атомах квантуються, причому енергія для переходів між орбітами задана
\[\Delta E=h f=E_{\mathrm{i}}-E_{\mathrm{f}}, \nonumber\]
-
де\(\Delta E\) - зміна енергії між початковою і кінцевою орбітами і\(hf\) - енергія поглиненого або випромінюваного фотона. Корисно побудувати орбітальні енергії на вертикальному графіку, який називається діаграмою енергетичного рівня.
- Бор запропонував, щоб дозволені орбіти були круговими і повинні мати квантований орбітальний кутовий імпульс, заданий
\[L=m_{e} v r_{n}=n \frac{h}{2 \pi}(n=1,2,3 \ldots), \nonumber\]
де \(L\)- момент імпульсу,\(r_{n}\) - радіус \(n\mathrm{th}\)орбіти, і \(h\)постійна Планка. - Додаткові квантовані орбітальні величини - радіус орбіти, орбітальна швидкість та орбітальна енергія - можуть бути отримані, починаючи з припущення Бора, і вони дають прогнози, узгоджені з експериментальною формулою Рідберга.
- Хоча напівкласична модель атома Бора не враховує всі експериментальні факти про атом, вона є важливим кроком до повністю квантово-механічних моделей атома.
Глосарій
- довжини хвиль водневого спектра
- довжини хвиль видимого світла від водню; можна обчислити за\(\frac{1}{\lambda}=R\left(\frac{1}{n_{\mathrm{f}}^{2}}-\frac{1}{n_{\mathrm{i}}^{2}}\right)\)
- Постійна Рідберга
- фізична константа, пов'язана з атомними спектрами з встановленим значенням\(1.097 \times 10^{7} \mathrm{~m}^{-1}\)
- подвійні щілинні перешкоди
- експеримент, в якому хвилі або частинки з одного джерела наштовхуються на дві щілини, так що результуючі інтерференції можуть спостерігатися
- Діаграма енергетичного рівня
- діаграма, яка використовується для аналізу енергетичного рівня електронів на орбітах атома
- Радіус Бора
- середній радіус орбіти електрона навколо ядра атома водню в його основному стані
- воднеподібний атом
- будь-який атом тільки з одним електроном
- енергії воднеподібних атомів
- Формула Бора для енергій електронних станів у воднеподібних атомах:\(E_{n}=-\frac{Z^{2}}{n^{2}} E_{0}(n=1,2,3, \ldots)\)
