29.8: Каталізатор впливає на механізм та енергію активації
- Page ID
- 26702
Як видно з рівняння Арренія, величина енергії активації визначає значення константи швидкості\(k\), при заданій температурі і, отже, загальну швидкість реакції.\(E_a\) Каталізатори забезпечують засіб зниження\(E_a\) і збільшення швидкості реакції. Каталізатори визначаються як речовини, які беруть участь у хімічній реакції, але не змінюються і не споживаються. Натомість вони забезпечують новий механізм реакції, яка має меншу енергію активації, ніж реакція без каталізатора.

Гомогенний каталіз відноситься до реакцій, в яких каталізатор знаходиться в розчині принаймні з одним з реагентів, тоді як гетерогенний каталіз відноситься до реакцій, в яких каталізатор присутній в іншій фазі, як правило, у вигляді твердої речовини, ніж реагенти. На малюнку Template:index показано порівняння енергетичних профілів реакції за відсутності та наявності каталізатора.
Розглянемо некаталізовану елементарну реакцію
\[\text{A} \overset{k}{\longrightarrow} \text{P} \nonumber \]
який протікає зі\(k\) швидкістю при певній температурі. Швидкість реакції може виражатися у вигляді
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] \nonumber \]
При наявності каталізатора\(\text{C}\) ми можемо записати реакцію як
\[\text{A} + \text{C} \overset{k_\text{cat}}{\longrightarrow} \text{P} + \text{C} \nonumber \]
і швидкість реакції як
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] - k_\text{cat} \left[ \text{A} \right] \left[ \text{C} \right] \nonumber \]
де перший член представляє некаталізовану реакцію, а другий - каталізовану реакцію. Оскільки швидкість реакції каталізованої реакції часто перевищує величину некаталізованої реакції (тобто\(k_\text{cat} \gg k\)), перший термін часто можна ігнорувати.
Приклад гомогенного каталізу: кислотний каталіз
Поширеним прикладом однорідних каталізаторів є кислоти і основи. Наприклад, з огляду на загальну реакцію є\(\text{S} \rightarrow \text{P}\). \(k\)Якщо ставка, то
\[\dfrac{d \left[ \text{P} \right]}{dt} = k \left[ \text{S} \right] \nonumber \]
Призначення ферменту - підвищення швидкості виробництва продукту\(\text{P}\). Рівняння кислотно-каталізованої реакції
\[\begin{align} \text{S} + \text{A}H &\overset{k_1}{\underset{k_{-1}}{\rightleftharpoons}} \text{S}H^+ + \text{A}^- \\ \text{S}H^+ + H_2 O &\overset{k_2}{\rightarrow} \text{P} + H_3 O^+ \\ H_3 O^+ + \text{A}^- &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align} \nonumber \]
Повний набір кінетичних рівнянь
\[\begin{align} \dfrac{d \left[ \text{S} \right]}{dt} &= -k_1 \left[ \text{S} \right] \left[ \text{A} H \right] + k_{-1} \left[ \text{S} H^+ \right] \left[ \text{A}^- \right] \\ \dfrac{ d \left[ \text{A} H \right]}{dt} &= -k_1 \left[ \text{S} \right] \left[ \text{A} H \right] + k_{-1} \left[ \text{S} H^+ \right] \left[ \text{A}^- \right] - k_{-3} \left[ \text{A} H \right] + k_3 \left[ H_3 O^+ \right] \left[ \text{A}^- \right] \\ \dfrac{d \left[ \text{S} H^+ \right]}{dt} &= k_1 \left[ \text{S} \right] \left[ \text{A} H \right] - k_{-1} \left[ \text{S} H^+ \right] \left[ \text{A}^- \right] - k_2 \left[ \text{S} H^+ \right] \\ \dfrac{d \left[ \text{A}^- \right]}{dt} &= k_1 \left[ \text{S} \right] \left[ \text{A} H \right] - k_{-1} \left[ \text{S} H^+ \right] \left[ \text{A}^- \right] -k_2 \left[ \text{A}^- \right] \left[ H_3 O^+ \right] + k_{-3} \left[ \text{A} H \right] \\ \dfrac{d \left[ \text{P} \right]}{dt} &= k_2 \left[ \text{S} H^+ \right] \\ \dfrac{d \left[ H_3 O^+ \right]}{dt} &= -k_2 \left[ \text{S} H^+ \right] - k_3 \left[ H_3 O^+ \right] \left[ \text{A}^- \right] + k_{-3} \left[ \text{A} H \right] \end{align} \nonumber \]
Ми не можемо легко їх вирішити, оскільки вони нелінійні. Однак розглянемо два випадки\(k_2 \gg k_{-1} \left[ \text{A}^- \right]\) і\(k_2 \ll k_{-1} \left[ \text{A}^- \right]\). В обох випадках\(\text{S} H^+\) споживається швидко, і ми можемо застосувати стале наближення:
\[\dfrac{d \left[ \text{S} H^+ \right]}{dt} = k_1 \left[ \text{S} \right] \left[ \text{A} H \right] - k_{-1} \left[ \text{A}^- \right] \left[ \text{S} H^+ \right] - k_2 \left[ \text{S} H^+ \right] = 0 \nonumber \]
Перестановка в плані\(\text{S} H^+\) врожайності
\[\left[ \text{S} H^+ \right] = \dfrac{k_1 \left[ \text{S} \right] \left[ \text{A} H \right]}{k_{-1} \left[ \text{A}^- \right] + k_2} \nonumber \]
і швидкість виробництва\(\text{P}\) може бути записана як
\[\dfrac{d \left[ \text{P} \right]}{dt} = k_2 \left[ \text{S} H^+ \right] = \dfrac{k_1 k_2 \left[ \text{S} \right] \left[ \text{A} H \right]}{k_{-1} \left[ \text{A}^- \right] + k_2} \nonumber \]
У разі\(k_2 \gg k_{-1} \left[ \text{A}^- \right]\), коли, Рівняння 29.8.17 можна записати як
\[\dfrac{d \left[ \text{P} \right]}{dt} = k_1 \left[ \text{S} \right] \left[ \text{A} H \right] \nonumber \]
який відомий як загальна кислотно-каталізована реакція. З іншого боку, якщо\(k_2 \ll k_{-1} \left[ \text{A}^- \right]\), ми можемо використовувати рівноважне наближення, щоб записати швидкість виробництва\(\text{P}\) як
\[\dfrac{d \left[ \text{P} \right]}{dt} = \dfrac{k_1 k_2 \left[ \text{S} \right] \left[ \text{A} H \right]}{k_{-1} \left[ \text{A}^- \right]} = \dfrac{k_1 k_2}{k_{-1} K} \left[ \text{S} \right] \left[ H^+ \right] \nonumber \]
де\(K\) константа дисоціації кислоти:
\[K = \dfrac{ \left[ \text{A}^- \right] \left[ H^+ \right]}{\left[ \text{A} H \right]} \nonumber \]
В даному випадку реакція каталізується іоном водню.
Приклад гетерогенного каталізу: поверхневий каталіз газофазних реакцій
Багато газофазних реакцій каталізуються на твердій поверхні. Для одномолекулярної реакції першого порядку механізм реакції можна записати як
\[\text{A} \left( g \right) + \text{S} \left( s \right) \overset{k_1}{\underset{k_{-1}}{\rightleftharpoons}} \text{AS} \left( s \right) \nonumber \]
\[\text{AS} \left( s \right) \overset{k_2}{\rightarrow} \text{P} \left( g \right) + \text{S} \left( g \right) \nonumber \]
де першим кроком є оборотна адсорбція молекули газу\(\text{A}\), на активні ділянки на поверхні каталізатора\(\text{S}\), щоб сформувати перехідний стан\(\text{AS}\), а другий крок - перетворення адсорбованих\(\text{A}\) молекул в види\(\text{P}\). Застосовуючи стаціонарне наближення до видів\(\text{AS}\), ми можемо записати
\[\dfrac{d \left[ \text{AS} \right]}{dt} = k_1 \left[ \text{A} \right] \left[ \text{S} \right] - k_{-1} \left[ \text{AS} \right]_{ss} - k_2 \left[ \text{AS} \right]_{ss} = 0 \nonumber \]
Оскільки концентрація загальних активних ділянок на поверхні каталізатора фіксується при\(\left[ \text{S} \right]_0\), концентрація адсорбованих видів на поверхні каталізатора\(\left[ \text{AS} \right]\) може бути записана як
\[\left[ \text{AS} \right] = \theta \left[ \text{S} \right]_0 \nonumber \]
і\(\left[ \text{S} \right]\) can be written as
\[\left[ \text{S} \right] = \left( 1 - \theta \right) \left[ \text{S} \right]_0 \nonumber \]
де\(\theta\) is the fractional surface coverage of species \(\text{A}\) on the catalyst surface. We can now write Equation 29.8.23 as
\[k_1 \left[ \text{A} \right] \left( 1 - \theta \right) \left[ \text{S} \right]_0 - \left( k_{-1} + k_2 \right) \theta \left[ \text{S} \right]_0 = 0 \nonumber \]
Перестановка вищевказаного рівняння через\(\theta\) yields
\[\theta = \dfrac{k_1 \left[ \text{A} \right]}{k_1 \left[ \text{A} \right] + k_{-1} + k_2} \nonumber \]
Темп виробництва\(\text{P}\) can be written as
\[\dfrac{d \left[ \text{P} \right]}{dt} = k_2 \left[ \text{AS} \right]_{ss} = k_2 \theta \left[ \text{S} \right]_0 = \dfrac{k_1 k_2}{k_1 \left[ \text{A} \right] + k_{-1} + k_2} \left[ \text{A} \right] \left[ \text{S} \right]_0 \nonumber \]
З наведеного вище рівняння ми можемо спостерігати важливість наявності високих площ поверхні для каталітичних реакцій.
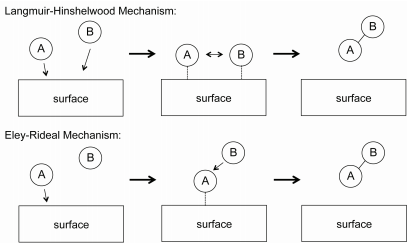
Для бімолекулярних газофазних реакцій двома загальновикористовуваними механізмами пояснення кінетики реакцій є механізми Ленгмюра-Гіншелвуда та Елея-Рідеала, показані на малюнку Template:index. У механізмі Ленгмюра-Хіншелвуда,\(\text{A}\) and \(\text{B}\) both adsorb onto the catalyst surface, at which they react to form a product. The reaction mechanism is
\[\text{A} \left( g \right) + \text{S} \left( s \right) \overset{k_1}{\underset{k_{-1}}{\rightleftharpoons}} \text{AS} \left( s \right) \nonumber \]
\[\text{B} \left( g \right) + \text{S} \left( s \right) \overset{k_2}{\underset{k_{-2}}{\rightleftharpoons}} \text{BS} \left( s \right) \nonumber \]
\[\text{AS} \left( s \right) + \text{BS} \left( s \right) \overset{k_3}{\rightarrow} \text{P} \nonumber \]
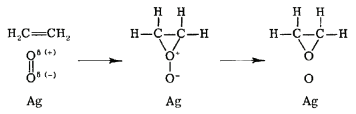
Закон швидкості для механізму Ленгмюра-Гіншелвуда можна вивести аналогічно тому, що для одномолекулярних каталітичних реакцій, припускаючи, що загальна кількість активних ділянок на поверхні каталізатора фіксована. У механізмі Eley-Rideal на поверхні каталізатора адсорбується лише один вид. Прикладом такої реакції є часткове окислення етилену в оксид етилену, як показано на малюнку Template:index. У цій реакції двоатомний кисень адсорбується на каталітичній поверхні, де він реагує з молекулами етилену в газовій фазі.
Реакції для механізму Елея-Рідеала можна записати як
\[\text{A} \left( g \right) + \text{S} \left( s \right) \overset{k_1}{\underset{k_{-1}}{\rightleftharpoons}} \text{AS} \left( s \right) \nonumber \]
\[\text{AS} \left( s \right) + \text{B} \left( g \right) \overset{k_2}{\rightarrow} \text{P} \left( g \right) + \text{S} \left( s \right) \nonumber \]
Припускаючи, що\(k_{-1} \gg k_1\), we can apply a steady-state approximation to species \(\text{AS}\):
\[\dfrac{d \left[ \text{AS} \right]}{dt} = 0 = k_1 \left[ \text{A} \right] \left[ \text{S} \right] - k_{-1} \left[ \text{AS} \right]_{ss} - k_2 \left[ \text{AS} \right]_{ss} \left[ \text{B} \right] \nonumber \]
Як і у випадку одномолекулярних каталізованих реакцій, ми можемо висловити концентрації\(\text{AS}\) and \(\text{S}\) in terms of a fraction of the total number of active sites, \(\text{S}_0\) and rewrite the above equation as
\[0 = k_1 \left[ \text{A} \right] \left( 1 - \theta \right) \left[ \text{S} \right]_0 - k_{-1} \left[ \text{S} \right]_0 - k_2 \theta \left[ \text{S} \right]_0 \left[ \text{B} \right] \nonumber \]
Рішення для\(\theta\) yields
\[\theta = \dfrac{k_1 \left[ \text{A} \right]}{k_1 \left[ \text{A} \right] + k_{-1} + k_2 \left[ \text{B} \right]} \nonumber \]
Крім того, якщо\(k_2 \ll k_1\) and \(k_{-1}\), we can simplify \(\theta\) to
\[\theta = \dfrac{k_1 \left[ \text{A} \right]}{k_1 \left[ \text{A} \right] + k_{-1}} \nonumber \]
Темп виробництва\(\text{P}\) can be expressed as
\[\dfrac{d \left[ \text{P} \right]}{dt} = k_2 \left[ \text{AS} \right]_{ss} \left[ \text{B} \right] = k_2 \theta \left[ \text{S} \right]_0 \left[ \text{B} \right] = \dfrac{k_1 k_2 \left[ \text{A} \right]}{k_1 \left[ \text{A} \right] + k_{-1}} \left[ \text{S} \right]_0 \left[ \text{B} \right] \nonumber \]
Ми також можемо записати вищевказаний вираз з точки зору константи рівноваги,\(K\), which is equal to\(k_1/k_{-1}\)
\[\dfrac{d \left[ \text{P} \right]}{dt} = K k_2 \left[ \text{B} \right] \dfrac{K \left[ \text{A} \right]}{K \left[ \text{A} \right] + 1} \nonumber \]