28.4: Різні закони швидкості передбачають різну кінетику
- Page ID
- 27379
Закони різниці швидкості прогнозують різну кінетику
Кінетика нульового порядку
Якщо реакція слідує закону швидкості нульового порядку, вона може бути виражена через часову швидкість зміни [A] (яка буде негативною, оскільки A є реагентом):
\[-\dfrac{d[A]}{dt} = k\]
У цьому випадку просто розділити змінні. Розміщення змінних часу праворуч і [A] ліворуч
\[ d[A] = - k \,dt\]
У такому вигляді його легко інтегрувати. Якщо концентрація А дорівнює [A] 0 в момент t = 0, а концентрація А [A] в якийсь довільний час пізніше, форма інтеграла дорівнює
\[ \int _{[A]_o}^{[A]} d[A] = - k \int _{t_o}^{t}\,dt\]
який дає
\[ [A] - [A]_o = -kt\]
або
\[ [A] = [A]_o -kt\]
Це говорить про те, що графік концентрації як функція часу дасть пряму лінію, нахил якої дорівнює —k, а перехоплення якої дорівнює [A] 0. Якщо такий графік лінійний, то дані узгоджуються з кінетикою 0-го порядку. Якщо їх немає, слід враховувати інші можливості.
Кінетика другого порядку
Якщо реакція слідує закону про ставку другого порядку, певна методологія може бути використана. Ставка може бути записана як
\[ -\dfrac{d[A]}{dt} = k [A]^2 \label{eq1A}\]
Поділ концентрації і тимчасових термінів (на цей раз зберігаючи негативний знак зліва для зручності) дає
\[ -\dfrac{d[A]}{[A]^2} = k \,dt \]
Тоді інтеграція стає
\[ - \int_{[A]_o}^{[A]} \dfrac{d[A]}{[A]^2} = \int_{t=0}^{t}k \,dt \label{eq1}\]
І зауваживши, що
\[ - \dfrac{dx}{x^2} = d \left(\dfrac{1}{x} \right)\]
результат інтеграції Рівняння\ ref {eq1} дорівнює
\[ \dfrac{1}{[A]} -\dfrac{1}{[A]_o} = kt\]
або
\[ \dfrac{1}{[A]} = \dfrac{1}{[A]_o} + kt\]
І тому сюжет\(1/[A]\) як функція часу повинен виробляти лінійний сюжет, нахил якого є\(k\), а перехоплення якого є\(1/[A]_0\).
Інші закони 2-го порядку трохи складніше інтегрувати, оскільки інтеграція залежить від фактичної стехіометрії досліджуваної реакції. Наприклад, для реакції типу
\[A + B \rightarrow P\]
Це має закони про ставки, наведені
\[ -\dfrac{d[A]}{dt} = k [A][B] \]
і
\[ -\dfrac{d[B]}{dt} = k [A][B] \]
інтеграція буде залежати від зменшення [A] і [B] (що буде пов'язано стехіометрією), що може бути виражено в терміні концентрації продукту [P].
\[[A] = [A]_o – [P] \label{eqr1}\]
і
\[[B] = [B]_o – [P]\label{eqr2}\]
Концентраційна залежність від\(A\) і потім\(B\) може бути усунена, якщо закон норми виражається в терміні виробництва продукту.
\[ \dfrac{d[P]}{dt} = k [A][B] \label{rate2} \]
Підстановка зв'язків для\([A]\) і\([B]\) (Рівняння\ ref {eqr1} і\ ref {eqr2}) у вираз закону швидкості (Equaration\ ref {rate2}) дає
\[ \dfrac{d[P]}{dt} = k ( [A]_o – [P]) ([B] = [B]_o – [P]) \label{rate3} \]
Поділ змінних концентрації та часу призводить до
\[\dfrac{d[P]}{( [A]_o – [P]) ([B] = [B]_o – [P])} = k\,dt\]
Відзначивши\(t = 0\), що в той час\([P] = 0\), інтегрована форма ставка закону може генеруватися шляхом вирішення інтегрального
\[\int_{[A]_o}^{[A]} \dfrac{d[P]}{( [A]_o – [P]) ([B]_o – [P])} = \int_{t=0}^{t} k\,dt\]
Консультації з таблицею інтегралів показує, що для\(a \neq b\) [1],
\[ \int \dfrac{dx}{(a-x)(b-x)} = \dfrac{1}{b-a} \ln \left(\dfrac{b-x}{a-x} \right)\]
Застосування певного інтеграла (до тих пір, поки\([A]_0 \neq [B]_0\)) призводить до
\[ \left. \dfrac{1}{[B]_0-[A]_0} \ln \left( \dfrac{[B]_0-[P]}{[A]_0-[P]} \right) \right |_0^{[A]} = \left. k\, t \right|_0^t\]
\[ \dfrac{1}{[B]_0-[A]_0} \ln \left( \dfrac{[B]_0-[P]}{[A]_0-[P]} \right) -\dfrac{1}{[B]_0-[A]_0} \ln \left( \dfrac{[B]_0}{[A]_0} \right) =k\, t \label{finalint}\]
Підстановка рівнянь\ ref {eqr1} та\ ref {eqr2} на рівняння\ ref {finalint} та спрощення (об'єднання натуральних логарифмічних членів) дає
\[\dfrac{1}{[B]_0-[A]_0} \ln \left( \dfrac{[B][A]_o}{[A][B]_o} \right) = kt\]
За цим нормовим законом, сюжет\(\ln([B]/[A])\) як функція часу буде виробляти пряму лінію, нахил якої дорівнює
\[ m = ([B]_0 – [A]_0)k.\]
У межі в\([A]_0 = [B]_0\), то\([A] = [B]\) в усі часи, за рахунок стехіометрії реакції. Таким чином, закон ставки стає
\[ \text{rate} = k [A]^2\]
і інтегрувати прямий, як у Equation\ ref {Eq1a}, а інтегрований закон швидкості є (як і раніше)
\[ \dfrac{1}{[A]} = \dfrac{1}{[A]_o} + kt\]
Приклад\(\PageIndex{2}\): Confirming Second Order Kinetics
Розглянемо наступні кінетичні дані. Використовуйте графік, щоб продемонструвати, що дані відповідають кінетиці другого порядку. Також, якщо дані другого порядку, визначте значення константи швидкості для реакції.
| час (и) | 0 | 10 | 30 | 60 | 100 | 150 | 200 |
|---|---|---|---|---|---|---|---|
| [А] (М) | 0,238 | 0.161 | 0.098 | 0.062 | 0.041 | 0.029 | 0,023 |
Рішення:
Сюжет виглядає наступним чином:
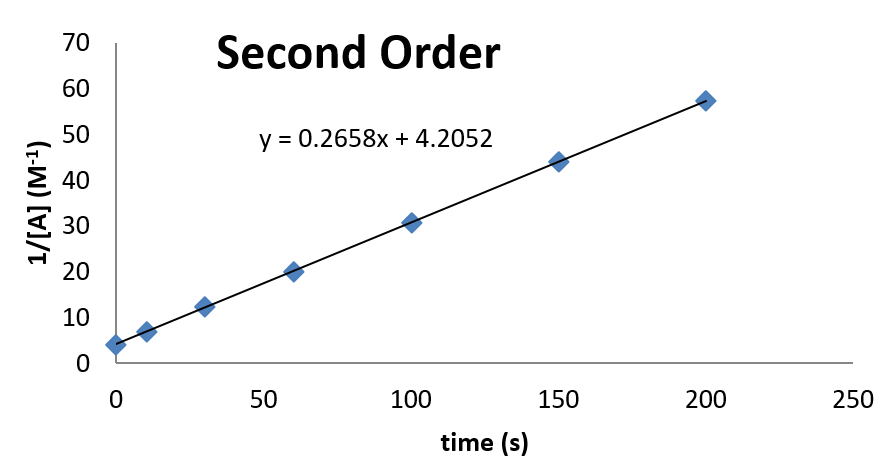
З цієї ділянки видно, що константа швидкості дорівнює 0,2658 М -1 с -1. Концентрація в часі також\(t = 0\) може бути виведена з перехоплення.
[1] Цю інтегральну форму можна генерувати за допомогою методу часткових дробів. Див. (Будинок, 2007) для повного виведення.
Пентоксид азоту (N 2 O 5) розкладається до NO 2 і O 2 при відносно низьких температурах в наступній реакції:
\( 2N_{2}O_{5}\left ( soln \right ) \rightarrow 4NO_{2}\left ( soln \right )+O_{2}\left ( g \right ) \)
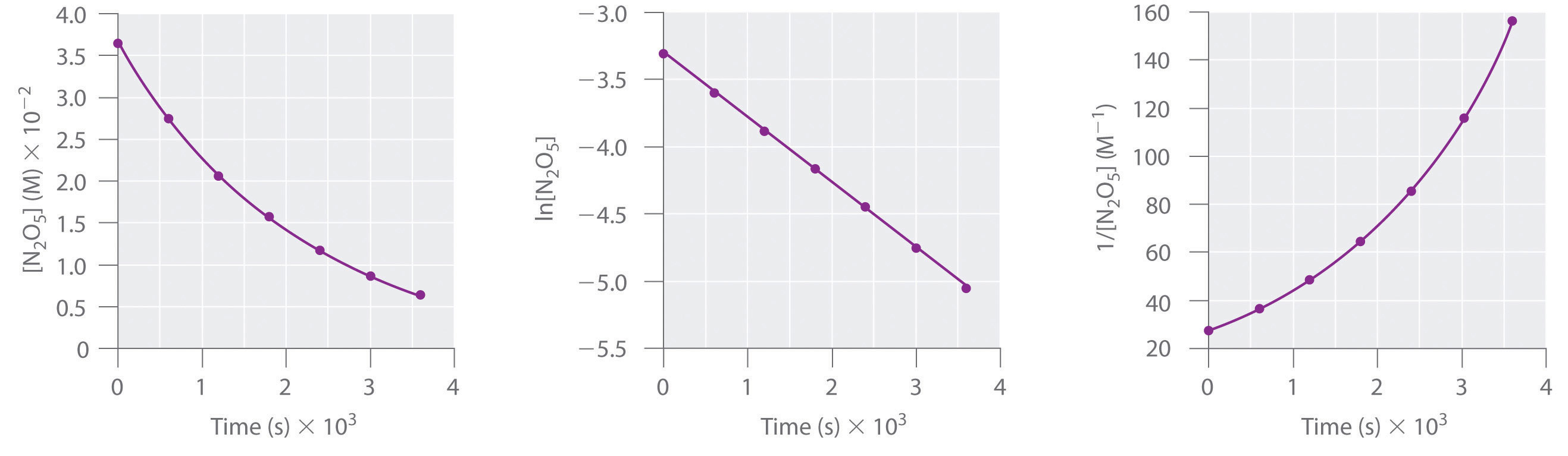
Ця реакція проводиться в розчині cCl 4 при 45°С, концентрації N 2 O 5 в залежності від часу наведені в наступній таблиці разом з природними логарифмами і зворотними концентраціями N 2 O 5. Побудувати графік концентрації проти t, ln концентрації проти t, і 1/концентрації проти t, а потім визначити закон швидкості і обчислити константу швидкості.
| Час (и) | [N 2 O 5] (М) | лн [Н 2 О 5] | 1/ [N 2 О 5] (М −1) |
|---|---|---|---|
| 0 | 0.0365 | −3.310 | 27.4 |
| 600 | 0.0274 | −3.597 | 36.5 |
| 1200 | 0.0206 | −3.882 | 48.5 |
| 1800 | 0.0157 | −4.154 | 63.7 |
| 2400 | 0.0117 | −4.448 | 85.5 |
| 3000 | 0,00860 | −4.756 | 116 |
| 3600 | 0,00640 | −5.051 | 156 |
Задано: збалансоване хімічне рівняння, час реакції та концентрації
Запитано: графік даних, закон швидкості та постійна швидкість
Стратегія:
A Використовуйте дані в таблиці, щоб окремо побудувати концентрацію, природний логарифм концентрації та зворотну концентрацію (вертикальна вісь) проти часу (горизонтальна вісь). Порівняйте графіки з графіками на малюнку 13.4.2, щоб визначити порядок реакції.
B Напишіть закон швидкості для реакції. Використовуючи відповідні дані з таблиці і лінійного графіка, відповідного закону швидкості для реакції, обчислити нахил нанесеної лінії для отримання константи швидкості для реакції.
Рішення:
A Ось ділянки [N 2 O 5] проти t, ln [N 2 O 5] проти t, і 1/ [N 2 O 5] проти t:
Ділянка ln [N 2 O 5] проти t дає пряму лінію, тоді як ділянки [N 2 O 5] проти t та 1/ [N 2 O 5] проти t не роблять. Це означає, що розкладання N 2 O 5 знаходиться в першому порядку в [N 2 O 5].
B Закон швидкості для реакції, таким чином,
\( rate = k \left [N_{2}O_{5} \right ]\)
Обчислення константи швидкості є простим, оскільки ми знаємо, що нахил ділянки ln [A] проти t для реакції першого порядку дорівнює − k. Ми можемо обчислити нахил, використовуючи будь-які дві точки, які лежать на прямій на ділянці ln [N 2 O 5] проти t. Використовуючи точки для t = 0 і 3000 с,
\( slope= \dfrac{ln\left [N_{2}O_{5} \right ]_{3000}-ln\left [N_{2}O_{5} \right ]_{0}}{3000\;s-0\;s} = \dfrac{\left [-4.756 \right ]-\left [-3.310 \right ]}{3000\;s} =4.820\times 10^{-4}\;s^{-1} \)
Таким чином k = 4,820 × 10 −4 с −1.