9.5: Склеювання та антізв'язуючі орбіталі
- Page ID
- 26861
- Характеризують склеювання та протисклеювальні молекулярні орбіталі в\(\ce{H^{+}}\)
Дві молекулярні орбіталі\(\ce{H^{+}}\) іона були створені за допомогою лінійних комбінацій атомних орбіталів (LCAO), які були створені з суми та різниці двох атомних орбіталів. У межах цього наближення j -я молекулярна орбіталь може бути виражена як лінійна комбінація багатьох атомних орбіталей {\(\phi_i\)}:
\[| \psi_J \rangle = \sum_i^N c_{J,i} | \phi_i \rangle \label{9.5.12} \]
Молекула матиме стільки молекулярних орбіталей, скільки атомних орбіталів, що використовуються в базовому наборі (\(N\)у рівнянні\(\ref{9.5.12}\)). Додавання двох атомних орбіталей відповідає конструктивній інтерференції між двома хвилями, тим самим посилюючи їх інтенсивність; збільшується щільність ймовірності міжядерних електронів. Молекулярна орбіталь, що відповідає сумі двох орбіталей H 1 s, називається комбінацією σ 1 s (частини (a) та (b) Рисунок Template:index).
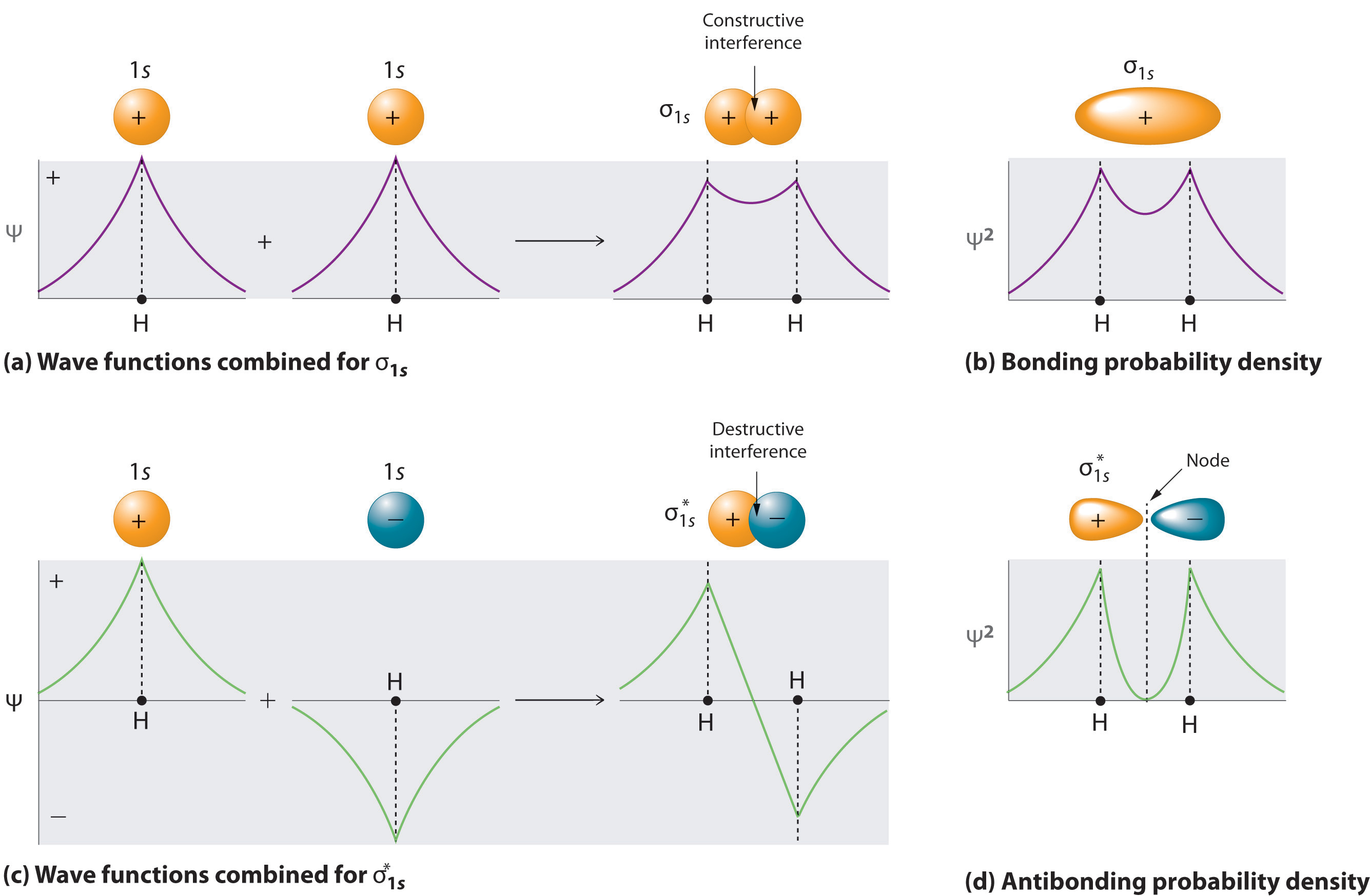
В орбіталі сигма (\(σ\)) електронна щільність по міжядерної осі і між ядрами має циліндричну симетрію; тобто всі поперечні перерізи, перпендикулярні міжядерної осі, є колами. Індексит 1 s позначає атомні орбіталі, з яких була отримана молекулярна орбіталь.
\[ | \sigma _{1s} \rangle = \dfrac{1}{\sqrt{2(1 + S )}} \left( | 1s_A \rangle + | 1s_B \rangle \right) \label{9.7.2} \]
І навпаки, віднімання однієї атомної орбіти від іншої відповідає руйнівній інтерференції між двома хвилями, що знижує їх інтенсивність і викликає зменшення щільності ймовірності міжядерних електронів (частина (c) і частина (d) на рисунку Template:index). Отриманий візерунок містить вузол, де електронна щільність дорівнює нулю. Відповідна різниці молекулярна орбіталь називається\( \sigma _{1s}^{*} \) і має область нульової електронної ймовірності, вузлову площину, перпендикулярну міжядерної осі:
\[ | \sigma _{1s}^* \rangle = \dfrac{1}{\sqrt{2(1 - S )}} \left( | 1s_A \rangle - | 1s_B \rangle \right) \label{9.7.3} \]
Електронна щільність в молекулярній орбіталі σ 1 с найбільша між двома позитивно зарядженими ядрами, а отримані електростатичні атракціони електронно-ядра зменшують відштовхування між ядрами. Таким чином, орбіталь σ 1 s являє собою склеювальну молекулярну орбіталь. Молекулярна орбіталь, яка утворюється, коли атомні орбіталі або орбітальні частки з однаковим знаком взаємодіють, щоб дати підвищену ймовірність електронів між ядрами за рахунок конструктивного посилення хвильових функцій. На відміну від цього, електрони в\( \sigma _{1s}^{\star } \) орбіталі, як правило, знаходяться в просторі поза міжядерної області. Оскільки це дозволяє позитивно зарядженим ядрам відштовхуватися один від одного,\( \sigma _{1s}^{\star } \) орбіталь - це антизв'язуюча молекулярна орбіталь (молекулярна орбіталь), яка утворюється, коли атомні орбіталі або орбітальні частки протилежного знаку взаємодіють, щоб дати знижену ймовірність електронів між ядрами через деструктивне посилення хвильових функцій).
Антизв'язуючі орбіталі містять вузол, перпендикулярний міжядерної осі; зв'язуючі орбіталі не мають.
Оскільки електрони в орбіталі σ 1 s взаємодіють одночасно з обома ядрами, вони мають меншу енергію, ніж електрони, які взаємодіють тільки з одним ядром. Це означає, що молекулярна орбіталь σ 1 s має меншу енергію, ніж будь-яка з атомних орбіталей водню 1 s. І навпаки, електрони в\( \sigma _{1s}^{\star } \) орбіталі взаємодіють тільки з одним водневим ядром одночасно. Крім того, вони знаходяться далі від ядра, ніж були в атомних орбіталах батьківського водню 1 s. Отже,\( \sigma _{1s}^{\star } \) молекулярна орбіталь має більш високу енергію, ніж будь-яка з атомних орбіталей водню 1 с. Молекулярна орбіталь σ 1 s (зв'язування) стабілізується щодо атомних орбіталів 1 s, а молекулярна орбіталь\( \sigma _{1s}^{\star } \) (антизв'язуюча) дестабілізується. Рівні відносної енергії цих орбіталів показані на діаграмі енергетичного рівня (схематичний малюнок, який порівнює енергії молекулярних орбіталів (зв'язку, антизв'язування та незв'язування) з енергіями батьківських атомних орбіталів) на рисунку Template:Index
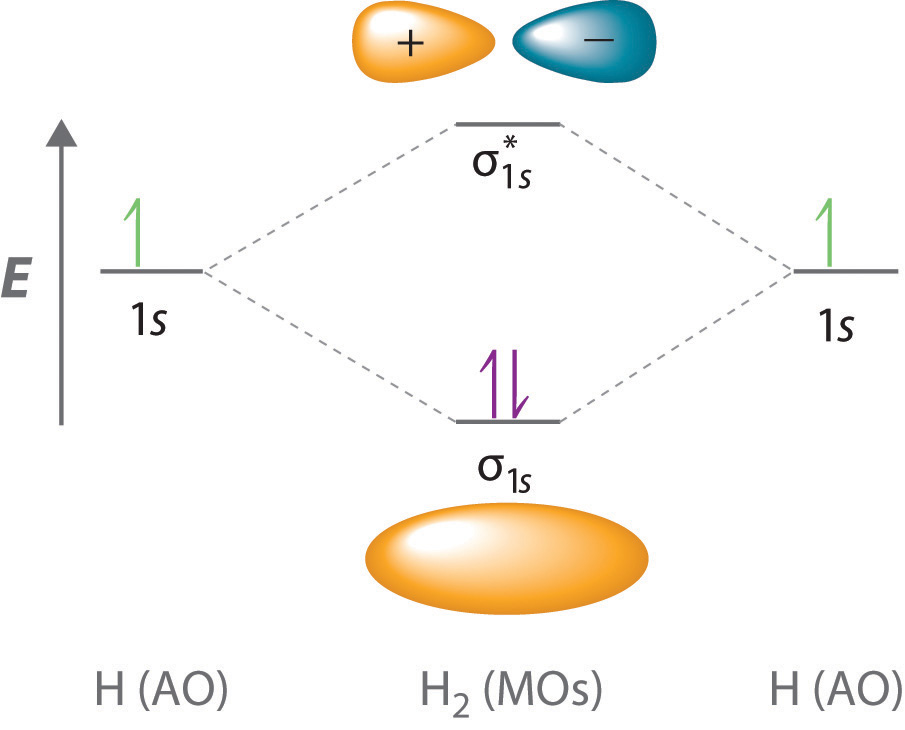
Молекулярна орбітальна зв'язок завжди нижча за енергією (більш стабільна), ніж компонент атомних орбіталів, тоді як антизв'язуюча молекулярна орбіталь завжди вища за енергією (менш стабільна).
Розширення за межі 1-го орбітального базового набору
Ця картина склеювання в Н 2 + в попередньому розділі дуже проста, але дає розумні результати при порівнянні з точним розрахунком. Відстань рівноважного зв'язку становить 134 вечора порівняно з 106 пм (точна), а енергія дисоціації становить 1,8 еВ порівняно з 2,8 еВ (точна). Для кращого опису хімічного зв'язку нам потрібно враховувати збільшення електронної густини між двома ядрами. Самі по собі орбіталі 1s не особливо хороші для цієї мети, оскільки вони сферично симетричні і не показують переваги простору між атомними ядрами. Використання додаткових атомних орбіталей дозволяє виправити цю ситуацію і забезпечити додаткові параметри, які можна оптимізувати лінійним варіаційним методом, щоб дати кращу функцію з меншою енергією і більш точним описом щільності заряду.
Енергію ненормованої молекулярної орбіти можна обчислити за інтегралом очікуваного значення гамільтоніана,
\[E_{J} = \dfrac{\left \langle \psi _{J} | \hat {H} _{elec} | \psi _{J} \right \rangle}{\left \langle \psi _{J} | \psi _{J} \right \rangle} \label {9.5.13} \]
Це варіаційна енергія, яка використовує в\(| \psi _{J} \rangle\) якості хвильової функції сліду. Після підстановки розширення LCAO для\(| \psi _{J} \rangle\) (Equation\ ref {9.5.12}) в енергетичний вираз Equation\ ref {9.5.13} призводить до:
\[\begin{align} E_{J} &= \dfrac{\left \langle \displaystyle \sum_i c_{J,i}^* \phi_i \right | \hat {H} _{elec} \left | \displaystyle \sum_j c_{J,i} \phi_j \right \rangle}{\left \langle \displaystyle \sum_i c_{J,i}^* \phi_j | \displaystyle \sum_j c_{J,j} \phi_j\right \rangle} \label {9.5.14} \\[4pt] &= \dfrac{ \displaystyle \sum_{i,j} c_{J,i}^* c_{J,j} \left \langle \phi_i \right| \hat {H} _{elec} \left| \phi_j \right \rangle}{ \displaystyle\sum_{i,j} c_{J,i}^* c_{J,j} \left \langle \phi_i | \phi_j\right \rangle} \label {9.5.15} \\[4pt] &= \dfrac{ \displaystyle \sum_{i,j} c_{J,i}^* c_{J,j} H_{ij}}{ \displaystyle \sum_{i,j} c_{J,i}^* c_{J,j} S_{ij} } \label {9.5.16} \end{align} \]
де\(H_{ij}\) - елемент гамільтонової матриці.
\[H_{ij} = \langle \phi_i | \hat {H} _{elec} | \phi_j \rangle \nonumber \]
Слідуючи варіаційній теоремі, щоб визначити коефіцієнти розширення LCAO\(c_i\), нам потрібно мінімізувати\(E_J\)
\[ \dfrac{\partial E_J}{\partial c_k} = 0 \label{9.5.17} \]
для всіх\(k\). Це вимагає рішення\(N\) лінійних рівнянь, щоб триматися істинно (де\(N\) число атомних орбіталей в основі)
\[ \sum_{i=1}^{N} c_i (H_{ki} - ES_{ki}) = 0 \label{9.5.18} \]
Ці рівняння є світськими рівняннями і обговорювалися раніше в контексті наближення лінійного варіаційного методу. Для двох базових множин розширення (\(N\)) на малюнку Template:index, це
\[\begin{array}{rcl} c_1(H_{11} - ES_{11}) + c_2(H_{12} - ES_{12}) & = & 0 \\ c_1(H_{12} - ES_{12}) + c_2(H_{22} - ES_{22}) & = & 0 \end{array} \label{9.5.19} \]
де\(c_1\) and \(c_2\) are the coefficients in the linear combination of the atomic орбіталі використовуються для побудови молекулярної орбіталі. Запис цієї множини однорідних лінійних рівнянь у матричній формі дає
\[\begin{pmatrix} H_{11} - ES_{11} & H_{12} - ES_{12} \\ H_{12} - ES_{12} & H_{22} - ES_{22} \end{pmatrix} \begin{pmatrix} c_1 \\ c_2 \end{pmatrix} = \begin{pmatrix} 0 \\ 0 \end{pmatrix} \label{9.5.20} \]
Розв'язування цих світських рівнянь з N різними атомними орбіталями в розширенні (Equation\(\ref{9.5.12}\)) вимагає знаходження N коренів полінома N порядку.
\[\left|\begin{array}{lcc} H_{11} - ES_{11} & H_{12} - ES_{12} & \ldots\\ H_{12} - ES_{12} & H_{22} - ES_{22} &\ldots \\ \ldots &\ldots &\ldots \end{array}\right|=0\label{23} \]
Кожна молекулярна орбіталь (\(| \psi_J \rangle\)) з цього лікування має енергію,\(E_J\) яка задається різним набором коефіцієнтів,\(\{c_{ij}\}\) де\(i\) проходить над усіма\(N\) функціями в основі (тобто число атомних орбіталів у наближенні LCAO Рівняння\(\ref{9.5.12}\)), і \(J\)проходить по молекулярних орбіталів. Розв'яжіть набір лінійних рівнянь, використовуючи це\(E_J\) специфічне для визначення\(c_{ij}\) значень.
- Виберіть набір N базисних функцій
- Визначити всі N (N —1) /2 значення обох\(H_{ij}\) і\(S_{ij}\)
- Сформувати світський детермінант; визначити N\(E_j\) коренів світського рівняння
- Для кожного\(E_J\) розв'язання множини лінійних рівнянь для визначення базової множини коефіцієнтів\ (c_ {ij\}) для j-й молекулярної орбіталі
Більш детальну інформацію про розв'язування світських рівнянь дивіться тут.
Чим більша кількість атомних орбіталів\(N\), які об'єднуються для генерації молекулярних орбіталів (Equation\(\ref{9.5.12}\)), тим точніше наближення LCAO. Це очікується на основі наших обговорень прикладів варіаційного методу. Отже,\(\psi_+\) і\(\psi_-\)\(H_2^+\) молекулярні орбіталі для краще виражені з більш високими енергетичними гідрогенними хвильовими функціями
\[| \psi_J \rangle = c_{J,1} 1s_A + c_{J,2} 1s_B + c_{J,3} 2s_A + c_{J,4} 2s_B + c_{J,5} 2p_{z,A} + c_{J,6} 2p_{z,B} \label{9.5.24} \]
Причини того, що тільки\(p_z\) атомні орбіталі включаються в це розширення, розглядаються далі.