12.10: Каталіз
- Page ID
- 21141
Існує багато прикладів реакцій, які включають каталіз. Той, який має нинішнє значення для хімії навколишнього середовища, є каталітичне розкладання озону (Fahey, 2006). Загальна реакція
\[ O_3 + O^{\cdot} \xrightarrow{} 2 O_2\]
може каталізуватися атомним хлором за наступним механізмом.
\[ O_3 + Cl \xrightarrow{k_1} ClO + O_2\]
\[ ClO + O \xrightarrow{k_1} Cl + O_2\]
Швидкість зміни проміжної (\(ClO\)) концентрації задається
\[ \dfrac{[ClO]}{dt} = k_1 [ O_3][Cl] - k_2 [ClO][O]\]
Застосування наближення сталого стану до цього співвідношення та розв'язування для\([ClO]\) вироблених
\[ClO] =\dfrac{[O_3][Cl]}{k_2[O]} \label{clo}\]
Швидкість вироблення\(O_2\) (яка в два рази перевищує швидкість реакції) задається
\[\dfrac{d[O_2]}{dt} = k_2[O_3][Cl] + k_2[ClO][O]\]
Підстановка виразу для\([ClO]\) (Equation\ ref {clo}) у вищевказаний вираз дає
\[\dfrac{d[O_2]}{dt} = k_2[O_3][Cl] + k_2 \left(\dfrac{[ O_3][Cl]}{k_2[O]} \right) [O]\]
\[ = k_1 [O_3[Cl] + k_1[O_3][Cl]\]
\[ = 2k_1[O_3][Cl]\]
І тому швидкість реакції прогнозується бути першого порядку в\([O_3]\), першого порядку в каталізаторі\([Cl]\), і другого порядку в цілому.
\[\text{rate} = k[O_3][Cl]\]
Якщо концентрація каталізатора постійна, кінетика реакції зменшиться до першого порядку.
\[\text{rate} = k[O_3]\]
Цей каталітичний цикл можна представити на наступній схемі:
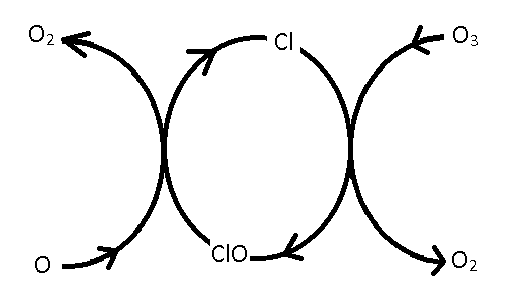
Ліворуч атомарний кисень забирає атом кисню, утворюючи\(O_2\) і генеруючи\(Cl\) атом, який потім може\(O_3\) реагувати з утворенням\(ClO\) і\(O_2\) молекулою.\(ClO\) Замкнутий контур посередині характерний для каталітичного циклу за участю\(Cl\) і\(ClO\). Крім того, оскільки\(Cl\) діє як каталізатор, він може розкладати багато\(O_3\) молекул, не руйнуючись через побічні реакції.
Введення атомів хлору у верхню атмосферу є основною екологічною проблемою, що призводить до щорічного витончення та можливого відкриття озонового шару над Антарктидою. Джерелом хлору є розкладання хлорфторуглеродів, які використовуються як холодоагенти та пропелленти завдяки їх неймовірній стійкості поблизу поверхні Землі. Однак у верхній атмосфері ці сполуки піддаються ультрафіолетовому випромінюванню, що випромінюється сонцем, і розкладаються з утворенням радикалів, відповідальних за каталітичне розкладання озону. Світова спільнота вирішила це питання шляхом розробки Монреальського протоколу (Секретаріат, 2015), який зосереджувався на викиді озоноруйнуючих сполук. Результат цієї дії приніс докази загоєння озонових дір Антарктики (K, 2015). Це один дуже хороший приклад науково орієнтованої політичної, промислової та економічної політики, що призводить до позитивних змін для нашого середовища.
