12.2: Профілі концентрації для деяких простих механізмів
- Page ID
- 21126
Щоб проілюструвати, як механізми можуть впливати на профіль концентрації реакції, ми можемо вивчити деякі прості механізми
\(A \rightarrow B\)
При цьому типі реакції одна речовина просто перетворюється в інше. Прикладом цього типу реакції може бути ізомеризація метилізоціаніду з утворенням ацетонітрилу (метилціаніду) (Redmon, Purvis, & Bartlett, 1978). Якщо механізм реакції складається з однієї одномолекулярної стадії, яка характеризується постійною швидкості\(k_1\):
\[ A \xrightarrow{k_1} B\]
то швидкість зміни концентрацій\(A\) і\(B\) може бути записана
\[\dfrac{d[A]}{dt} = - k_1 [A]\]
і
\[\dfrac{d[B]}{dt} = + k_1 [A]\]
Графік концентрації як функція часу виглядатиме наступним чином:

Можна легко побачити, що концентрація реагенту (А) зменшується з плином часу вперед, а концентрація продукту (B) збільшується. Це триватиме до тих пір, поки реагент А не буде виснажений.
\(A \rightleftharpoons B\)
Коли система зможе встановити рівновагу, швидкість зміни концентрації А і В буде залежати як від прямої, так і зворотної реакцій. Якщо k 1 - константа швидкості, яка характеризує пряму реакцію
\[ A \xrightarrow{k_1} B\]
і k -1 те, що характеризує реверс
\[ B \xrightarrow{k_{-1}} A\]
швидкість зміни концентрацій А і В може бути виражена
\[\dfrac{d[A]}{dt} = - k_1 [A] + k_{-1} [B]\]
і
\[\dfrac{d[B]}{dt} = + k_1 [A] - k_{-1} [B]\]
Профіль концентрації для цієї ситуації виглядає наступним чином:
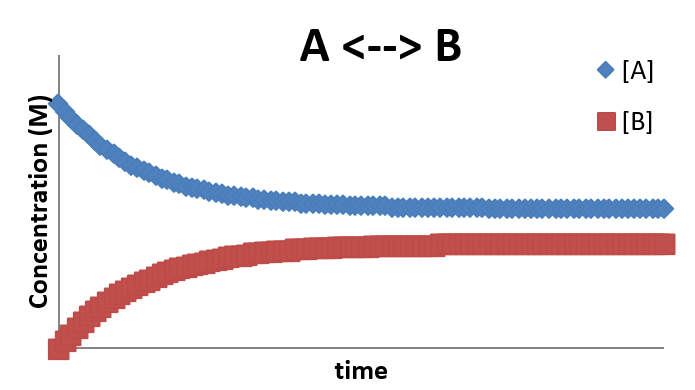
Цей профіль характеризується тим, що через певний проміжок часу система досягає рівноваги і концентрації перестають змінюватися (навіть незважаючи на те, що пряма і зворотна реакції все ще відбуваються. Це природа динамічної рівноваги, про яку ми говоримо про час в хімії. Кінцеві концентрації [A] і [B] після встановлення рівноваги будуть залежати від співвідношення k 1 і k -
Так як швидкість утворення\(A\) (від зворотного кроку) дорівнює нормі споживання\(A\) (від поступового кроку, то загальна швидкість зміни концентрації А дорівнює нулю після встановлення рівноваги. Так що повинно бути зрозуміло, що
\[k_1[A] = k_{-1}[B]\]
або
\[\dfrac{k_1}{k_{-1}} = \dfrac{[B]}{[A]}\]
а відношення f\(k_1\) до\(k_{-1}\) дає значення постійної рівноваги!
\(A + C \rightarrow B + C\)
Деякі реакції вимагають каталізатора для опосередкування перетворення реагентів у продукти. Визначення каталізатора - це вид, який потрібно додати (він не формується як проміжний), з'являється в механізмі (як правило, на дуже ранньому етапі), і це закінчується як частина закону швидкості, але пізніше реформується, щоб він не відображався в загальній стехіометрії. Якщо реакція
\[A \rightarrow B\]
допомагає каталізатор\(C\), то один можливий (одноступінчастий) механізм реакції може бути
\[A + C \rightarrow B + C\]
В даному випадку\(C\) виступає каталізатором реакції. Швидкість зміни концентрацій можна дізнатися по
\[\dfrac{[A]}{dt} = -k [A][C]\]
\[\dfrac{[B]}{dt} = k [A][C]\]
\[\dfrac{[C]}{dt} = - k [A][C] + k [A][C] = 0\]
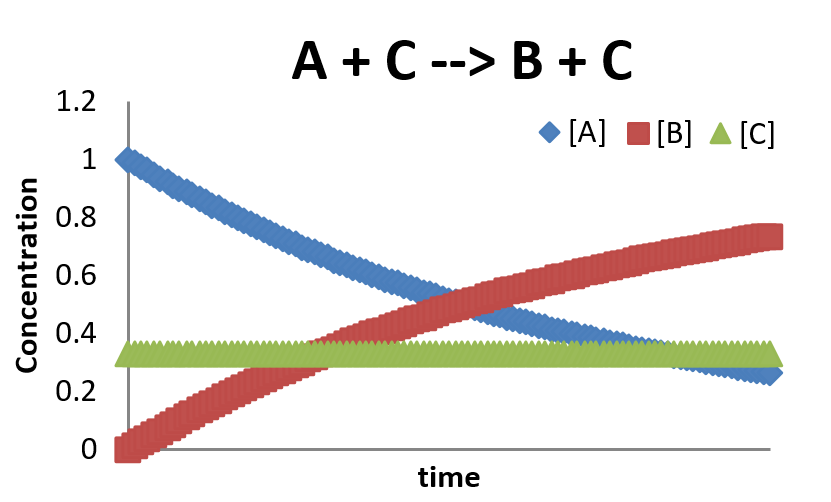
Це дуже спрощена картина каталізованої реакції. Як правило, для каталізованої реакції потрібно щонайменше два етапи:
\[A +C \rightarrow AC\]
\[AC \rightarrow B + C\]
Пізніше ми побачимо, як стаціонарне наближення насправді прогнозує вищезображений профіль концентрації для двоступеневого механізму, коли\(AC\) це короткочасний вид, який можна розглядати як постійну та малу концентрацію.
\(A \rightarrow B \rightarrow C\)
Ще одна важлива (і дуже поширена) механістична особливість - формування проміжного. Це вид, який утворюється хоча б в одному з кроків механізму, але не фігурує в загальній стехіометрії для реакції. Це відрізняється від каталізатора, який необхідно додати для прискорення реакції. Простим прикладом механізму реакції, що передбачає утворення каталізатора, є
\[ A \xrightarrow{k_1} B\]
\[ B \xrightarrow{k_2} C\]
У цьому випадку\(C\) не може утворюватися до тих пір, поки не буде\(B\) створена помітна концентрація проміжного елемента першим кроком механізму.
Швидкість зміни концентрацій\(A\)\(B\), і\(C\) може бути виражена
\[\dfrac{[A]}{dt} = -k_1 [A]\]
\[\dfrac{[B]}{dt} = k_1 [A] - k_2 [B]\]
\[\dfrac{[C]}{dt} = k_2 [B]\]
Потім профіль концентрації показаний нижче. Зверніть увагу на затримку в утворенні\(C\).

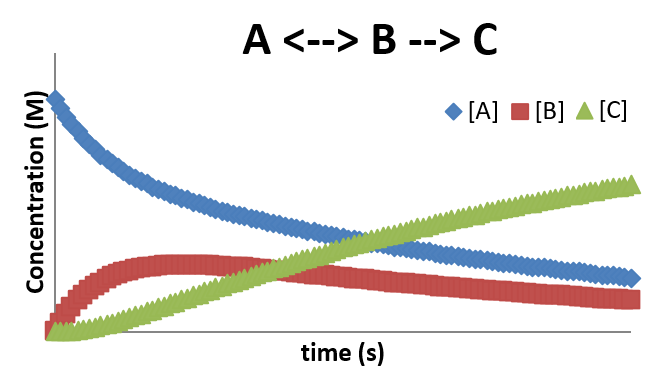
\(A \rightleftharpoons B \rightarrow C\)
У багатьох випадках формування проміжного має на увазі оборотний крок. Цей крок іноді називають кроком попереднього рівноваги, оскільки він часто встановлює близьку рівновагу, поки реакція прогресує. Результат поєднання попереднього рівноваги з проміжним дає профіль, який показує особливості обох більш простих механізмів. Прикладом такого механізму є
\[ A \xrightleftharpoons [k_1]{k_{-1}} B\]
\[ B \xrightarrow{k_2} C\]
При цьому швидкість зміни концентрацій\(A\)\(B\), і\(C\) може виражатися
\[\dfrac{[A]}{dt} = -k_1 [A] + -k_{-1} [B]\]
\[\dfrac{[B]}{dt} = k_1 [A] -k_{-1} [B] - k_2 [B]\]
\[\dfrac{[C]}{dt} = k_2 [B]\]
Профіль концентрації для цього механізму наведено нижче. Знову ж таки, зверніть увагу на затримку у виробництві продукту\(C\), через вимогу, щоб концентрація В була досить високою, щоб другий крок відбувався з помітною швидкістю.
\(A \rightarrow B\)і\(A \rightarrow C\)
Є багато випадків, коли реагент може слідувати шляхами до різних продуктів (а іноді навіть одних і тих же продуктів!) , і ці шляхи конкурують один з одним. Прикладом може служити наступний простий механізм:
\[ A \xrightarrow{k_{-1}} B\]
\[ A \xrightarrow{k_2} C\]
При цьому швидкість зміни концентрацій може виражатися як
\[\dfrac{[A]}{dt} = -k_1 [A] + -k_2 [A] \]
\[\dfrac{[B]}{dt} = + k_1 [A] \]
\[\dfrac{[C]}{dt} = + k_2 [A]\]
Загалом, профіль виглядає як два розкладання першого порядку, що відбуваються одночасно, при цьому кінцева концентрація продукту формується з більшою постійною швидкістю.

Однією з цілей вивчення хімічної кінетики є розуміння того, як змінити стан реакції, щоб сприяти виробництву бажаних продуктів реакції. Це може бути досягнуто за допомогою ряду засобів, таких як зміна концентрацій, температури, додавання каталізаторів тощо Розуміння основ призведе до кращого розуміння того, як профілі концентрації можуть бути змінені шляхом зміни умов.
