9.7: Метод лампочки Дюма для вимірювання рівноваги розкладання
- Page ID
- 21008
Класичний приклад експерименту, який використовується в багатьох лабораторних курсах фізичної хімії, використовує метод лампочки Дюма для вимірювання дисоціації N 2 O 4 (g) в залежності від температури (Mack & France, 1934). У цьому експерименті скляна колба використовується для створення ємності постійного обсягу, в якій летюча речовина може випаровуватися, або досягти рівноваги з іншими присутніми газами. Останній представляє інтерес у випадку реакції.
\[N_2O_4(g) \rightleftharpoons 2 NO_2(g) \label{eq1}\]
Реакція ендотермічна, тому при більш високих температурах спостерігається більший ступінь дисоціації.
Процедура полягає в тому, щоб спочатку калібрувати внутрішній об'єм колби Дюма. Це робиться за допомогою важкого газу (наприклад, SF 6) і порівняння маси колби при евакуації до маси колби, повної калібраним газом при певному тиску і температурі.
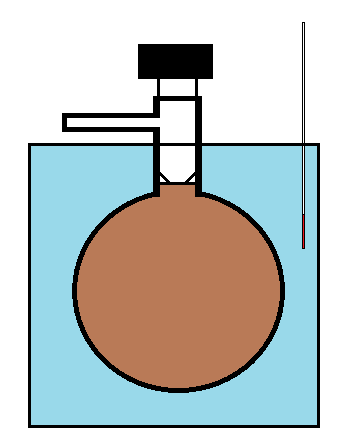
Потім лампочку Дюма заряджають чистим зразком досліджуваного газу (наприклад, N 2 O 4) і поміщають у термалізовану ванну. Потім дозволяється прийти до рівноваги. Після встановлення рівноваги запірний кран відкривають, щоб газ виходив до тих пір, поки внутрішній тиск не буде встановлено на тиск приміщення. Потім запірний кран закривають і колбу зважують, щоб визначити загальну масу газу, що залишився всередині. Експеримент повторюється при більш високих і високих температурах (так що при кожному наступному вимірі більша ступінь дисоціації створює більше молекул газу і збільшення тиску в колбі (поряд з більш високою температурою), що потім призводить до вигнання газу при тиску врівноважений.
Ступінь дисоціації потім визначається виходячи з розрахункової щільності газу при кожній температурі.
\[ \alpha = \dfrac{\rho_1-\rho_2}{\rho_2(n-1)}\]
де\(\rho_1\) - виміряна щільність і\(\rho_2\) теоретична щільність, якщо дисоціації не відбувається (обчислюється з ідеального закону газу для заданої температури, тиску і молярної маси дисоціюючого газу) і\(n\) є кількістю фрагментів, в які дисоціює газ (т. г.,\(n = 2\) для рівняння\ req {eq1}). Константа рівноваги потім обчислюється як
\[ K = \dfrac{4 \alpha^2}{1-\alpha^2} \left( \dfrac{p}{1.00 \,atm} \right)\]
Нарешті, генерується графік Ван не Гоффа для визначення ентальпії реакції.
