5.2: Визначення енантіомерної або ізомерної чистоти активних фармацевтичних інгредієнтів
- Page ID
- 19456
Цей документ містить два окремих додатки, які обговорюють використання кількісних вимірювань ЯМР для аналізу енантіомерной або ізомерної чистоти фармацевтичних сполук.
Додаток 1. Q-ЯМР для визначення енантіомерної чистоти фармацевтичних інгредієнтів
Енантіомерна чистота (EP) має важливе значення при розробці активних фармацевтичних інгредієнтів (API) фармацевтичною промисловістю. Для деяких препаратів енантіомери API можуть виробляти різко різні фармакологічні реакції. Enantiomeric чистота зазвичай визначається шляхом здійснення хірального поділу, однак, хіральні поділи можуть займати багато часу і, як правило, передбачають використання дорогих хіральних колонок. Хоча неможливо відрізнити енантіомери безпосередньо з ЯМР, дериватизація з утворенням діастереомерів виробляє молекули з чіткими спектрами ЯМР. 1 Визначення ЕП за допомогою ЯМР за допомогою хіральних сольватуючих агентів (CSA) полегшує необхідність хімічної дериватизації або стандартів. CSA взаємодіють з енантіомерами в розчині, утворюючи перехідні діастереомери. Про використання CSA в ЯМР вперше повідомила в 1966 році Піркл. 2 CSA, що використовується в цьому дослідженні, був 1,1'-бінафтол показаний як сполука 1 на малюнку 1. Відомо, що ця сполука розчиняє хіральні аміни, такі як сполуки 2-5, показані нижче. Деякі хіральні сполуки на малюнку 1 призначаються клінічно для лікування таких розладів, як депресія і тривожність (наприклад, 2, Золофт ® і 3, Паксил ®). З'єднання 5, фенфлурамін, було компонентом препарату проти ожиріння Fen-Phen, який був вилучений з ринку США після повідомлень, пов'язаних з ураженням серця.
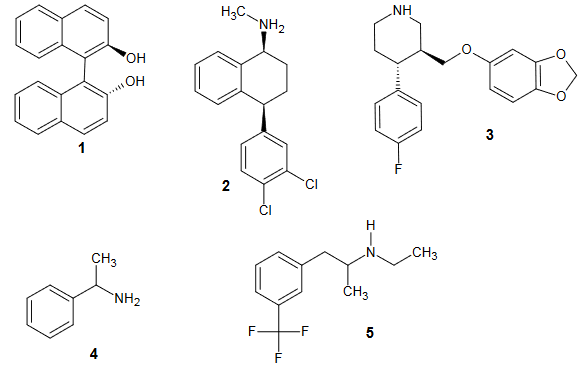
Малюнок 1. Структури (1) хірального сольвуючого агента (R) -1,1'-бі-2-нафтолу, (2) (+) -сертраліну HCl, (3) (-) -пароксетину HCl, (4) рацемічного метилбензиламіну та (5) рацемічного фенфлураміну HCl.
Енантіомерное поділ за ЯМР засноване на внутрішніх відмінностях в діастереомерних комплексах, що утворюються і/або відмінності в кінетиці асоціації рівноваг нижче:
\[\mathrm{E + S \rightleftharpoons ES}\]
\[\mathrm{E’ + S \rightleftharpoons E’S}\]
де S представляє молекулу CSA, тоді як E і E' представляють різні розчинені енантіомери. 3
В експериментах Salsbury et al. для визначення енантіомерної чистоти API, фенфлураміну, серталіну та пароксетину, а також модельної сполуки, метилбензиламіну (MBA, з'єднання 4 на малюнку 1), аналіти були розчинені в CdCl 3 та хімічні зрушення, пов'язані з тетраметилсиланом (TMS). 1 Спектри ЯМР 1 H, що використовуються для визначення меж виявлення та кількісного визначення, вимірювали за допомогою 64 перехідних процесів, кута нахилу 30°, затримки релаксації 1 с та розширенням лінії 0,3 Гц. Призначення хімічного зсуву протонів були підтверджені за допомогою COSY. Зважували стандарти (1-4 мг) та готували розчини CdCl 3, що містять відповідне молярне співвідношення аналіту та 1,1'—бінафтолу. Здатність взаємодії CSA розсмоктувати суміші енантіомерів оцінювалася за допомогою сумішей MBA. Використовуючи стандарти метилбензиламіну в різних концентраціях для отримання калібрувальної кривої, межа кількісного визначення була визначена нижче 1% від другорядного компонента. Аналіз рацемічного фенфлураміну показав, що він містив 50,2 ± 0,4% S-енантіомер. Хоча хіральну ВЕРХ не можна було проводити для фенфлураміну або сертраліну без дериватизації, аналіз енантіомерів пароксетину проводився як ЯМР, так і ВЕРХ, що дає результати 7,5 ± 0,3% та 8,5% відповідно.
Посилання
- Солсбері, Дж. С. і Ісбестер, П.К. Магн. Причина. Хім. 2005, 43, 910-917
- Піркл, А.М. Хім. Соц. 1966, 88, 1837
- Піркл, W. H. і Гувер, D.J. Топ. Стерхім. 1982, 13, 263
Додаток 2. Q-ЯМР для кількісного визначення вмісту ізомеру E/Z флувоксаміну
Флувоксамін є антидепресантом з двома можливими ізомерними структурами, як показано на малюнку 1 нижче. Активність флувоксаміну знаходиться в Е-ізомері (рис. 1А). Однак Z-ізомер (рис. 1B) зустрічається у всіх шляхах синтезу. Транспортні білки можуть розрізняти Е- і Z-ізомери. Британська Фармакопея обмежує вміст Z-ізомеру до 0,5%. Описаний метод QNMR вимірює Z-ізомер до рівня 0,2% в 15 мг лікарської речовини.

Малюнок 1. Структури (A) (E) -флувоксаміну та (B) (Z) -флувоксаміну. Фармацевтична рецептура доступна у вигляді малеатної солі флувоксаміну. Нумерація атомів корелює з спектром ЯМР, повідомленим у довідці.
Перевагою Q-ЯМР для визначення вмісту Z-ізомеру є мінімальна необхідна підготовка проб. У цьому прикладі 15 мг матеріалу розчиняли в дейтрованому метанолі, який також використовувався як посилання на хімічний зсув 1 H (3.31 ppm). 1 1 H ЯМР-спектри були отримані шляхом коприєднання 128 перехідних процесів на спектральній ширині 4595 Гц. FID були аподизовані множенням з експоненціальною функцією, еквівалентною розширенню лінії 0,3 Гц. Для кількісного визначення протонні резонанси С-2 ізомерів флувоксаміну Z- (2,62 ppm) та E- (2,90 ppm) інтегрували вручну та порівнювали значення.
Перед проведенням кількісних вимірювань необхідно було визначити межі кількісного визначення і виявлення для кожного ізомера. Хоча чистий Е-ізомер був комерційно доступний, чистий Z-ізомер не був. Натомість автори мали доступ лише до суміші 1:1 (E/Z). Тому вихідний розчин, що містить 5,13% (Z) флувоксаміну, готували шляхом змішування відповідних кількостей чистої суміші Е та Е/З. Серійні розведення були зроблені з цього складського розчину для аналізу ЯМР. З кожним розведенням концентрації Е- і Z-ізомерів зменшувалися, але вміст %Z залишався на рівні 5,13%. Для спектра, виміряного в кожній концентрації, тричі проводилося ручне інтегрування протонних резонансів С-2 (Z) та C-2 (E). Різниця між розрахунковими та визначеними значеннями вмісту Z-ізомеру становила менше 5% при концентраціях до 0,07 мг/л, більша відхилення від розрахункових значень спостерігалося при більш низьких концентраціях Z-ізомеру. На підставі цих експериментів були визначені межі кількісного визначення і виявлення 0,07 мг/л і 0,018 мг/л відповідно. Для визначення лінійності в трьох примірниках вимірювали набір сумішей, що містять 0-10% Z-ізомеру. Встановлено, що коефіцієнт кореляції калібрувального графіка дорівнює 0,9999 з коефіцієнтом нахилу 0,9923. Оскільки британські тести Фармакопеї вимагають, щоб вміст Z був менше 0,5%, готували розчини, що містять 0,15-1,01% Z-ізомеру. ЯМР-спектри вимірювалися в трьох примірниках і кожен спектр інтегрований три рази. Лінійний регресійний аналіз дав коефіцієнт кореляції 0,994 з нахилом 1,042, що вказує на те, що аналіз Q-ЯМР є лінійним над цією концентрацією. Виявлено, що метод Q-ЯМР є точним, чутливим та економічним методом для визначення вмісту Z- флувоксаміну.
Довідка
- Дебнер, Р. і Хольцграбе, У.Магн. Причина. Хім. 2002, 40, 762-766
