4.4: Усунення
- Page ID
- 25186
Скелетні перебудови є недоліком впливу субстратів до умов, в яких виходить група іонізується. На жаль, вони не є єдиним ускладненням - існує також ймовірність того, що може виникнути інший тип реакції - усунення для отримання алкена.
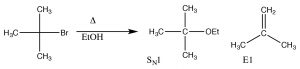
У цьому випадку реакція протікає через той же карбокатіонний проміжний продукт, а потім з вуглецю виводиться протон поруч з карбокатом (\(\beta\)вуглецем).
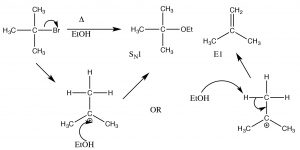
Реакція елімінації Е1
Це називається реакцією елімінації, і це перший порядок, оскільки етапом визначення швидкості є утворення карбокатіону, і тому це\(\mathrm{E} 1\) реакція. Насправді\(\mathrm{S}_{\mathrm{N} 1\) реакції часто супроводжуються\(\mathrm{E} 1\) реакціями (і навпаки). Якщо є можливість утворення більше одного алкену (оскільки існують різні\(\beta\) вуглеці), зазвичай найбільш заміщений алкен є основним продуктом. [4] Наприклад, спирти піддаються\(\mathrm{E} 1\) елімінації при обробці концентрованою сірчаною кислотою. У цьому випадку немає продукту заміщення, оскільки сульфат-аніон не є хорошим нуклеофілом (він сильно стабілізується резонансом).
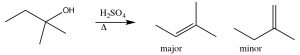
Тут основний продукт має три алкільні групи на подвійному зв'язку, тоді як незначний продукт має лише дві. Насправді ця каталізована кислотою дегідратація спиртів є досить синтетично корисною реакцією, але якщо субстрат має потенціал для перебудови (тобто отриманий карбокат може стабілізуватися гідридним або алкільним зрушенням), то є потенціал для утворення ще більшої кількості продуктів. Наприклад:
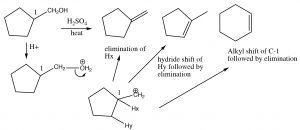
Ліквідація і перестановка
Очевидно, що такі перебудови та усунення не є синтетично корисними на субстратах, схильних до перебудови скелетів. Однак існує реакція елімінації, яка, як правило, забезпечує нам набагато більший контроль.
\(\mathrm{E} 2\)Реакція.
Як ми побачимо незабаром, синтез алкенів шляхом елімінації\(\mathrm{H–L}\) (де L - це група, що відходить) є важливою реакцією, але ми набагато частіше маємо контроль над продуктами, якщо реакція не проходить через карбокацію. Тобто, якщо ми можемо одночасно усунути\(\mathrm{H}^{+}\) і групу, що виходить, менше шансів побічних реакцій. Ця реакція є\(\mathrm{E} 2\) реакцією (усунення другого порядку), і сприяє наявність міцної основи. Наприклад, реакція трет-бутилброміду з гідроксидом (або будь-яким міцним підставою), показана вище. При цьому заміщення продукту мало, а замість основи одночасно видаляється протон з\(\beta\) вуглецю, як показано на малюнку.
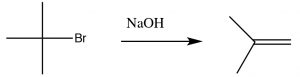
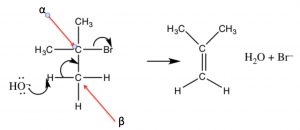
Ліквідація Е2
Отже, швидкість залежить як від субстрату, так і від основи:\(\text { Rate }=k[\mathrm{RL}][\text{base}]\) —тобто реакція другого порядку. Але зачекайте - чи не бачили ми, що сильні основи - це хороші нуклеофіли? З самого початку ми показали, що метил і первинні субстрати з сильними нуклеофілами піддаються\(\mathrm{S}_{\mathrm{N} 2\) реакції. Як ми можемо здійснити ліквідацію в цьому випадку? Ну, так само, як стерильно перешкоджений субстрат не зазнає\(\mathrm{S}_{\mathrm{N} 2\) реакції, ми можемо використовувати стерильно ускладнену основу, щоб уникнути таких реакцій. Якщо основа занадто громіздка навколо своєї реактивної ділянки, то вона не може наблизитися до підкладки в електрофільному центрі, а замість цього забере протон з одного з\(\beta\) вуглеців. Однією з таких основ є сіль т-бутанолу, трет-бутоксид калію (\(\mathrm{tBuOK}\)), яка використовується для\(\mathrm{E} 2\) усунення первинних і вторинних субстратів.
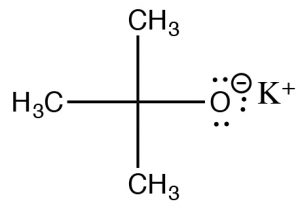
Так само, як і у випадку з\(\mathrm{E} 1\) реакціями, найбільш заміщений подвійний зв'язок є основним продуктом:
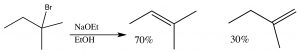
Ще одним фактором, який необхідно враховувати в\(\mathrm{E} 2\) реакціях, є те, що для виникнення такої реакції група виходу та протон, який усувається, повинні перебувати в орієнтації, яка дозволяє регібридизуючим орбіталям перекриватися в перехідному стані.
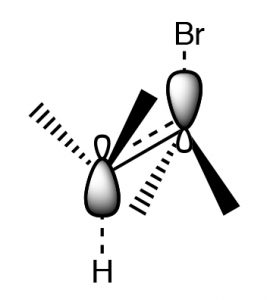
Така орієнтація називається антиперипланарной, і ця потреба в конкретному розташуванні реакції, називається стереоелектронним вимогою.
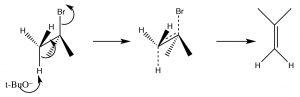
Антиперипланарна (або транс-діаксіальна) стереоелектронна вимога до\(\mathrm{E} 2\) елімінації
У системах, де можливе вільне обертання, це вирівнювання груп, як правило, не є проблемою, але якщо усунення має відбуватися в кільцевій системі, то і виїжджаюча група повинна бути\(H\) транс-і діааксіальною, інакше стереоелектронна вимога не може бути виконана.
Так, наприклад, 1-бром-2-метилцілогексан виробляє 3-метилциклогексен, а не 1- метилциклогексен. Це пояснюється тим, що водень на тому ж вуглеці, що і метильна група, повинен бути екваторіальним (якщо метильна група транс). Тому осьовий водень з іншого бета-вуглецю усувається замість цього.
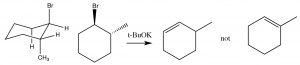
\(\mathrm{E} 2\)елімінація вимагає транс-діаксіальної (антиперипланарної) конформації
| Сила нуклеофіла/основи | Метиловий | Первинний | Вторинний | третинний |
| Сильна/сильна напр.\({}^{-} \mathrm{OCH}_{3}\) | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{E} 2\) | \(\mathrm{E} 2\) |
| Сильні/слабкі\(\mathrm{RSH}\), наприклад, галогенідні іони | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{S}_{\mathrm{N}} 2\) | \(\mathrm{NR}\) |
| Слабий/сильний\({}^{-} \mathrm{OBu}^{\mathrm{t}}\), наприклад, nAh | \(\mathrm{NR}\) | \(\mathrm{E} 2\) | \(\mathrm{E} 2\) | \(\mathrm{E} 2\) |
| Слабий/слабкий\(\mathrm{H}_{2} \mathrm{O}\), наприклад,\(\mathrm{CH}_{3} \mathrm{OH}\) | \(\mathrm{NR}\) | \(\mathrm{NR}\) | \(\mathrm{S}_{\mathrm{N}} 1 / \mathrm{E} 1\) | \(\mathrm{S}_{\mathrm{N}} 1 / \mathrm{E} 1\) |
Одне можна сказати точно: взаємодія між субстратом і розчинником може бути дуже заплутаною. Неможливо запам'ятати всі можливі результати із заданого набору умов реакції, і хоча деякі узагальнення можуть бути зроблені, найкращий спосіб керувати всім цим - спробувати пропрацювати реакцію, написавши правдоподібний механізм. При цьому наступна таблиця узагальнює деякі потенційні результати за типом субстрату та силою нуклеофіла/основи.
