ІІІ. Амоній церій (IV) Нітрат
- Page ID
- 27882
А. додавання CH-кислих сполук до D-глікалів
1. Диметил малонат
a. регіоселективність
Подібно до реакції ацетату марганцю (III), нітрат церію амонію (IV) сприяє регіоселективному додаванню СН-кислих сполук до вуглеводів з багатими електронами подвійними зв'язками. 6—9,15,16,19—22 Приклади таких реакцій наведено у рівняннях 3 та 4, а механізм процесу додавання запропоновано на схемі 7. 6-9 Реакції глікалів з (NH 4) 2 Ce (NO 3) 6 (екв 3 і екв 4) можуть проводитися при більш низьких температурах, ніж ті, що мають Mn (oAc) 3 (екв 1 і екв 2). Ці більш м'які умови повністю пригнічують утворення продукту перестановки Фер'єра 8, сполуки, утвореної в реакції, наведеної в еквалайзері 1, але відсутня в тому, що показано в еквалайзері 3.
.png)
.png)
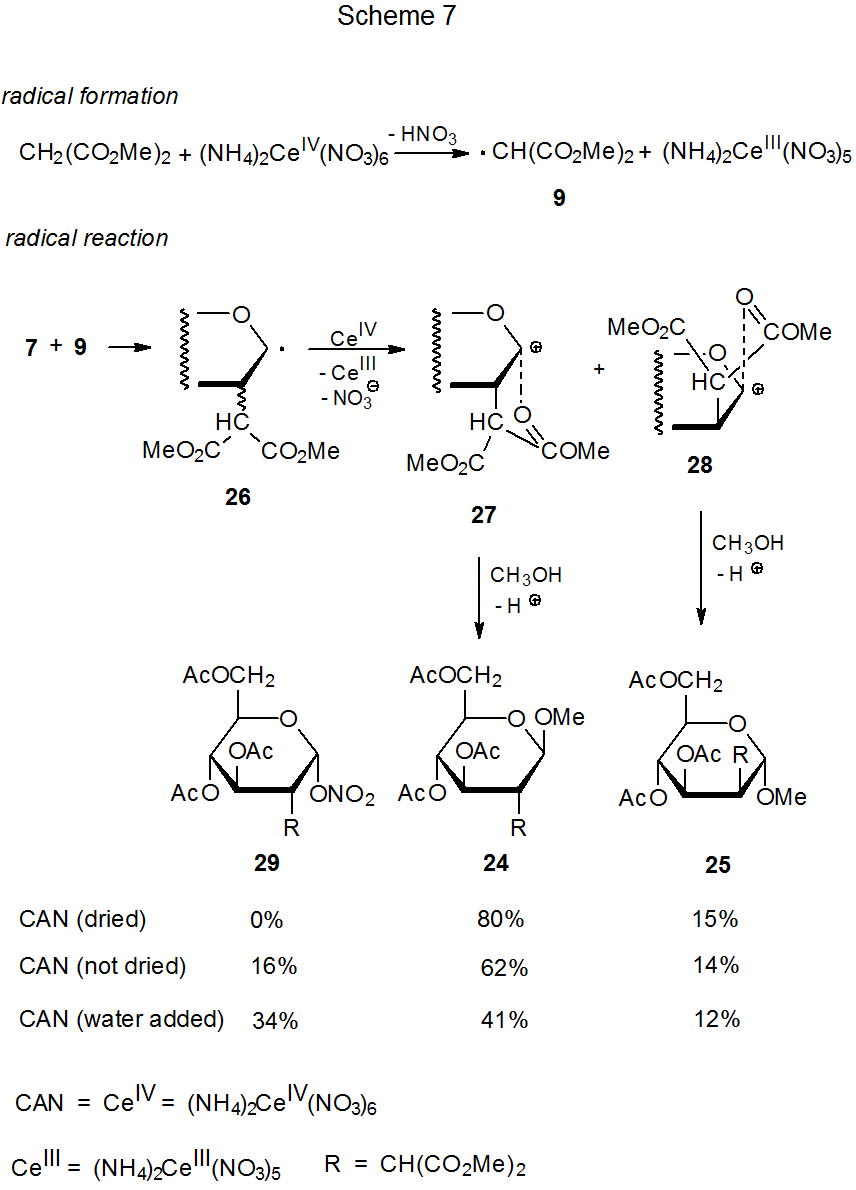
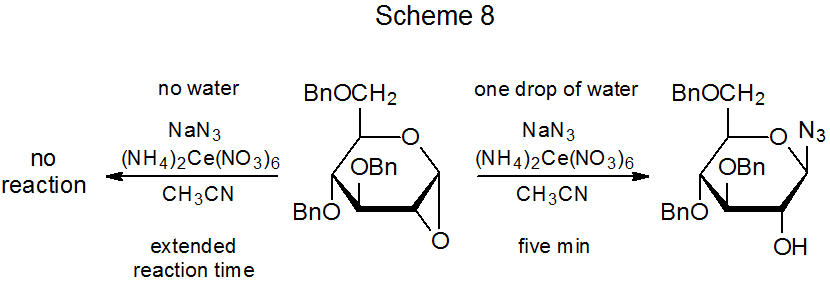
Якщо вода присутня, навіть в невеликих кількостях, в реакції, наведеної на схемі 7, утворюється нове з'єднання (29). 22 Як утворюється це з'єднання? Пряма реакція між катіоном 27 і нітратним аніоном є однією з можливих, але якщо цей шлях правильний, додавання нітрату натрію в реакційну суміш має збільшити вихід 29. Це не так. 7 Перехід ліганду з (NH 4) 2 Ce (NO 3) 6 до радикального 26 також можливий, 6,7, але важко зрозуміти, чому такий процес повинен залежати від кількості води, присутньої в реакційній суміші. Обидві ці можливості [реакція 27 з NaNO 3 або перенесення ліганду з (NH 4) 2 Ce (NO 3) 6], швидше за все, виробляють аномер 29, а не сам 29. Дані в схемі 7 показують, що утворення нітрату 29 відбувається за рахунок β-глікозиду 24. Перетворення 24 в 29 може бути результатом реакції 24 з азотною кислотою, отриманої при взаємодії (NH 4) 2 Ce (NO 3) 6 з водою. Ця можливість підтримується реакцією, показаною на схемі 8, де крапля води, мабуть, реагує з (NH 4) 2 Ce (NO 3) 6 для створення азотної кислоти, необхідної для кільцевого відкриття каталізованого кислотою. 23
б. стереоселективність
Стереоселективність реакції поліпшується, коли (NH 4) 2 Ce (NO 3) 6 замінює Mn (OaC) 3 при додаванні диметилмалонату до 3,4,6-три-О -ацетил- D -глюкалу (7). Співвідношення α-лицьового до β-лицьового приєднання при С-2 малоніліновим радикалом змінюється від 52:14 (екв 1, схема 4) 6 до 80:15 (ур. 3, схема 7). 22 Різниця температур цих реакцій [95 o C (eq 1) до 0 o C (екв 3)] є ймовірною причиною такого підвищення стереоселективності.
Другий стереоселективний етап реакцій, показаних на схемах 3 і 7, відбувається під час захоплення розчинника проміжними катіонами. Метанол вступає в реакцію з катіонами 27 і 28 виключно з боку кільця, протилежної малонільної групі, і в кожному випадку виробляє єдиний стереоізомер (схема 7). Захоплення оцтової кислоти, зображеної на схемі 3, також є стереоселективним, але менш тому, що кожен проміжний катіон реагує на отримання суміші стереоізомерів. Знову ж таки, більша стереоселективність реакції корелює з більш низькою температурою реакції.
Стереоселективність при малоніл-радикальному додаванні також збільшується, коли наближення до однієї грані кільця ускладнюється через зміну структури субстрату. Така зміна відбувається, коли 3,4,6-три-О -ацетил- D -глюкал (7) (екв 3) замінюється 3,4,6-три-О- ацетил - D -галактал (30) (екв 4). 7 Проекція C-4 ацетоксигрупи на β грань піраноїдного кільця в 30 робить цю грань більш перевантаженою, ніж β грань піраноїдного кільця в 7.
c. реактивність
(1). Вплив С-1 замісників на формування орто-ефіру глікальної реактивності
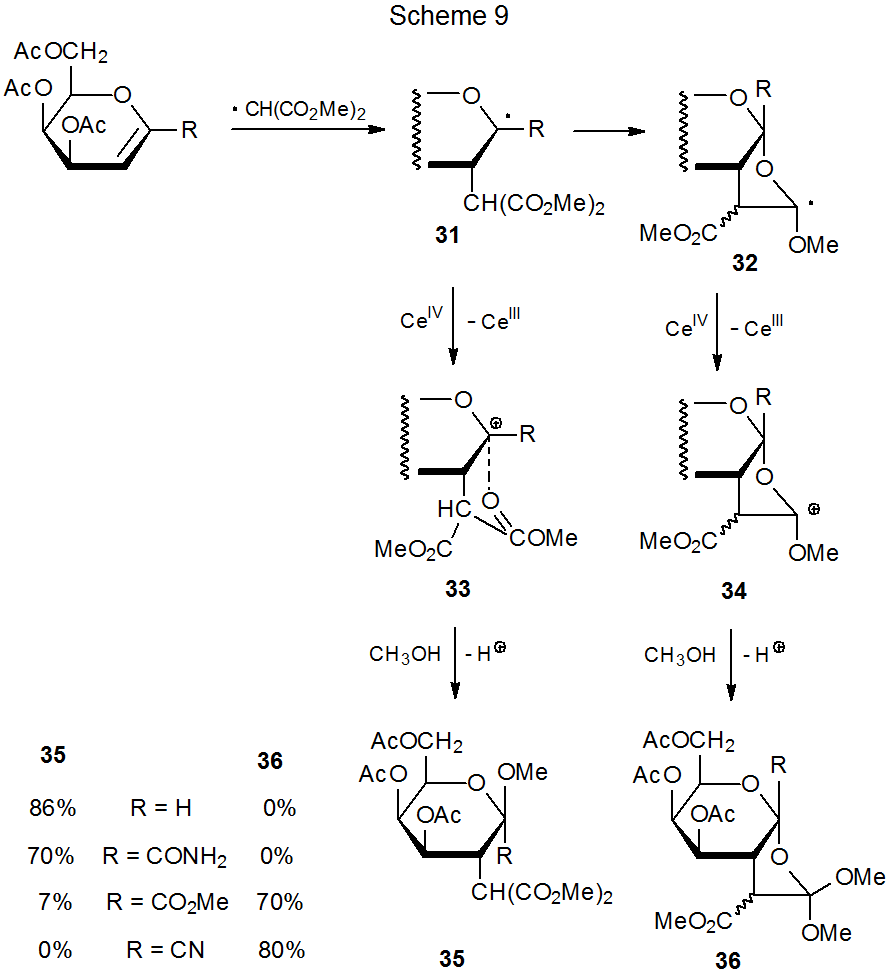
Продукти, що утворюються від додавання малонілрадикала 9 до С-1 заміщених гліколів, залежать від структури С-1 замінників (схема 9). 24 Коли R є H або C (= O) NH 2, глікозид 35 утворюється, але коли R - CO 2 Me або CN, продукти є ортоефірами 36. Пояснення цієї різниці в реактивності полягає в тому, що коли R сильно відводить електрони (наприклад, CN або CO 2 Me), окислювальний потенціал радикала 31 досить високий, щоб його перетворення в катіон 33 шляхом реакції з (NH 4) 2 Ce (NO 3) 6 пригнічується (Схема 9). 24,25 Коли відбувається це придушення, циклізація 31 виробляє 32, радикал, який тепер може легко окислюватися до відповідного катіона (34). Реакція цього катіону з метанолом потім дає ортоефіри 36.
(2). Вплив С-3-замінника глікальної реактивності
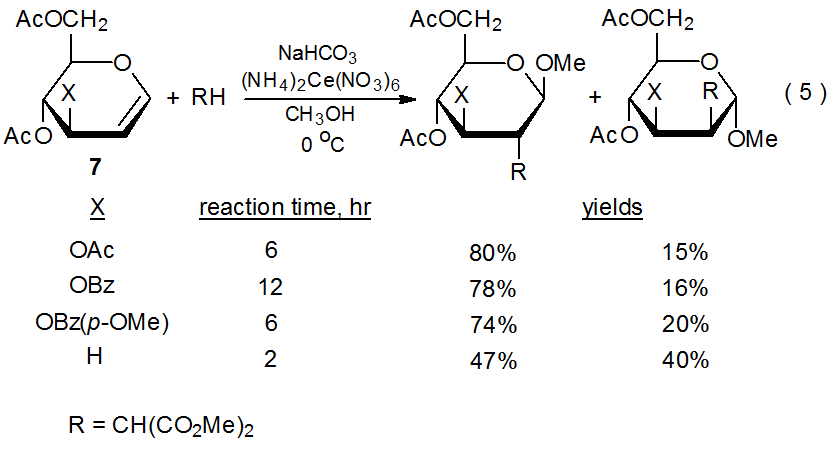
Важливість замісників, що відводять електронів, для глікальної реактивності також очевидна, коли різні замісники додаються до С-3 (екв 5). 25 Реакції, показані в еквалайзері 5, підтверджують раніше згадані висновки (Розділи III.A.1.a та III.A.1.b) про регіоселективність (малоніловий радикал 9 додає виключно до С-2) та стереоселективності (9 додає переважно до обличчя піраноїдне кільце, протилежне тому, що містить С-3 замісника). Ці реакції також демонструють вплив електронного характеру С-3 замінника на швидкість реакції (еквалайзер 5). Оскільки реакції передбачають додавання електрофільного малонільного радикала до багатої електронів подвійного зв'язку, збільшення відведення електронів групи R зменшує швидкість реакції за рахунок зменшення електронної щільності в подвійному зв'язку; таким чином, O -бензоїльна група, яка більше електронно- виведення, ніж O -ацетильна група, викликає більш повільну швидкість реакції. Швидкість реакції O -бензоїлзаміщеного глікалю може бути збільшена шляхом розміщення електронно-донорської метоксигрупи в бензольне кільце. Реакцію можна зробити ще швидше, усунувши будь-яку групу відведення електронів з С-3 (еквалайзер 5).
.png)
2. етил нітроацетат
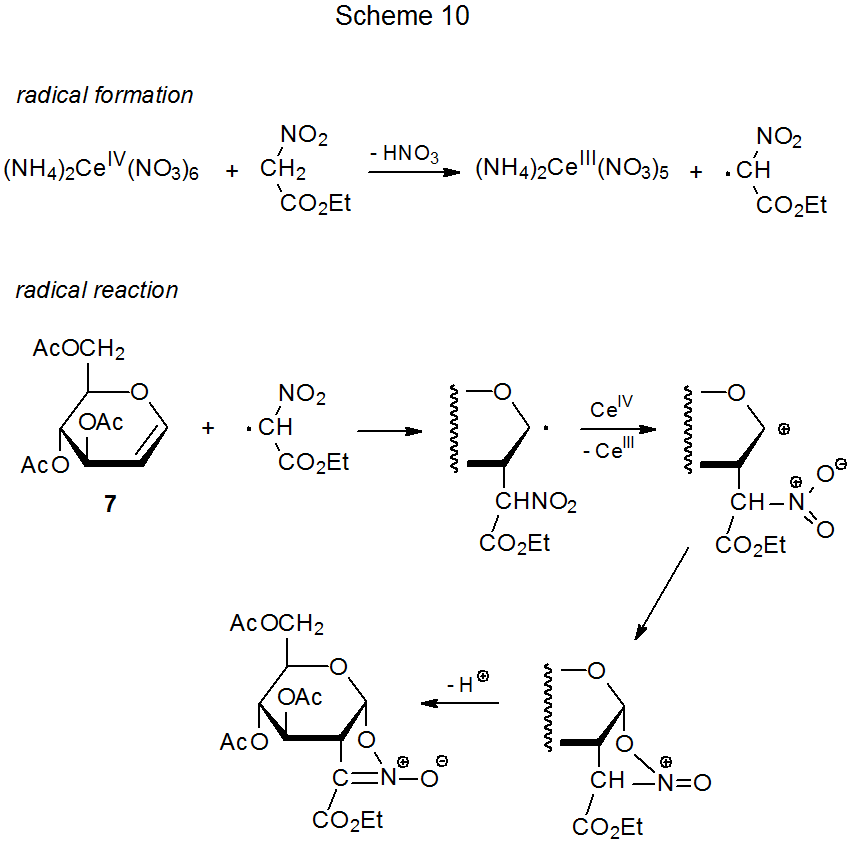
Коли етилнітроацетат реагує з (NH 4) 2 Ce (NO 3) 6 у присутності D-глюкаля 7 (екв 6), 20 відбувається перетворення, подібне на ранніх стадіях до реакції диметилмалонату, показаної в еквалайзері 3. Ці два процеси йдуть різними шляхами після того, як радикал аддукта окислюється до катіону. У реакції етилнітроацетату відбувається циклізація (схема 10), а не захоплення розчинника, що характеризує реакцію з диметилмалонатом (Схема 7).
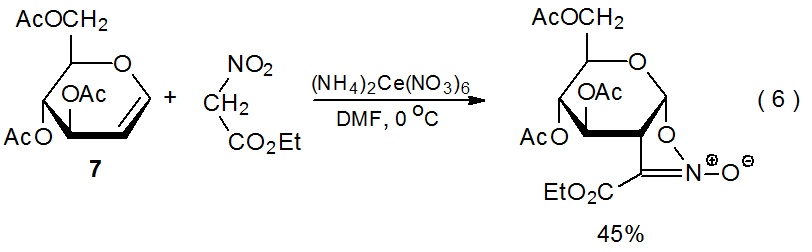.png)
3. Нітрометан
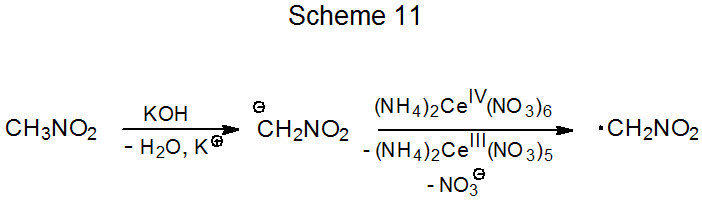
Нітрометан - це СН-кисла сполука, яка реагує з гідроксидом калію з утворенням аніону нітронату. Окислення цього аніону нітратом церію амонію (IV) виробляє електрофільний радикал · CH 2 NO 2 (схема 11). Якщо в реакційній суміші присутній з'єднання з багатим електронами подвійним зв'язком, відбувається приєднання радикалів (ур. 7). 26
.png)
Б. додавання азидного радикалу до D-глікалу
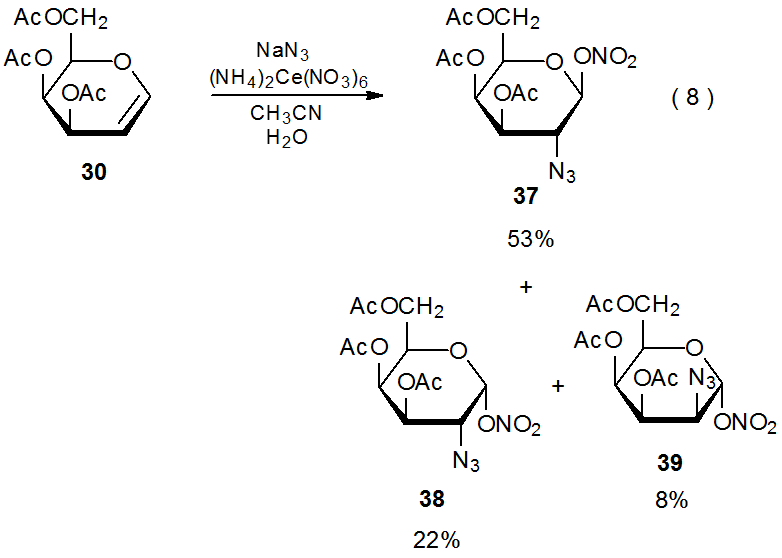
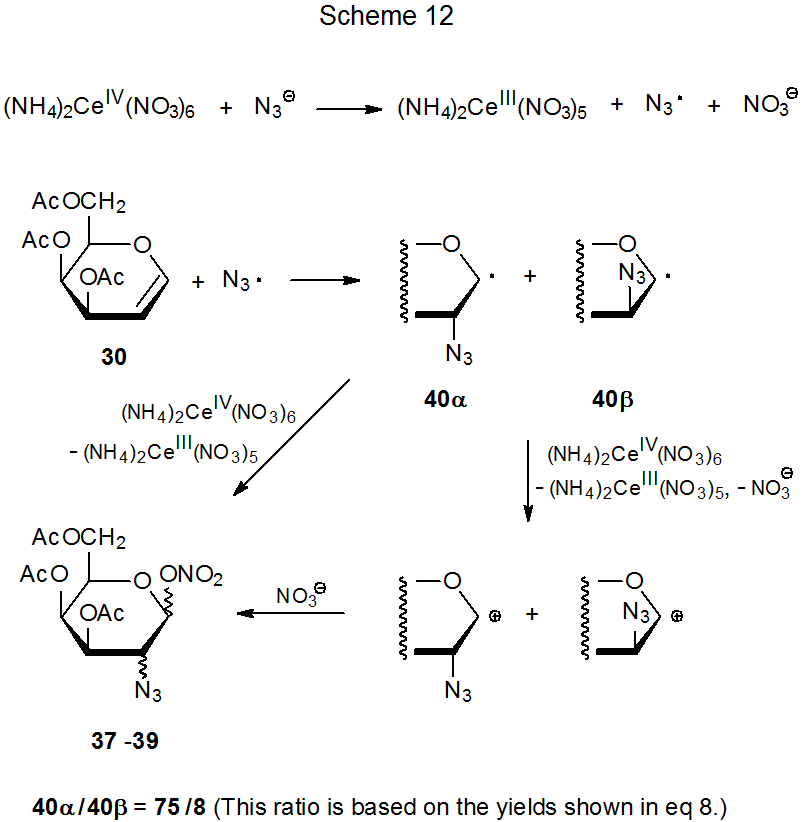
Реакція нітрату церію амонію (IV) з азидом натрію в присутності D -галакталу 30 виробляє діастереомерні азидонітрати 37 - 39 (екв 8). 27 Є переконливі докази того, що (NH 4) 2 Ce (NO 3) 6 окислює NaN 3 з отриманням азидного радикала (схема 12). 28 Високостереоселективне додавання цього радикала до 30 дає аддукт радикалів 40α і 40β у співвідношенні 75:8. Потім азидо нітрати 37 - 39 утворюються або опосередковано реакцією нітратного іона з катіонами, що утворюються окисленням 40α і 40β, або безпосередньо шляхом перенесення ліганду з (NH 4) 2 Ce (NO 3) 6 до цих радикали. 29 (Розділ II.B.2 глави 15 містить більше інформації про азидонітрацію та додаткові посилання на цю реакцію.)
.png)
C. Додавання фосфонільного радикала до D-глікалу
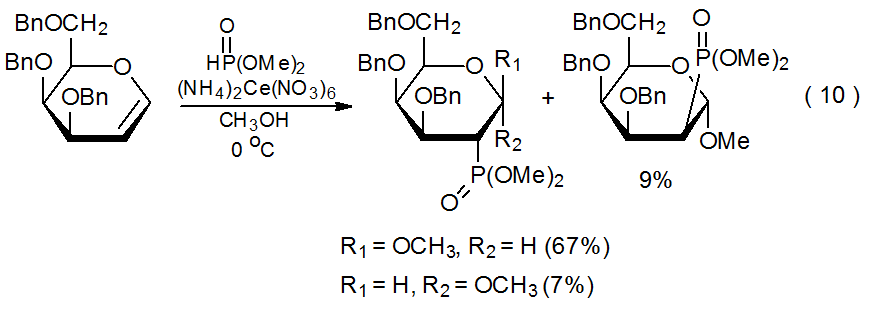
Диметилфосфіт реагує з (NH 4) 2 Ce (NO 3) 6 з отриманням центрованого фосфору радикала 41 (екв 9). 30 Потім цей радикал додає до D-глікалів у регіоспецифічний, високостереоселективний спосіб (ур. 10).
.png)
.png)