Реакції циклізації
- Page ID
- 28180
А. субстрати для радикальної циклізації
Радикали, здатні до циклізації, можуть утворюватися в результаті реакції Smi 2 з ненасиченими вуглеводними сульфонами 13,27,88-91 або галогенідами. 14—18,92,93 Внутрішнє додавання можливе або до подвійного зв'язку C — C 14 —18 (схема 8) 14 або C—N 92,93 (екв 8) 92. Глікозилфенілсульфони часто є вихідними матеріалами вибору для формування піранос-1-іл радикалів, оскільки такі сульфони не тільки стабільніші (32), ніж відповідні йодиди та броміди, але вони також легко виробляють радикали при реакції з SmI 2 у присутності HMPA. (Схема 3). HMPA має вирішальне значення для реакційної здатності фенілсульфону, оскільки за відсутності цього співрозчинника ці сульфони не реагують. 13,91

.png)
На відміну від фенілсульфонів, HMPA не потрібен для реакції 2-піридилсульфонів. Така контрастна поведінка пояснюється впливом 2-піридильної групи на енергетичні рівні сульфону МО. Оскільки енергія LUMO 2-піридилсульфону нижча, ніж у фенілсульфону, перенесення електрона до похідної 2-піридилу відбувається легше (рис. 2); в результаті реакція може відбуватися без присутності HMPA (Схема 9). 13,91

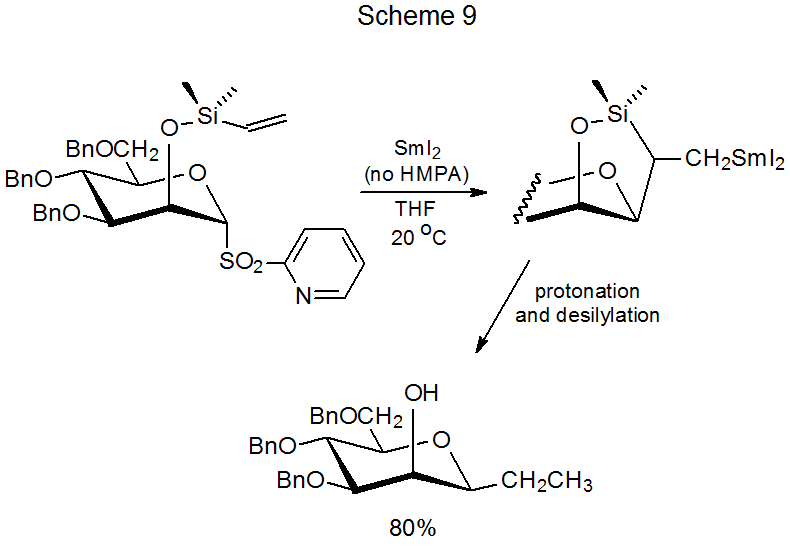
Б. радикальна циклізація проти циклізації органосамарієвої сполуки
Коли відбувається одноелектронний перенесення від Smi 2 до молекули субстрату, часто незрозуміло, чи є реактивні форми радикалом, органосамарієвим з'єднанням або навіть аніоном. 94 У реакції, показаної на схемі 10, наприклад, радикальна циклізація та утворення органосамарієвих з'єднань можливі з радикала 19. 27 Оскільки ні протонації, ні β елімінації, характерних реакцій проміжного органосамарію, не спостерігається, показанням є те, що радикал 19 піддається циклізації до утворення органосамарієвого з'єднання 20.

Реакція, зображена на схемі 8 14, аналогічна тій, яка показана на схемі 10, оскільки утворення кільця відбувається без простого відновлення або β елімінації, що характеризують проміжні продукти органосамарію. У цій реакції (схема 8) стереоселективність сильно залежить від умов реакції. Для ініціюваної AIBN реакції 14 з три-н-бутилтингідридом мало сумнівів, що відбувається радикальна циклізація. Подібність у співвідношеннях продуктів між цією реакцією та реакцією, спричиненою Smi 2 (за відсутності HMPA), підтримує ідею, що обидві реакції передбачають радикальну циклізацію.
Існує різка зміна стереоселективності, коли HMPA додається до реакції, показаної на схемі 8. 14 Ця зміна була пов'язана з HMPA-комплексним іоном самарію, який став асоціюватися з карбонільною групою в 15. Вважається, що розмір цієї групи достатній для створення важкої стеричної взаємодії з ізопропіліденовою групою, взаємодія, яка змушує ці дві групи до протилежних граней новоутвореного кільця. 14 Однак також можливо, що велика зміна стереоселективності сигналізує про новий механізм реакції. Циклізація може відбуватися від органосамарію проміжного 16. Однак, щоб це сталося, потрібно було б сформувати 16 швидше, ніж внутрішнє радикальне додавання до активованого подвійного зв'язку. Це також вимагатиме циклізації органосамарієвої сполуки швидше, ніж протонація або β елімінація з 16. Наявна інформація не дає остаточного механістичного вибору для цієї реакції, тобто радикальної циклізації, показаної на схемі 8, коли присутній HMPA. 14