ІІ. Визначення характеристик реакцій радикального приєднання
- Page ID
- 27993
А. Механізми реакції
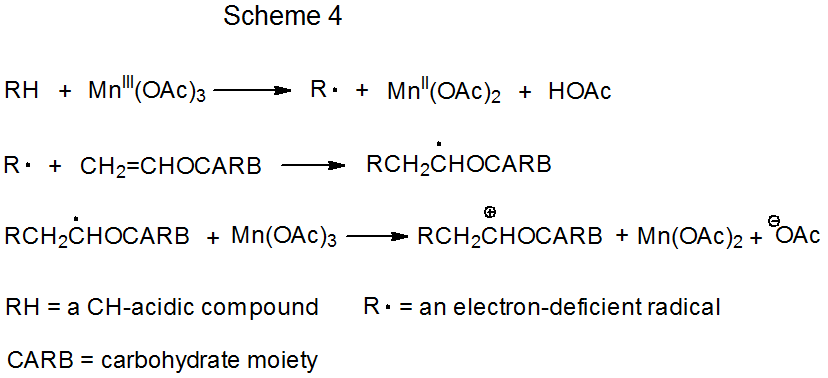
Радикальне додавання може відбуватися або ланцюгової, або неланцюгової реакцією. Для кожного з них є дві варіації основного механізму реакції. Для ланцюгових реакцій (схеми 1 і 2) кожна варіація має різний тип ланцюгової передачі кроку. Для неланцюгових реакцій обидва механізми передбачають перенесення електронів. Відрізняються вони тим, що перенесення відбувається або з (Схема 3), або на (Схема 4) металоорганічного комплексу.
1. Ланцюгові реакції
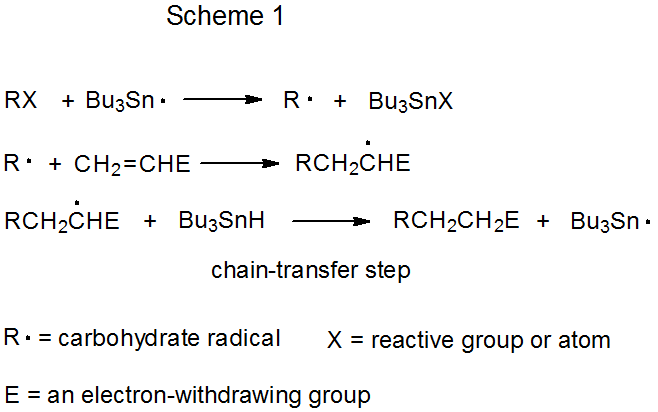
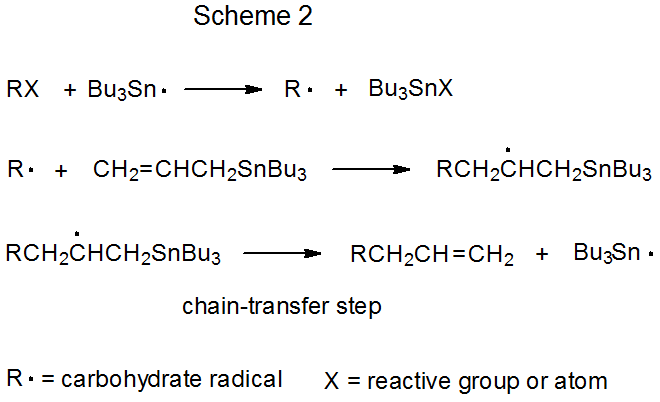
Обидва механізми радикального складання ланцюговою реакцією мають фазу поширення, яка починається з групової або атомної абстракції (Схеми 1 і 2). У кожному з цих механізмів Bu 3 Sn· показаний як абстрагуючий радикал, хоча інші радикали [наприклад, (Me 3 Si) 3 Si·] здатні заповнити цю роль. Визначальною відмінністю цих двох механізмів є крок ланцюгової передачі. У реакції, показаної на схемі 1, вона бімолекулярна, а в схемі 2 - одномолекулярна.
а. бімолекулярна ланцюгова передача
Відмінною рисою ланцюгової реакції, що протікає шляхом бімолекулярного ланцюгового перенесення, є елементарна реакція між радикалом і нерадикалом, яка закінчує одну послідовність поширення і створює радикал, який починає нову послідовність. У реакції, показаної на схемі 1, ланцюговий перенесення відбувається, коли аддуктивний радикал абстрагує атом водню з Bu 3 SnH, утворюючи добуток додавання RCH 2 CH 2 E і генерувати ланцюгонесучий радикал Bu 3 Sn·.
b. одномолекулярний ланцюговий перенесення
Одномолекулярний ланцюговий перенесення описує реакцію, в якій етап ланцюгового перенесення в послідовності поширення є елементарною реакцією з одним реагентом. Етапи поширення для типової одномолекулярної реакції ланцюгового перенесення показані на схемі 2, де етап перенесення є β-фрагментацію, яка виробляє ненасичену сполуку і ланцюгонесучий радикал.
2. Безланцюгові реакції
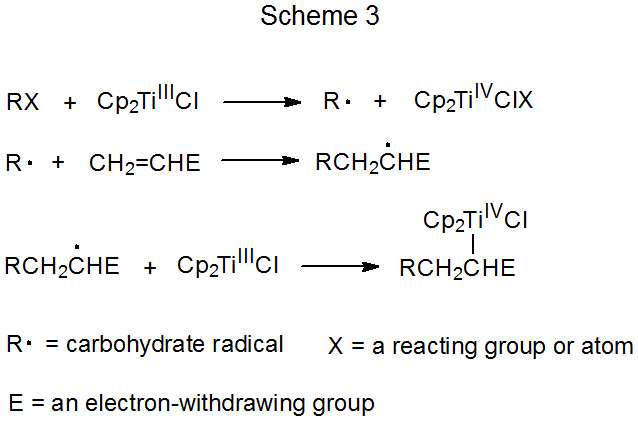
Схеми 3 і 4 описують механізм реакції, яка не має повторюваного циклу. У першому з них (схема 3) вуглеводний радикал R· утворюється шляхом перенесення електронів від комплексу перехідних металів (Cp 2 TiCl) до вуглеводного похідного. (Cp 2 TiCl - один з декількох комплексів перехідних металів, які, як відомо, функціонують як донор електронів у цьому типі реакції.) Радикальна реакція закінчується, коли друга молекула Cp 2 TiCl поєднується з аддуктивним радикалом для отримання нестабільного карбометалічного продукту. Продукти цього типу проходять швидку, нерадикальну реакцію (наприклад, усунення елементів Cp 2 TiClH з утворенням подвійного зв'язку).
При другому типі неланцюгової реакції (схема 4) радикальне утворення відбувається, коли перехідно-металевий комплекс дарує електрон СН-кислотному з'єднанню. Радикальна фаза реакції закінчується другим перенесенням електронів, таким, який виробляє карбокацію. Цей катіон зазнає швидку нерадикальну реакцію, таку як захоплення молекулою розчинника.
B. Вибірковість у реакціях додавання
1. Хіміоселективність
Хімоселективність є наслідком на двох стадіях реакції радикального приєднання. Перший знаходиться на стадії радикального формування, де селективність визначається реактивністю функціональних груп, присутніх в молекулі субстрату. Формування бажаного радикала здійснюється на цьому етапі, гарантуючи, що попередник радикалу має найбільш реактивний замінник, прикріплений до атома вуглецю, де повинен бути розташований радикальний центр. Наступне місце, на якому селективність потенційно має значення, - це під час радикального додавання до множинного зв'язку. Хімоселективність має значення в цей час, якщо є дві або більше множинних зв'язків, до яких може відбуватися додавання.
2. Регіоселективність
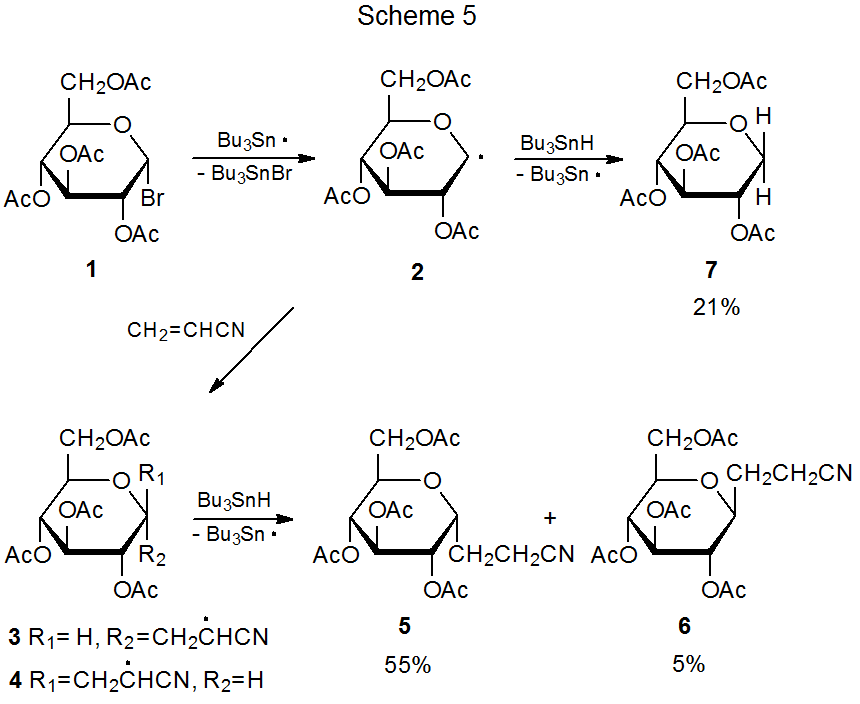
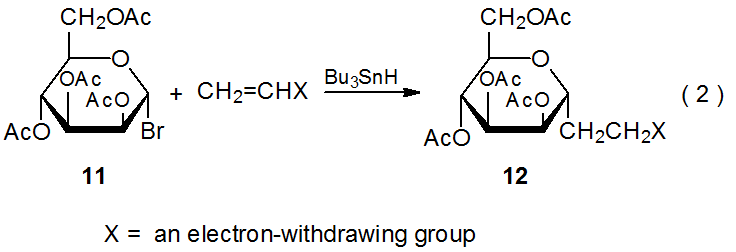
Найбільш радикальні реакції приєднання за участю вуглеводів є регіоспецифічними. Додавання відбувається виключно при менш заміщеному атомі вуглецю в багаторазовому зв'язку. Типовий спосіб додавання піранос-1-іл радикала 2 до акрилонітрилу (схема 5). 1,2 Реакції в таблицях 1 і 2 документують аналогічну регіоспецифічність при додаванні 2 до інших ненасичених сполук. Дані в таблицях 3-5 показують, що реакції інших піранос-1-іл радикалів проявляють подібну реакційну здатність. (Всі ці таблиці розташовані в кінці цієї глави.)
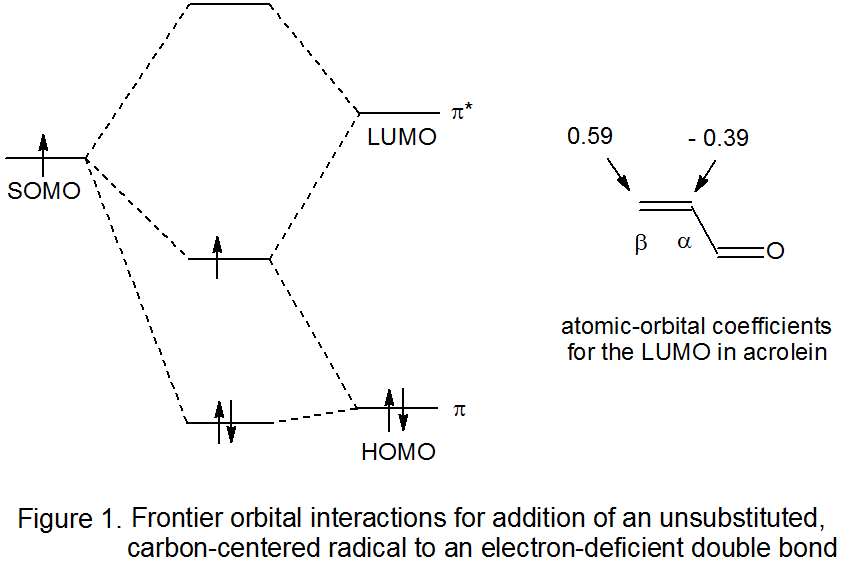
Як стеричні, так і полярні ефекти відіграють певну роль у визначенні регіоспецифічності на додаток реакцій. Стеричні ефекти стають все більш важливими, оскільки ефективний розмір замінників поблизу множинного зв'язку в ненасиченій сполуці збільшується і як ефективний розмір додається радикала збільшується. Полярні ефекти проявляються всякий раз, коли нуклеофільний радикал додає до множинного зв'язку з дефіцитом електронів, або електрофільний радикал додає до багаторазового зв'язку, багатого електроном. Ступінь впливу кожного ефекту залежить від точки, в якій досягається перехідний стан в міру прогресування реакції. Наприклад, оскільки додавання нуклеофільного радикала в електронно-дефіцитний множинний зв'язок (найбільш поширений тип реакції приєднання) є екзотермічним, така реакція повинна мати ранній (реагентоподібний) перехідний стан 11 з мінімальним, новим утворенням зв'язків. Коли в перехідному стані мало формування нових зв'язків, існує зменшена можливість стеричних взаємодій впливати на регіоселективність. Ситуація з полярними ефектами інша, оскільки, як описано в наступному пункті, вони можуть надавати значний регіоселективний контроль у реакції, яка має ранній перехідний стан.
Для реакції з раннім перехідним станом молекулярні орбіталі в реагентах не сильно змінюються до моменту досягнення перехідного стану. У такій ситуації прикордонно-орбітальні взаємодії корисні не тільки для розуміння того, чому відбувається реакція, але і в поясненні регоселективності реакції. Коротко, реакція відбувається легко, оскільки SOMO вуглеводного радикала та LUMO ненасиченого реагенту енергетично досить близькі для значної стабілізуючої взаємодії між ними у перехідному стані (рис. 1). 12,13 Ступінь раннього зв'язку між радикалом і атомами вуглецю у взаємодіючій множинному зв'язку є функцією величини атомного орбітального коефіцієнта на кожному атомі вуглецю в LUMO ненасиченого реагенту. Приєднання до множинного зв'язку замінника, що відводить електронів або електронів, призводить до того, що ці коефіцієнти є досить нерівними, ситуація, яка призводить до регіоспецифічної реакції. Для поляризованого багаторазового зв'язку, такого як у α, β-ненасиченому нітрилі або карбонільній сполуці, регіоспецифічне додавання до β-атома вуглецю відображає більшу величину атомного орбітального коефіцієнта у цього атома в LUMO порівняно з величиною коефіцієнта на α атома вуглецю (рис. 1).
3. стерео селективність
Як описано в наступних кількох розділах, стереоселективність в реакціях радикального приєднання визначається поєднанням стеричного і стереоелектронного ефектів. Стереоелектронний ефект, що має першорядне значення, - кінетичний анномерний ефект. Стеричні ефекти, які впливають на стереоселективність реакції, мають різні назви, але всі вони залежать від стеричних взаємодій, що сприяють особливому підходу ненасиченої сполуки або перенесення атома водню до радикального центру.
a. кінетичний анномерний ефект
Реакція між піранос-1-іл радикалом 2 і ненасиченою сполукою з електронно-дефіцитним подвійним зв'язком є високостереоселективною (схема 5). Переважна реакція на α грані піраноїдного кільця в 2 значною мірою обумовлена кінетичним аномерним ефектом (розглянуто в главі 11 тому I). На стереоселективність в реакціях приєднання 2 також впливають умови реакції. Інформація в таблиці 1 включає кілька наборів умов, придатних для високостереоселективної реакції з невеликим, конкуруючим простим скороченням.
Селективність, що спостерігається в реакціях 2, поширюється і на інші D‑ гексопіранос-1-іл радикали. Реакції D-галакто-і D -маннопіранозилу бромідів 8 (екв 1) та 11 (екв 2) відповідно є принаймні такими ж стереоселективними, як і у відповідного D -глюкопіранозилброміду 1. Дані в таблицях 3 і 4 підтверджують, що реакції 8 і 11 відбуваються переважно на α грані піраноїдного кільця.
.png)
.png)
б. стеричні ефекти
(1). Групове екранування
Групове екранування спричиняє переважне додавання до менш перешкодженим обличчям кільцевої системи. У реакції, показаної в екв 3, група 2,3- O -ізопропілідену екранує α грань радикала, зосереджену на С-4 в піраноїдному кільці від наближення ненасиченим реагентом. 14
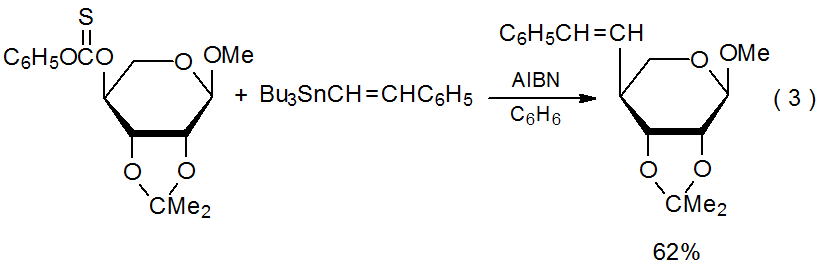.png)
(2). Розмір ненасиченого реагенту
Реакція, показана на схемі 6, ілюструє комбінований ефект стеричного розміру ненасиченого реагенту та групового екранування радикала кільцевими замісниками. 15 У цій реакції кількість додавання до краще екранованого, β обличчя піраноїдного кільця в радикалі 13 зменшується зі збільшенням ефективного розміру ненасиченого реагенту. Дані в схемі 6 показують, що навіть у реакції з раннім перехідним станом стеричні ефекти можуть відігравати значну роль у визначенні стереоселективності реакції, якщо ці ефекти досить великі.
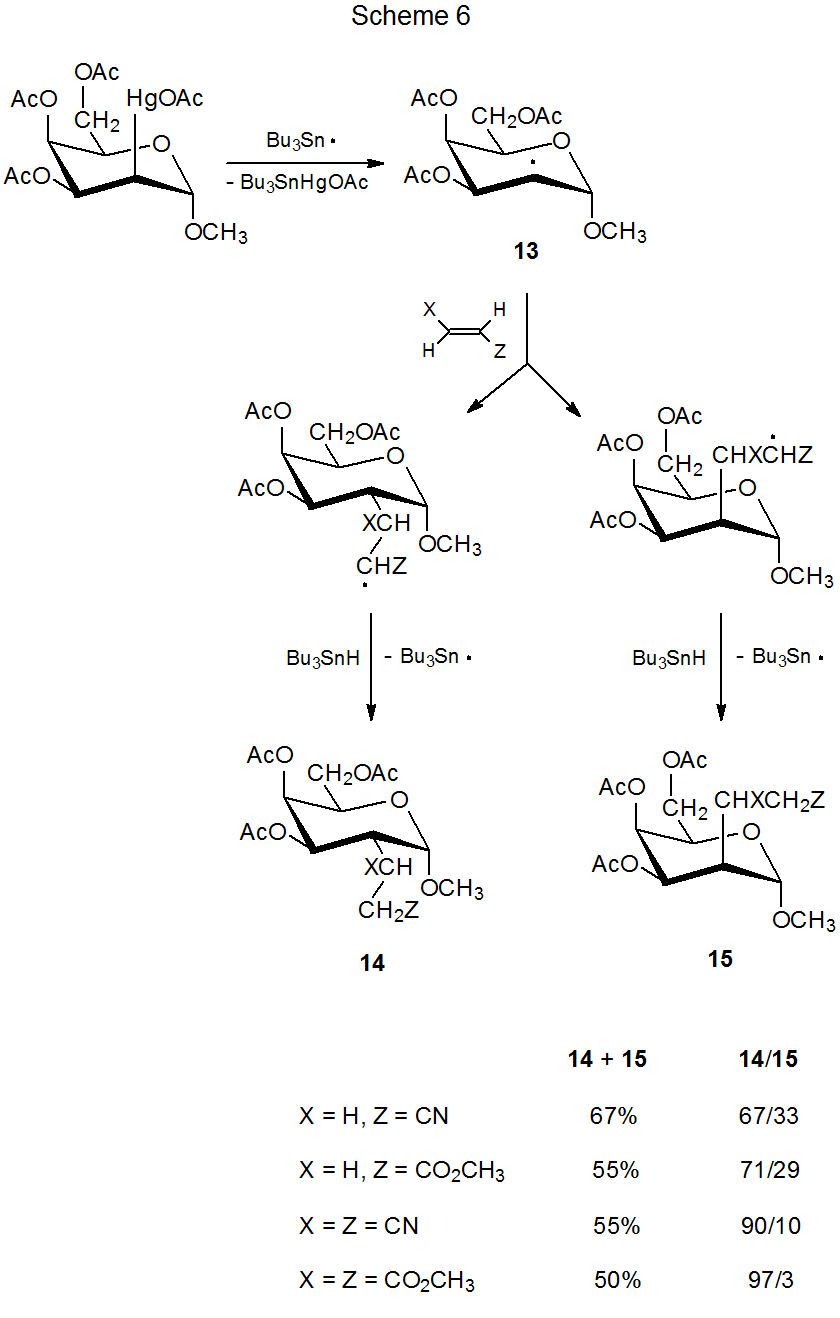
(3). Розмір переносу водь-атом
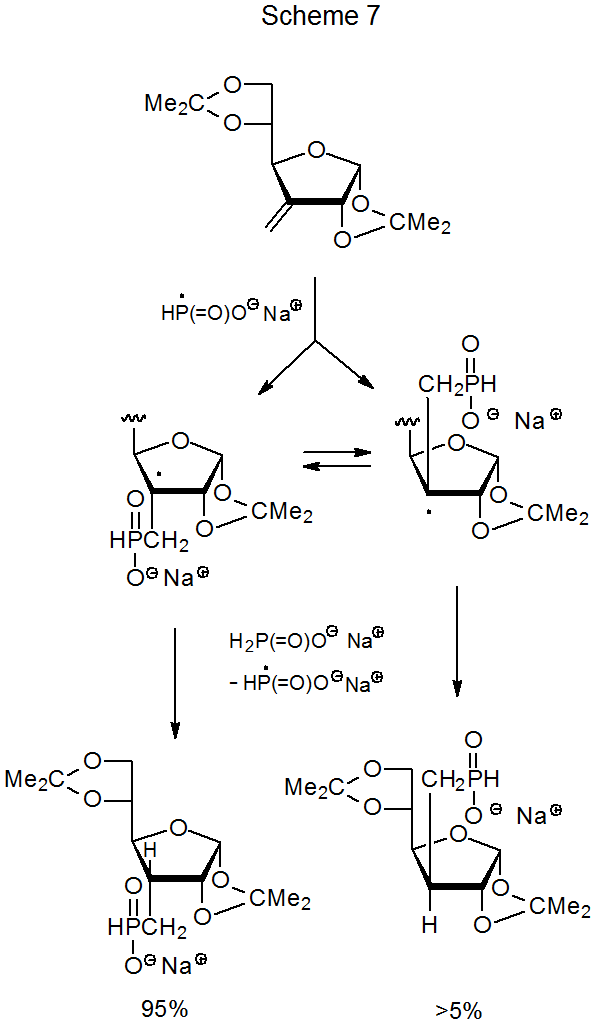
Іноді реакція утворює менш стабільну з двох можливих стереоізомерів внаслідок обмеженого наближення переносу атома водню до радикального центру на стадії формування продукту. Наприклад, у реакції, показаній на схемі 7, менш утруднене наближення гіпофосфіту натрію до β поверхні фураноїдного кільця виробляє менш стабільний стереоізомер при більшому виході 95%. 16