ІІ. Міграція фосфатокси-груп
- Page ID
- 28344
A. Механізм реакції
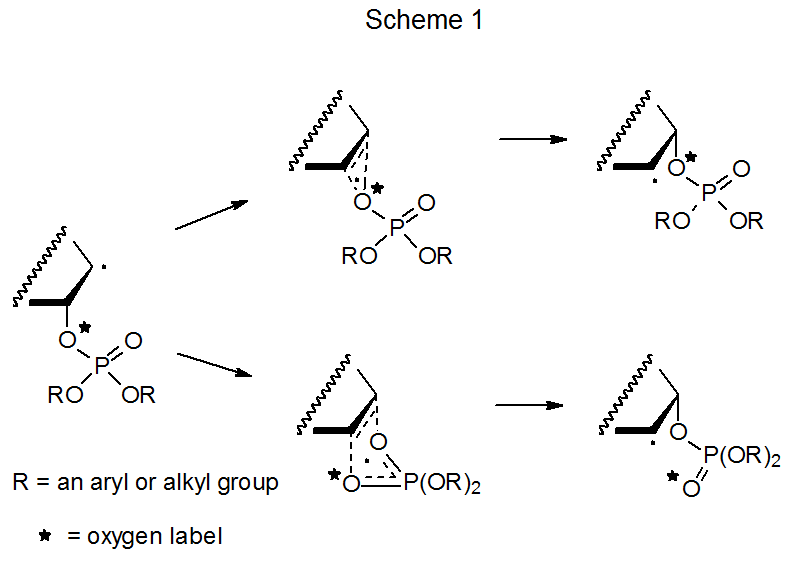
Спочатку два механізми розглядалися як можливості міграції фосфатоксигруп типу, показаного в еквалайзері 1. (Цей самий механістичний вибір існує для міграції ацилоксигруп і обговорюється в розділі В.А. Глави 8.) Перший з цих механізмів складався з пари конкуруючих, узгоджених реакцій, кожна з яких проходила через циклічний перехідний стан (Схема 1). 3-7 Основна відмінність між цією парою полягала в тому, що в одній реакції один і той же атом кисню був пов'язаний з каркасом атома вуглецю як до, так і після міграції, але в іншій каркас мав інший атом кисню, приєднаний після міграції. Пропонуючи міграцію за допомогою комбінації цих двох реакцій, дозволило пояснити експерименти з підкладками, маркованими киснем, в яких лише частина міченого кисню була прикріплена до каркасу атома вуглецю після міграції. Результати ранніх досліджень сприяли цьому поясненню з двома реакціями, 3—7, але результати пізніших досліджень вимагали його зміни, оскільки пізніші дослідження показали, що іонні проміжні продукти були залучені до процесу міграції.
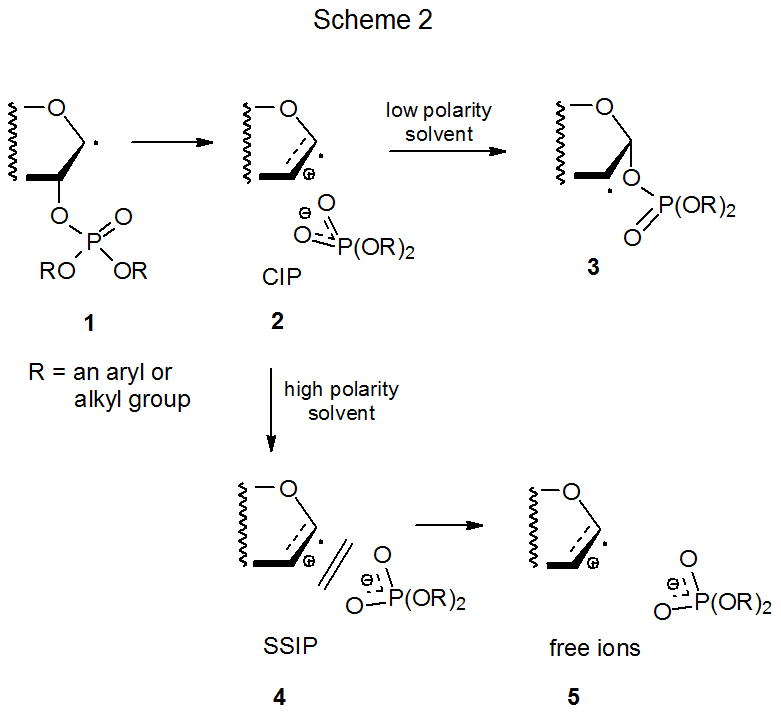
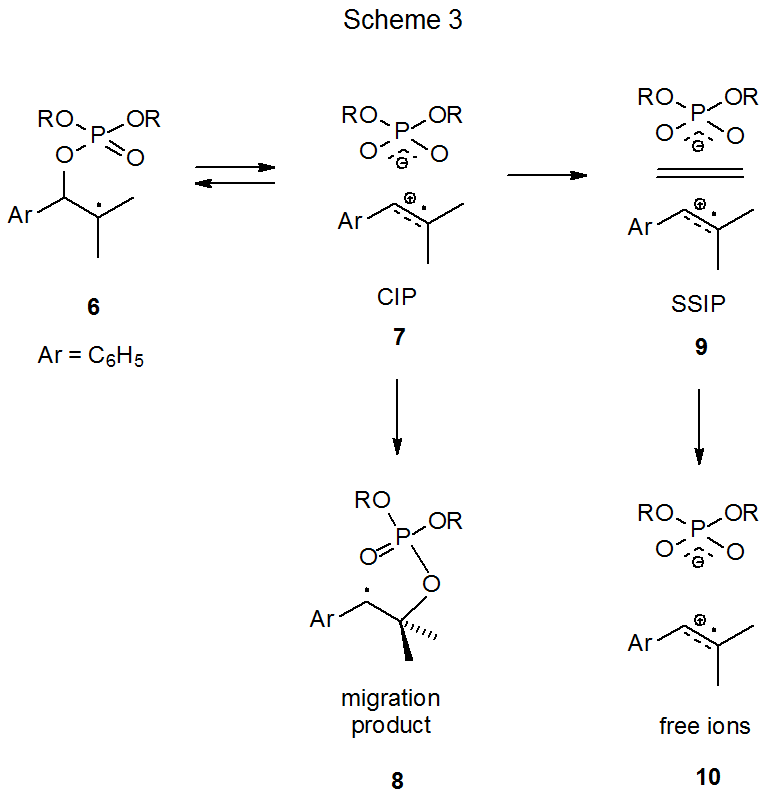
Механізм, що задовольняє іонно-проміжну вимогу, показаний на схемі 2, де фрагменти β-фосфатоксирадикала 1 гетеролітично дають контактну іонну пару (CIP) 2. 8-13 Ця іонна пара рекомбінується в розчинниках з низькою полярністю, утворюючи груповий мігруючий радикал 3, але в більшій кількості полярних розчинників CIP також може відокремлюватися, щоб стати іонною парою, розділеною розчинником (SSIP, 4), а потім вільними іонами 5. 10
Критична підтримка іонно-парного механізму міграції фосфатоксигруп походить від експериментів з лазерно-спалаховим фотолізом (LFP). Як SSIP 9, так і дифузно вільних радикалів катіон 10 можуть бути виявлені в дослідженнях, де LFP генерує радикал 6 (схема 3). 12 Докази для CIP в цій реакції є непрямими, імовірно, тому що його термін служби занадто короткий, щоб дозволити пряме виявлення. Вивчення швидкості реакції в розчинниках різної полярності підтримує думку про те, що радикал 6 проходить через загальний проміжний продукт у формуванні або мігруючого радикала 8, або SSIP 9. Обґрунтованим висновком є те, що загальним проміжним є контактна іонна пара 7 (Схема 3). 12 Ентропії активації, які однакові для утворення іонних пар у розчинниках з високою полярністю та групової міграції в розчинниках низької полярності, також сприяють загальному проміжному продукту, для якого 7 є основним кандидатом. 10,12 Узагальнення цих результатів призводить до механізму реакції, запропонованого в схемі 2. (Формулювання в цьому пункті також міститься в розділі V.A.5 глави 8, оскільки інформація, що міститься, стосується механізму міграції ацилоксигруп.)
Міграції фосфатокси-груп не широко поширені в хімії вуглеводів; насправді всі зареєстровані реакції включають міграцію від С-2 до С-1 в піраноїдне або фураноїдне кільце. Ця ситуація існує тому, що стабілізація, що забезпечується кільцевим атомом кисню, є критичною при перехідному стані, що призводить до утворення радикального катіону. Дослідження реактивності безвуглеводних радикалів, показаних у рівняннях 4 і 5, є повчальним. Атом кисню повинен бути повністю здатний брати участь у стабілізації радикального катіону для розриву гетеролітичного зв'язку (еквалайзер 4). 14 Заміна метоксигрупи в субстраті в реакції, показаної в еквалайзері 4, на ацетильну групу, як це робиться в реакції, показаної в еквалайзері 5, запобігає утворенню радикального катіону, оскільки атом кисню з приєднаною групою відведення електронів не здатний стабілізувати достатню кількість переходу. стан, що веде до радикально-катіонного проміжного. 14
.png)
.png)
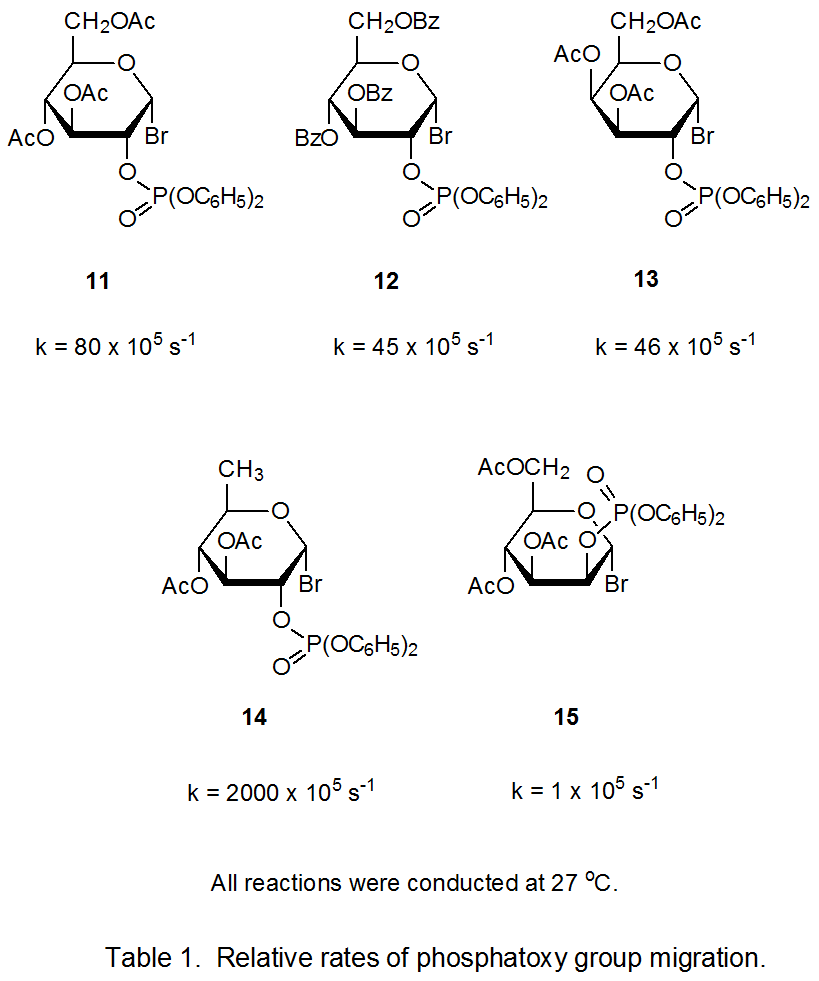
B. Відносні швидкості реакції
Відносні константи швидкості міграції фосфатоксигрупи в реакціях п'яти гексопіранозилбромідів 11 - 15 наведені в таблиці 1. 15 Константа швидкості реакції 6-дезоксиброміду 14 істотно більша, ніж для інших бромідів. Заміна відводить електронів ацилоксигрупи при С-6 атомом водню робить радикальний катіон 16 більш стабільним і при цьому стабілізує перехідний стан, що веде до нього (екв. 6).
.png)
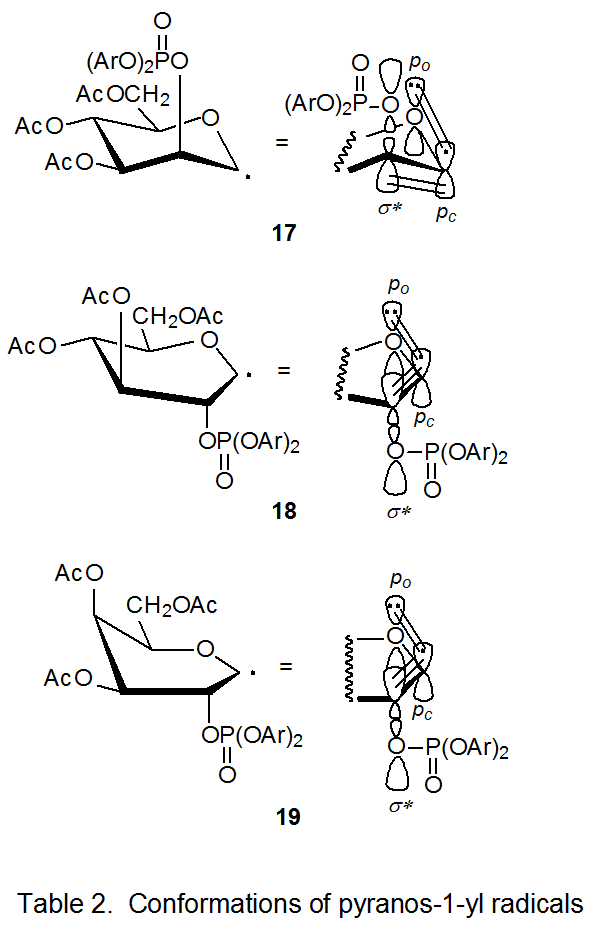
Постійна швидкості реакції D -маннопіранозилу броміду 15 рішуче менше, ніж для реакцій бромідів 11 - 14. Одним з факторів, що сприяє цій зниженій реактивності, є підвищена стабільність радикала 17 порівняно з відповідними радикалами, отриманими з інших бромідів (11 - 14). Лише 17 залишається у відносно вільної від деформації, 4 С 1 конформації, користуючись стабілізуючою взаємодією паралельних p o, p c та σ * орбіталей (табл. 2). 15 Щоб отримати вигоду від паралельно-орбітальної стабілізації, радикали, отримані з бромідів 11 - 14, повинні приймати менш стабільні конформації; наприклад, радикал, отриманий від 11, приймає конформацію човна B 2,5 18. 15 Оскільки міграція відбувається в кожному з радикалів 17 - 19, p o, p c, σ * орбітальна стабілізація втрачається, але для радикалів 18 і 19 ця втрата компенсується, при найменше частково, рухом до більш стабільної, 4 C 1 конформації. Така компенсація означає, що перехідні стани для радикально-катіонного утворення від 18 і 19 не такі високі за енергією, як для реакції 17; отже, групова міграція для радикала 17 повільніше, ніж для 18 і 19.
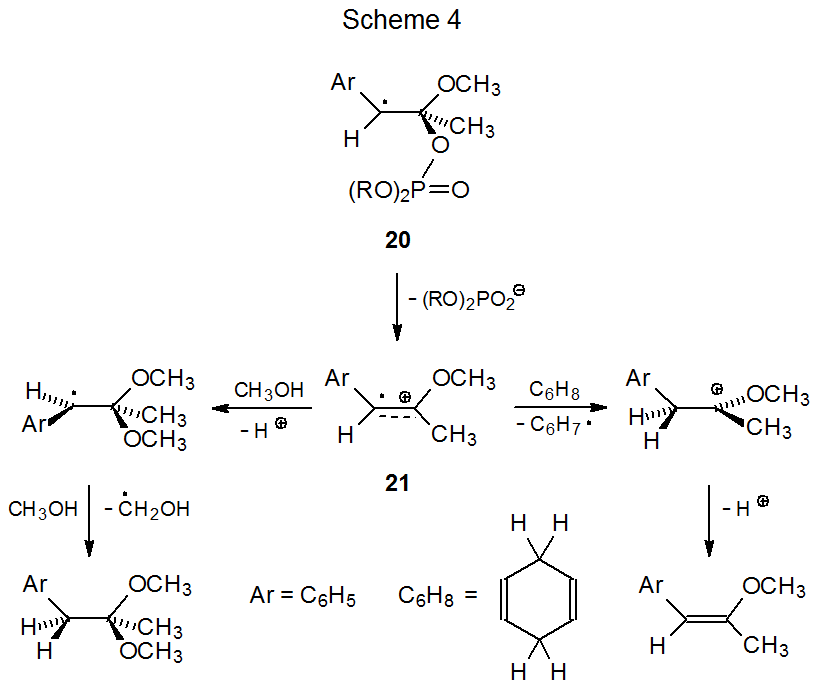
Відповідна інформація про утворення та реактивність радикальних катіонів надходить з вивчення безвуглеводних систем. 16,17 Нуклеофільне уловлювання катіона радикалу 21 метанолом (k< 1 x 10 3 M -1 s -1) є повільним порівняно з абстрагуванням атома водню з 1,4-циклогексадієну (k = 6 x 10 5 M -1 s -1) ( Схема 4). 17 Наскільки це спостереження є загальним, можна очікувати, що радикальні катіони матимуть більшу радикальну реактивність, ніж катіонна реактивність.
C. стереоселективність
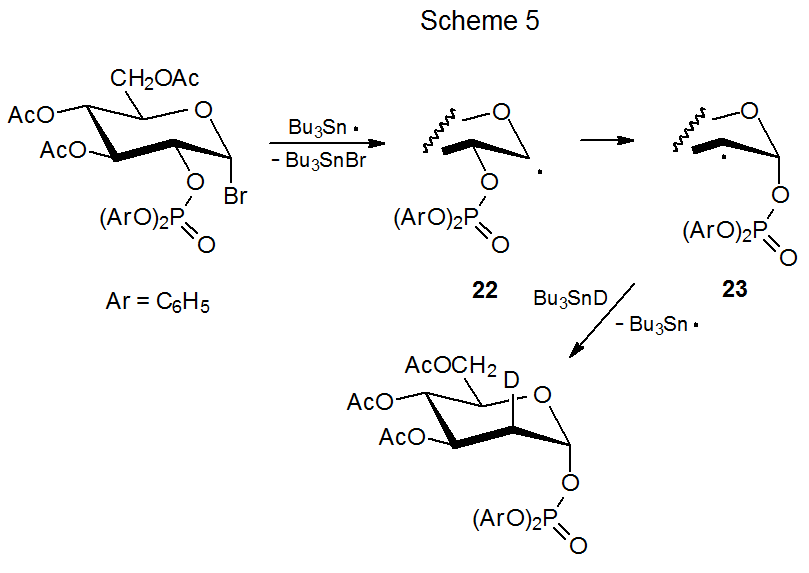
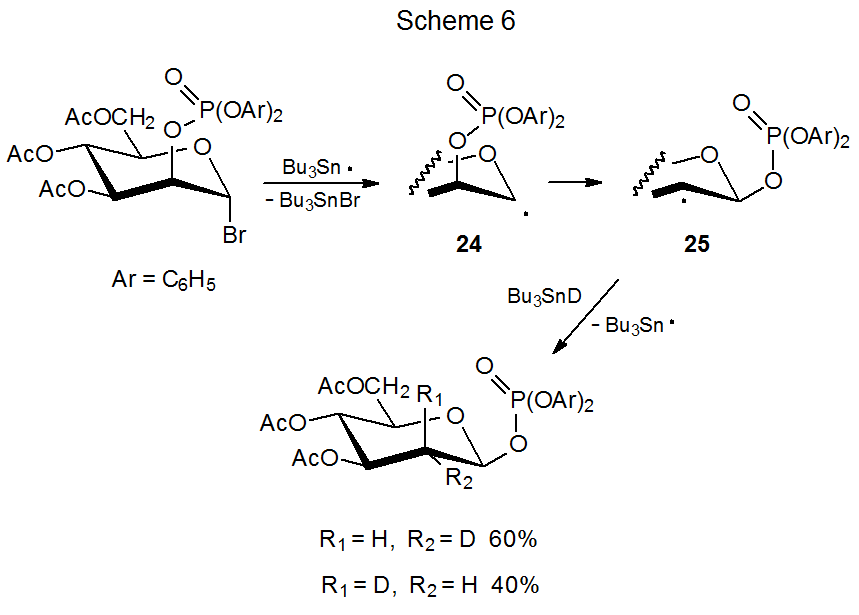
Реакції, зображені в схемах 5 і 6, показують, що міграція фосфатоксигрупи є стереоспецифічним процесом; таким чином, епімерні радикали 22 і 24 дають продукту радикали 23 і 25 відповідно. 1,15 Після того, як відбулася міграція, стереоселективна абстракція дейтерію завершує реакцію. Для радикальних 23 абстракція дуже стереоселективна, але це набагато менше для радикальних 25. Екранування α грані 23 осьової фосфатоксигрупою призводить до абстрагування дейтерію від β грані цього радикала (схема 5). Екваторіальна фосфатоксигрупа в 25 не настільки ефективна при форсуванні Bu 3 sNd до протилежної межі піраноїдного кільця (схема 6).
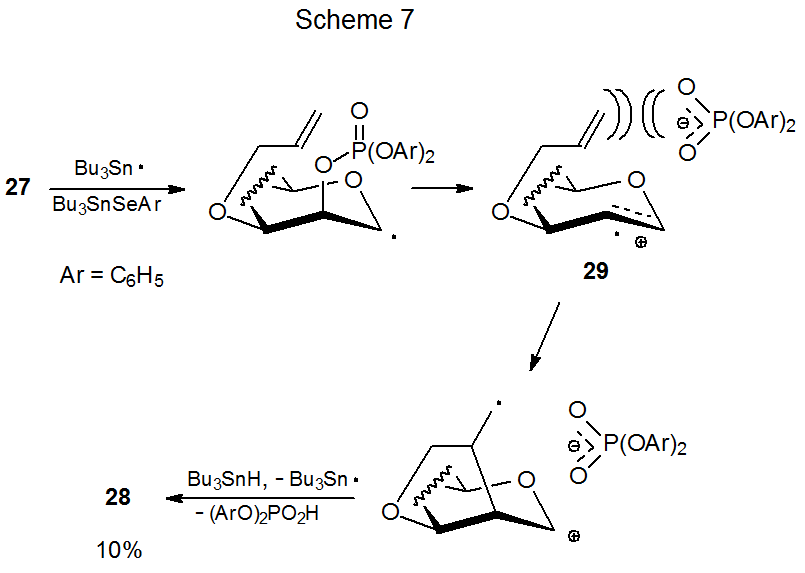
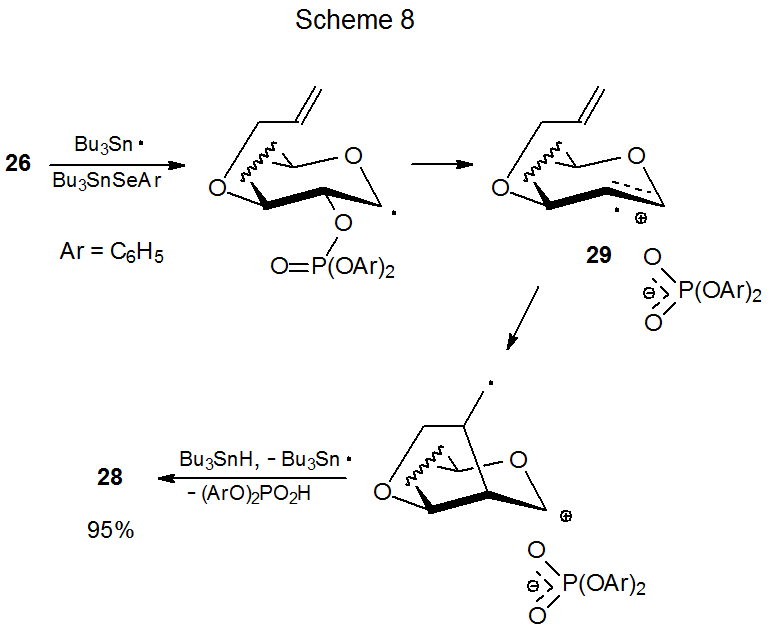
Диференціальне екранування граней піраноїдного кільця впливає на здатність фосфатів 26 і 27 піддаватися утворенню нового кільця (ур. 7). Фосфат 26 дає рішуче вищий вихід глікалю 28, ніж його епімер 27. 18 Істотно менший вихід продукту від реакції 27 пояснюється стеричним перешкодою сусіднього фосфатного протиіона при циклізації радикального катіона 29 (схема 7). Коли 29 генерується з 26, однак, лічильник іон знаходиться на протилежній грані кільця і не перешкоджає циклізації (Схема 8).
.png)