4.4: Синтез лонгіфолену
- Page ID
- 18750
Полярний аналіз функціоналізованих прекурсорів
Аналіз полярної реактивності не дуже корисний для дислокації лонгіфолену, оскільки він не має полярної функціональності. Однак функціональні попередники запропоновані шляхом розгляду можливих синтезів екзоциклічного метилену. Таким чином, алкоголь може виробляти 32 шляхом зневоднення, а алкоголь може виникнути при додаванні метилнуклеофіла до кетону 43.
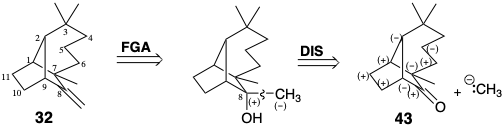
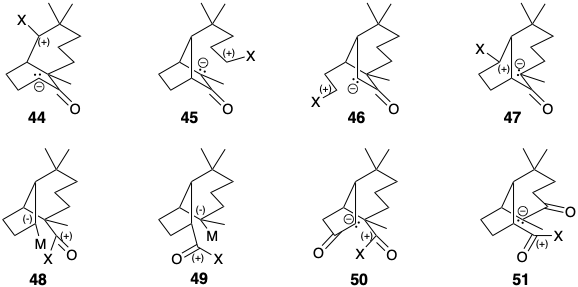
Для прямого полярного сполучного синтезу С-С 43 будь-яка додаткова полярна активуюча функціональність у попереднику повинна бути втрачена під час формування C-C зв'язку. Таким чином, 44 - 47, попередники для прямого синтезу 43, є результатом чотирьох можливих роз'єднань, які використовують потенційну нуклеофільність вуглецю a до карбонілу, тоді як 48 і 49 є результатом двох можливих роз'єднань, які експлуатують електрофільність карбонільного вуглецю. Однак може бути вигідно використовувати непряму стратегію, таку, яка включає додаткову функціональність в передостанніх проміжних продуктах скелетної конструкції (ур. 50 або 51).
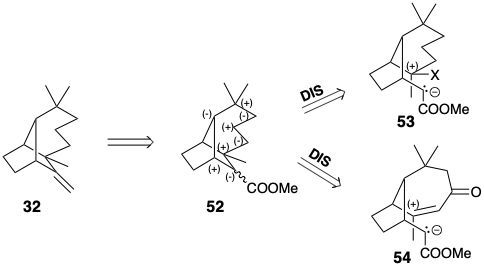
Потім ця функціональність повинна бути видалена після завершення роботи вуглецевої мережі. Наприклад, оскільки екзоциклічний метилен 32 може бути розумно отриманий з ефіру 52, інший набір проміжних продуктів, який має іншу схему реактивності, ніж перший набір, може бути сформований за допомогою аналізу полярної реактивності (наприклад, 53 та 54). Дуже багато додаткових попередників може генеруватися при розгляді дислокацій за участю додаткових активуючих груп або ненасичення.
Топологічний аналіз
Для таких молекул, як 32, які мають мінімальну функціональність і складні скелети, запропоновано інший підхід для виявлення корисних вивихів. Таким чином, увага спочатку спрямована на «вичерпний аналіз топологічних властивостей вуглецевої мережі для визначення діапазону можливих попередників... з яких бажаний скелет може бути отриманий шляхом встановлення однієї або двох сполучних зв'язків». 3 Можливі реакції, відповідний активуючий функціонал і т.д., розглядаються тільки після топологічного аналізу.
У багатьох випадках найбільш синтетично корисні дислокації виникають внаслідок видалення одного зв'язку між атомами кільцевих членів, званими загальними атомами, які пов'язані з трьома або чотирма іншими кільцевими членами (але не двома). Для лонгіфолена (32), в якому загальні атоми пронумеровані 1-4, це генерує три топологічно спрощені структури 55 - 57.
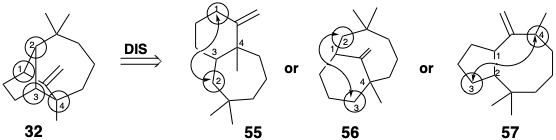
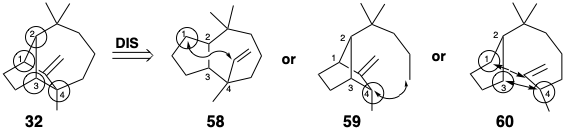
Інший корисний ряд генерується шляхом видалення одного зв'язку між загальним атомом і непоширеним атомом. Двоє учасників цієї серії - 58 і 59. Оскільки деякі реакції генерують дві нові зв'язки, наприклад циклододавання Дільса-Альдера, слід враховувати структури, створені шляхом видалення двох зв'язків вихідної мережі 32, особливо які з'єднують два сусідніх атома з одним або декількома загальними атомами, як у 60. Однак проміжні продукти, запропоновані дислокаціями, пов'язаними з видаленням зв'язку між непоширеними атомами, апріорі не можна ігнорувати.
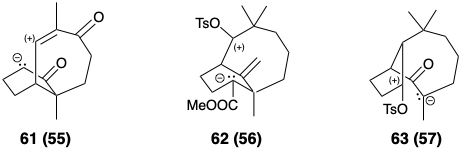
Після топологічного аналізу розглядаються специфічні реакції та відповідна функціональність, що дозволяє утворювати зв'язки. Процес повторюється до тих пір, поки не буде сформований ряд потенційних попередників для кожного передостаннього проміжного і так далі, поки синтетичне дерево не буде завершено. Оскільки функціональність додається до проміжних продуктів, топологічний аналіз стає менш актуальним. «Максимальне використання (суб) цільової функціональності» (див. Розділ 1.2) і, отже, аналіз полярної реактивності (див. Розділ 1.4) , стає основним фактором синтетичного планування. Сполуки 61 - 66 є можливими функціоналізованими похідними, відповідними структурам 55 - 60 відповідно.
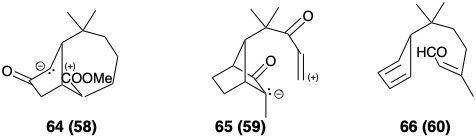
У якийсь момент робиться вибір між широким спектром можливостей. Це обов'язково повинно бути «дуже багато функції методології синтетичної хімії, доступної в той час, певних практичних міркувань, таких як наявність необхідних матеріалів і реагентів, і певних суб'єктивних суджень, що стосуються доцільності ключових реакцій або існування альтернативи». 3
Фатально недосконалі стратегії
Щоб проілюструвати підводні камені проектування складного молекулярного синтезу, спочатку розглянемо деякі невдалі стратегії синтезу лонгіфолену. Одна стратегія 4 була заснована на взаємоконвертованості шляхом перестановки лонгіфолену (32) та його гідрохлориду 67.
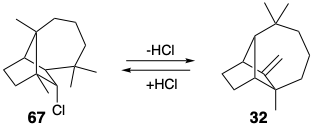
Проміжний 69, що відноситься до 65, готували в десять кроків з D-α-бромокамфори (68), яка легко доступна з натурального продукту. Однак 69 дали альдол продукт 71, а не бажаний продукт 70 в умовах реакції Майкла. Таким чином, незважаючи на готовність вихідного матеріалу, амбідентна електрофільність фрагмента генону в 69 зійшла з рейок синтетичного плану.
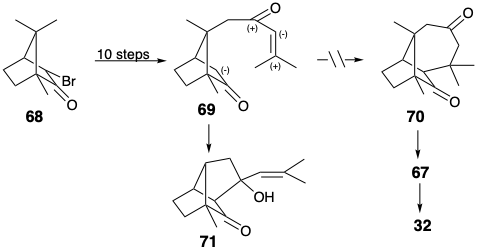
Видалення зв'язку між двома непоширеними атомами в першій дислокації з 32 призвело до розгляду потенційного проміжного 73 для синтезу лонгіфолену. 5 Цей маршрут особливо привабливий, оскільки 73 легко готується за кілька кроків з легкодоступних вихідних матеріалів. Ключова циклізація від 73 до 74 провалилася після обробки 73 кислотами.
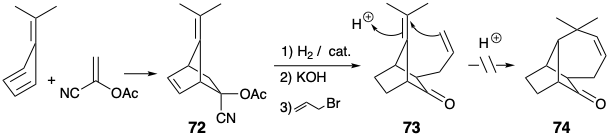
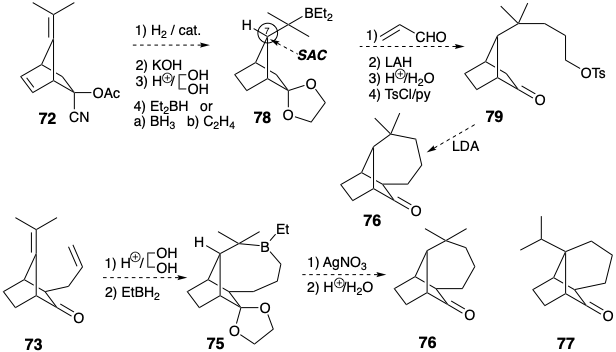
Слід вивчити інші режими циклізації, такі як 73 → 75 → 76. Але переважне початкове гідробірування монозаміщеної зв'язку C = C виключає необхідну орієнтацію для додавання до тетразаміщеної зв'язку C = C і призведе до 77. Крім того, проміжний 79, пов'язаний з 65, може бути доступний з аддукта Дільса-Альдера 72 і може піддаватися внутрішньомолекулярному алкілуванню, доставляючи 76. Контроль стеричного підходу повинен сприяти необхідної стереохімії на позиції 7 і 78.
Перший успішний синтез лонгіфолену (32) передбачає ключову циклізацію 61 → 80 як останній етап побудови скелета. 3 До речі, 61 пропонується не тільки топологічними міркуваннями (тобто структурою 55), але і аналізом полярної реактивності (тобто структура 44). Після довгих експериментів на цьому вирішальному кроці можна було досягти лише 10-20% прибутковості. Перетворення 80 до 32 тоді включало остаточне додавання метильної та метиленової групи та видалення карбонільних груп.
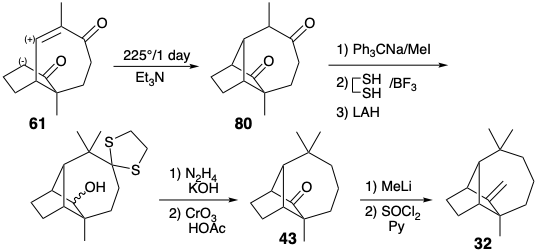
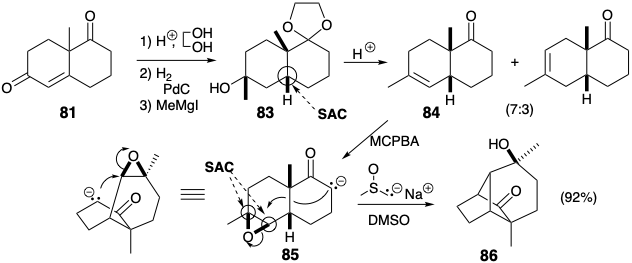
Синтез ключового проміжного 61 ілюструє стратегію, яка корисна для побудови вуглецевого скелета, а саме модифікація розміру кільця (RSM). Таким чином, 61 був отриманий з легкодоступного кетону Wieland-Miescher (81) шляхом розширення кільця від шести до семи членів. Селективна кеталізація насиченої карбонільної групи у 81 можлива завдяки дезактивації ненасиченого карбонілу\(\pi\) суміжною електронною системою.
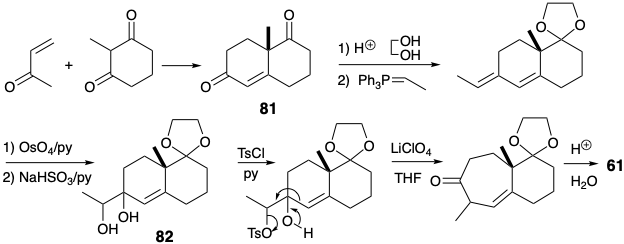
Вплив діолу 82 до звичайних кислих умов для перестановки пінакол-пінаколону призведе до іонізації третинного аллілового спирту та отримання похідного ацетилдекаліну. Тому необхідно було розробити модифіковану процедуру для направлення перестановки діолу 82 по бажаному шляху шляхом полегшення іонізації вторинного гідроксилу. Тому вторинний гідроксил був вибірково підлягав. Іонізація групи виходу лабільного тозилату супроводжувалася міграцією вінілової групи. Насичений вуглецевий ланцюг менш схильний до міграції, ніж ненасичений, оскільки в останньому можлива участь p- електронів, але не в першій перестановці.
Тактика модифікації розміру кільця
Логіка синтетичного маршруту може бути використана як інструмент для розробки стратегії або, ex post facto, як основа для досягнення фундаментального розуміння відомого синтезу. Рішення застосувати модифікацію розміру кільця у вищезгаданому синтезі 61 є логічним наслідком топологічного та полярного аналізу цієї мети. Топологічний аналіз передбачає відключення біциклічної кільцевої системи при зв'язках з плацдармом вуглеводнів, які є загальними атомами. Подвійне відключення семичленного кільця передбачає симетричний попередник, 2-заміщений 2-метилциклогексан-1,3-діон. Полярний аналіз виявляє можливість полярного відпалу для побудови циклогександіону, який використовує активацію, забезпечену двома приголосними карбонільними групами. Однак одне з бажаних роз'єднань 61 лежить на дисонансної схемі. Видалення одного атома цього дисонансного контуру (скорочення кільця) виробляє приголосний контур у 82 році та можливість побудови скелета шляхом полярної відпалу; тобто відпалювання Робінзона, що виробляє 81.
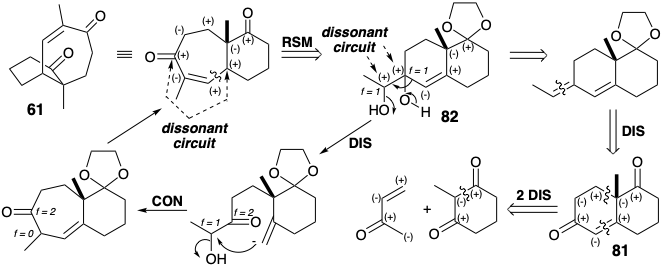
Важливо відзначити, що дисонансний контур в 61 виробляється з дисонансного попередника 82. Також, як зазначалося в попередньому розділі (див. Розділ 3.4), кільцева розширюється перестановка 82 еквівалентна гіпотетичній двоступеневої дислокації цілі, роз'єднання з подальшим підключенням. Також повчально відзначити зміни в f s, які супроводжують перестановку 82 → 61. Полярне відключення піднімає f (від +1 до +2) для електрофільного центру, що зазнає полярного відключення, від 82 і знижує f (від +1 до 0) для електрофільного центру, що проходить полярне з'єднання. Необхідний дисонанс полярної реактивності створюється неполярною реакцією, окислювальним віцинальним гідроксилюванням алкена (диоксидативного додавання). Цей алкен, очевидно, похідний від діону 81 шляхом селективної олефінації Віттіга. 81 цілком приголосний. Він може бути побудований полярними реакціями з 2-метилциклогексан-1,3-діону та метилвінілкетону. Якби процес відпалу Робінзона та кетон Віланда-Мішера (81) не були відомі, вищезгаданий ретросинтетичний аналіз призвів би до їх винаходу.
Перевірка на наявність недоліків
Розробивши вищевказану стратегію, обов'язковим є застосування кроку 4 «Протоколу синтетичного дизайну», викладеного на сторінці 23. Треба вивчити стратегію на предмет можливих недоліків. Насправді, очікується, що полярна перебудова 82 при кислотному каталізі буде слідувати альтернативним шляхом, що включає міграцію гідридів до третинного іона карбенію, який буде утворюватися легше, ніж необхідний вторинний іон карбенію. Тому стратегія була модифікована для забезпечення селективної активації вторинного гідроксилу. Таким чином, тозилювання посилило його нуклеоубіжність.
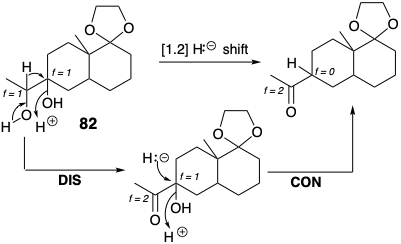
Також зверніть увагу, що узгоджена мігруюча перестановка гідриду еквівалентна двоступеневої дислокації цілі, відключення з подальшим підключенням H\({}^\ominus\). Крім того, полярне відключення гідриду піднімає f (від +1 до +2) для електрофільного вуглецевого центру, що зазнає полярного відключення (походження міграції) у 82 і знижує f (від +1 до 0) для електрофільного вуглецевого центру, що проходить полярне з'єднання (міграційна кінцева).
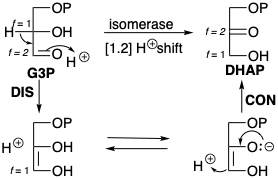
Подібні зміни в f s супроводжують полярні перебудови за участю нуклеофільного вуглецю на міграційному походженні і кінцевому, як, наприклад, при перестановці G3P на DHAP (див. Розділ 2.1). Цей процес фактично є двоступеневим дислокацією цільового ДХАП: відключення Н\({}^\oplus\) від С-1 з подальшим підключенням Н\({}^\oplus\) при С-2.
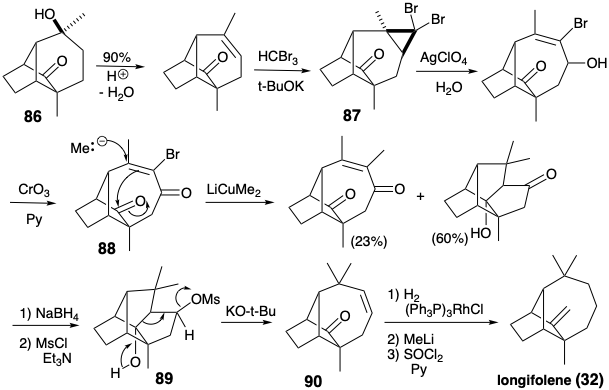
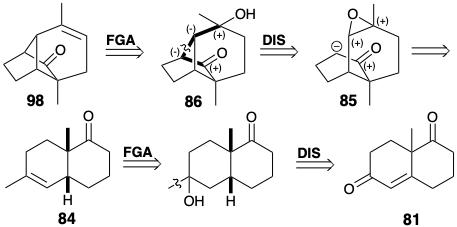
Модифікація розміру кільця може бути застосована на будь-якому етапі побудови скелета. У наступному синтезі кільцеве розширення застосовується після завершення скелетної мережі, яка топологічно еквівалентна тому, що в лонгіфолене (32). 6 Хоча скелетна мережа в 86 має мости різної довжини, ніж у 32, вона має таку ж зв'язок, як 32. Розширення одного з мостів в 86 призводить до лонгіфоленової кільцевої системи (див. Нижче). Синтез 86 має кілька важливих особливостей. Як і в попередньому синтезі 32, даний підхід починається з кетону Віланда-Мішера (81). Каталітичне гідрування протікає зі стереоселективним утворенням цис-декалону 83 за рахунок стеричного підходу контрольованого додавання водню до опуклої сторони складеної кільцевої системи 81. Аналогічно відбувається епоксидування 84 при стереоселективної доставці кисню з опуклої сторони. Стереохімія епоксиду 85 ідеально підходить для нуклеофільної атаки при внутрішньомолекулярному алкілуванні S N 2 відповідного аніону енолату. Ця ключова циклізація в синтезі лонгіфолену Мак-Мюррея протікає з відмінним виходом (92%).
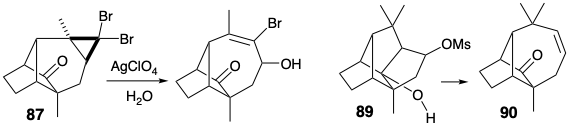
Кільцева система лонгіфолену потім була утворена з 86 кільцевим розширенням за участю перициклічного відкриття іона циклопропілкарбенію, який генерується під час сольволізу 87. Необхідне нуклеофільне 1,4-приєднання метилнуклеофіла до енону 88 супроводжувалося двома небажаними реакціями. По-перше, заміна вінілового бромозамінника метилом, породила марний побічний продукт. Однак інша, внутрішньомолекулярна конденсація альдолу, не була смертельною вадою, оскільки утворене таким чином додаткове кільце могло бути розщеплено реакцією фрагментації (89 → 90).
Розширення кільця як триступеневий процес
Знову ж таки, давайте проведемо ретросинтетичний аналіз ex post facto для досягнення більш фундаментального розуміння синтезу лонгіфолену за допомогою ключових проміжних продуктів 81 - 90. Ми розглянемо деякі альтернативи, які не були прийняті, і розглянемо стратегічні міркування, які лежать в основі обраного шляху. У цьому аналізі ми припустимо граничні умови використання 81 як вихідного матеріалу та генерації трициклічної вуглецевої мережі шляхом утворення зв'язку між початковими загальними атомами 1 і 2 (пронумеровані як 55 на сторінці 116) у біциклічному попереднику. Також функціональність буде введена шляхом припущення кетона як прабатька екзоциклічної метиленової групи. Однак замість того, щоб формувати трициклічний скелет в кінці синтезу після розширення 6 до 7-членного кільця, ми спочатку сформуємо трициклічний скелет, а потім виконаємо кільцеве розширення. Можна припустити, що четвертинний вуглець, що несе диметили дорогоцінних каменів, вставляється в шестичленне кільце попередника 92, щоб генерувати 91. Те, що 91 може містити другий карбоніл, що прилягає до плацдарму, є припущенням того факту, що цей вуглець у 92 відповідає карбонільного вуглецю в вихідному матеріалі 81 (vide infra). Зв'язок, який потрібно відключити між двома загальними атомами в 92, лежить на дисонансному контурі між карбонілами. Тому необхідна додаткова функціональність, тобто нуклеофуга, в попереднику X в 93, щоб забезпечити утворення полярних зв'язків.
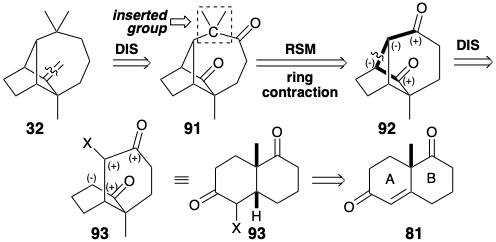
Кільцеве розширення передбачає введення атома вуглецю між двома кільцевими членами. Один зв'язок повинен бути утворений між новим вуглецем і кожним кільцевим елементом, в той час як зв'язок між кільцевими членами повинна бути розірвана. Існує два топологічно різні способи здійснення розширення кільця. Одна можливість генерації 91 з 92 аналогічна кільцевому розширенню 81 через 82 (див. Вище). Таким чином, ретро-пінаколь дислокація 91 досягається шляхом від'єднання вуглецю плацдарму (як нуклеофуга) в 91 від четвертинного вуглецю і повторного підключення його (як нуклеофіла) до сусіднього карбонільного вуглецю. Це говорить про синтепон 94 та синтетичний еквівалент 95 як попередники 91. У цій стратегії розширення кільця досягається послідовністю з'єднання-роз'єднання-з'єднання (CDC), яка починається з підключення нуклеофільного вуглецю 2-діазопропану до електрофільного карбонільного вуглецю 92.
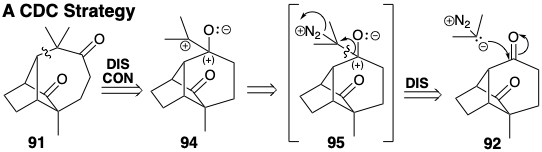
Топологічно інша стратегія, з'єднання-з'єднання-відключення (ПЗС), обов'язково включає циклопропановий проміжний продукт, який може бути утворений циклододаванням до алкену 98. Таким чином, 91 може бути отриманий з циклопропану 97, який міг ізомеризуватися до попередника циклогептену 96. Обов'язково в 96 може бути присутнім лише одна з метильних груп самоцвіту 91, оскільки вуглець, що несе цей метил, є четвертинним у попереднику циклопропілу 97. Таким чином, необхідно передбачити введення останньої метильної групи. Це може бути зроблено шляхом додавання функціональності до 96, як у 99, який має карбонільну групу, кон'юговану з центром вуглецю, до якого повинен бути доданий метил. Якщо кільцеве розширення, яке буде виробляти 99, передбачає полярну фрагментацію зв'язку з плавленням кільця в проміжному проміжному періоді циклопропану, то ретросинтетичний полярний аналіз пропонує два шляхи до 99. В обох шляхах зв'язок з кільцевим плавленням забезпечується ретросинтетичним з'єднанням з вуглецевим підшипником електропофільної субмішені функціональності, карбонілу в 99 або гідроксилу в 100. Електрони для цього з'єднання забезпечуються початковою нуклеофугою (Nu) шляхом додавання до зв'язку C = C.
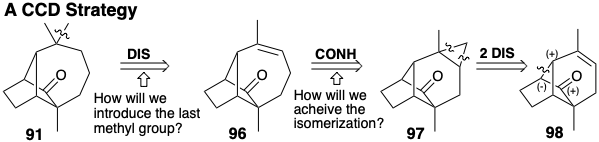
Менш прямий маршрут через 100 сумісний з попередником алкену 98. Обидва шляхи, виявлені цим аналізом, включають циклоприєднання карбена, до якого додається нуклеофуга (Nu). Хоча відходження нуклеофуги може відбутися після фрагментації зв'язку кільцево-злиття, можливі альтернативні терміни. Солволіз дибромоциклопропану, отриманого з 98, ймовірно, був би узгодженим процесом.
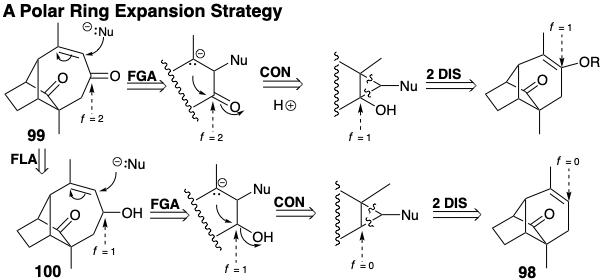
Полярний вивих 98 до аллілільного електрофілу та енолату може забезпечити недосконалу стратегію, оскільки зв'язок C = C у 99 вводить амбідентну електрофільність. Таким чином, циклізація може генерувати 102 реакцією S N 2'.
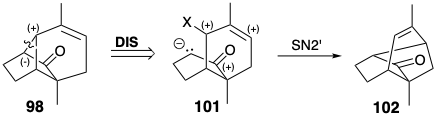
Тому зв'язок C = C в 98 найкраще вводити після циклізації, наприклад, шляхом зневоднення алкоголю 86. Зв'язок, що підлягає роз'єднанню між двома загальними атомами в 86, лежить на дисонансному контурі між карбонільною та гідроксильною групами. Тому в попереднику потрібна додаткова функціональність, наприклад 85, щоб забезпечити формування полярних зв'язків. Цей епоксид можна отримати шляхом диоксидативного додавання до алкену 84. Генерація 84 з початкового кетону 81 тривіальна.
Фрагментація плавлених велосипедів: тактика генерації великих кілець
Під час синтезу Mc Murray лонгіфолену небажане з'єднання, утворене внутрішньомолекулярної альдольної конденсацією енолату 103, що утворюється при кон'югатному додаванні метилового нуклеофіла до проміжного 88. Завдяки схильності енолату 105 до конденсації альдолу, ретро-альдольна фрагментація пентациклічного продукту 104 не могла забезпечити необхідну кільцеву систему. Цю проблему обійшла ізоелектронна (див. Стор. 80) фрагментація після зниження рівня функціональності кетону в 104 до алкоголю. Таким чином, фрагментація ретро Prins мезилату 89 породила 90, в якому слабо нуклеофільний алкен, на відміну від більш сильно нуклеофільного енолату в 105, не виявляв схильності до конденсації з карбонільною групою.
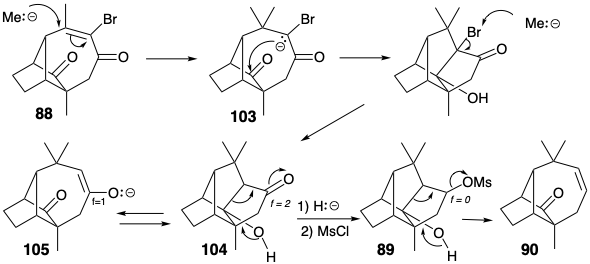
Синтез лонгіфолену Mc Murray дає два приклади фрагментації зв'язку, розділеного двома плавленими кільцями, для створення одного більшого кільця. Перший приклад використовував фрагментацію циклопропану 87 як частину тактики розширення кільця, тоді як другий, незапланований етап синтезу, передбачав фрагментацію 89.
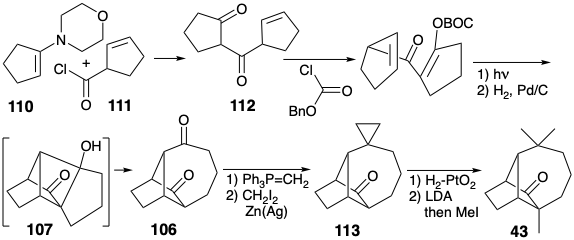
Інший синтез лонгіфолена був розроблений для використання фрагментації плавленого циклобутану. Ця стратегія визнає можливість використання карбонільної функціональності в 43 для забезпечення полярної реактивності для введення метиленової та а-метильної груп та іншої карбонільної групи, щоб дозволити введення диметилового масиву дорогоцінного каменю в попередник 106. Вивих цієї субмішені полярним зв'язком свідчить про те, що діон 106 може генеруватися фрагментацією ретроальдола β-гідроксикетону 107. На відміну від рівноваги між альдолом 104 та діоном 109, що сприяє першому, рівновага між альдолом 107 та діоном 106, як очікується, сприятиме останньому завдяки полегшенню кільцевого деформації, пов'язаного з розщепленням циклобутану.
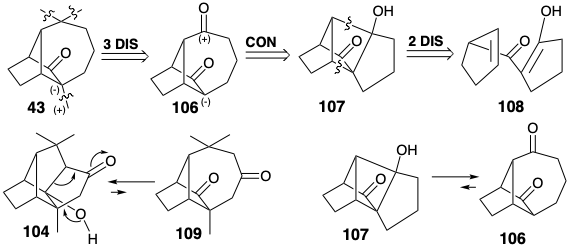
Виключно ефективний синтез лонгіфолену зумовлений застосуванням цієї стратегії. 7a Тільки 10 кроків використовуються для перетворення енаміну 110 та ацилгалогеніду 111 в лонгіфолен у загальному виході 26%. Фотоліз похідного ефіру енолу діону 112 з подальшим гідрогенолітичним видаленням групи бензилоксикарбонілів (BOC), породжених діоном 106 через 107. Селективне метиленування менш стерильно перевантаженого карбонілу в 106 з подальшим циклопропанацією, гідрогенолізом 1 1 3 та метилуванням доставленого кетону 43, проміжного продукту в синтезах лонгіфолену Корі та МакМюррея.
Маршрут циклізації полієну
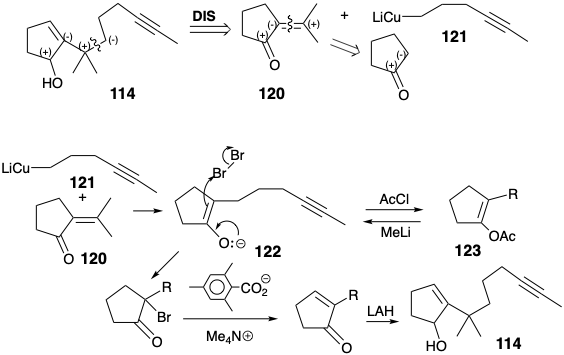
Інший ефективний синтез лонгіфолену (32) заснований на структурному спрощенні, запропонованому топологічним аналізом. Таким чином, дислокація до субмішені 60 (див. Стор. 116) шляхом видалення двох зв'язків із загальними атомами говорить про попередника, що містить лише одне кільце. При синтезі ці дві зв'язки були сформовані в ключовій кислотно-каталізованої поліенової циклізації (114 → 115). 7b Перетворення 115 в 32 вимагає відновного видалення гідроксилу. Це було досягнуто заміною S N 1 гідроксилу на гідрид через проміжний іон карбенію 116. Для забезпечення полярної активації, яка може бути використана для введення кутової метильної групи, зв'язок C = C в 117 був ізомеризований до екзоциклічного метилену в 118. Окислювальне розщеплення потім доставляється кетон 119.
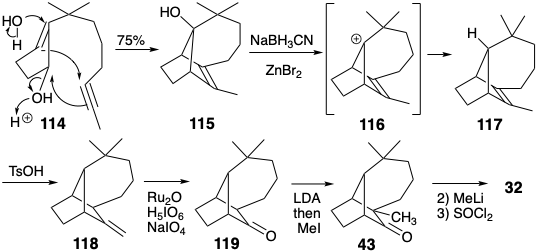
За допомогою полярного аналізу запропоновано синтез 114 з метиленциклопентанону електрофілу 120 та нуклеофільного синтону бічного ланцюга 121. Два додаткових етапи були додані до синтезу, щоб забезпечити очищення енолату 122, виробленого 1,4-додаванням 120 до 121. Таким чином, 122 опинилися в пастці O-ацилювання. Після очищення енолу ацетату 123 енолат 122 регенерували, а потім бромували. Дегідробромізація і відновлення завершили синтез 114.