11.9: Корисні шаблони для з'ясування структури
- Page ID
- 24005
Природа масових спектрів
Спектр маси зазвичай представляється у вигляді вертикальної гістограми, в якій кожен бар представляє іон, що має певне відношення маси до заряду (м/з), а довжина бару вказує на відносну кількість іона. Найбільш інтенсивному іону присвоюється велика кількість 100, і його називають базовим піком. Більшість іонів, що утворюються в мас-спектрометрі, мають один заряд, тому значення m/z еквівалентно самій масі. Сучасні мас-спектрометри легко розрізняють (розчиняють) іони, що відрізняються лише однією атомною одиницею маси, і тим самим забезпечують абсолютно точні значення молекулярної маси сполуки. Іон найвищої маси в спектрі зазвичай вважається молекулярним іоном, а іони меншої маси - фрагменти молекулярного іона, припускаючи, що зразок є єдиною чистою сполукою.
Атомна маса задається через уніфіковану одиницю атомної маси (символ: μ) або дальтон (символ: Da). В останні роки спостерігається поступова зміна до використання дальтона в перевазі уніфікованої одиниці атомної маси. Дальтон класифікується як «одиниця, що не є SI, значення якої в одиницях СІ повинні бути отримані експериментальним шляхом». Він визначається як одна дванадцята від маси решти незв'язаного атома вуглецю-12 в його ядерному та електронному наземному стані і має значення 1.660538782 (83) x10 -27 кг.
Наступна діаграма відображає масові спектри трьох простих газоподібних сполук, вуглекислого газу, пропану та циклопропану. Молекули цих сполук схожі за розмірами, СО 2 і С 3 Н 8 обидва мають номінальну масу 44 Da, а C 3 H 6 має масу 42 Да. Молекулярний іон є найсильнішим іоном в спектрах СО 2 і С 3 Н 6, і він помірно сильний в пропані. Роздільна здатність одиниці маси легко очевидна в цих спектрах (зверніть увагу на поділ іонів, що мають m/z = 39, 40, 41 і 42 в спектрі циклопропану). Незважаючи на те, що ці сполуки дуже схожі за розміром, визначити їх за індивідуальними масовими спектрами нескладно. Натиснувши на кожен спектр по черзі, буде показано аналіз часткової фрагментації та призначення піків. Навіть з такими простими сполуками, як ці, слід зазначити, що рідко можна пояснити походження всіх іонів фрагмента в спектрі. Також структура більшості фрагментних іонів рідко відома з упевненістю.
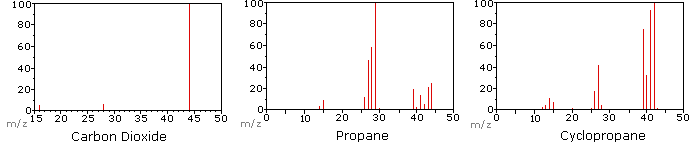
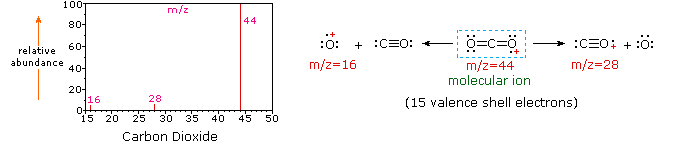
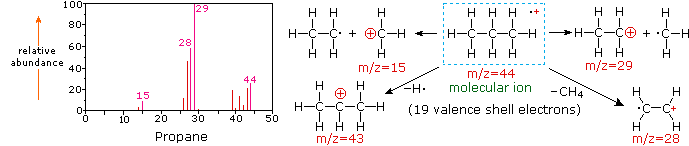
Оскільки молекула вуглекислого газу складається всього з трьох атомів, її масовий спектр дуже простий. Молекулярний іон також є базовим піком, і єдиними іонами фрагментів є CO (m/z = 28) і O (m/z = 16). Молекулярний іон пропану також має m/z = 44, але це не найпоширеніший іон у спектрі. Розщеплення вуглецево-вуглецевої зв'язку дає метиловий і етиловий фрагменти, один з яких є карбокатіоном, а інший радикальним. Спостерігаються обидва розподілу, але більший етиловий катіон (m/z = 29) є найбільш поширеним, можливо, тому, що його розмір забезпечує більший розгін заряду. Подібне розщеплення зв'язку в циклопропані не дає двох фрагментів, тому молекулярний іон сильніший, ніж в пропані, і фактично відповідає за базовий пік. Втрата атома водню до або після відкриття кільця виробляє стабільний алліловий катіон (m/z = 41). Третій найсильніший іон в спектрі має m/z=39 (C 3 H 3). Його структура невизначена, але дві можливості показані на схемі. Малий m/z = 39 іон у пропані та відсутність m/z = 29 іона в циклопропані особливо значущі для розрізнення цих вуглеводнів.
Більшість стійких органічних сполук мають парну кількість сумарних електронів, що відображають той факт, що електрони займають атомні і молекулярні орбіталі попарно. Коли один електрон видаляється з молекули, щоб дати іон, загальний підрахунок електронів стає непарним числом, і ми називаємо такі іони радикальними катіонами. Молекулярний іон у масовому спектрі завжди є радикальним катіоном, але іони фрагмента можуть бути або навіть електронними катіонами, або непарними електронно-радикальними катіонами, залежно від втраченого нейтрального фрагмента. Найпростішими і найпоширенішими фрагментаціями є розщеплення зв'язків, що виробляють нейтральний радикал (непарна кількість електронів) і катіон, що має парну кількість електронів. Менш поширена фрагментація, при якій втрачається парно-електронний нейтральний фрагмент, виробляє непарно-електронний радикальний катіонний фрагмент іона. Самі іони фрагментів можуть фрагментувати далі. Як правило, непарні електронні іони можуть фрагментувати або на непарні або парно-електронні іони, але парно-електронні іони фрагментують лише на інші парно-електронні іони. Маси молекулярних і фрагментних іонів також відображають кількість електронів в залежності від кількості атомів азоту у виду.
|
Іони без азоту |
непарні електронні іони |
парні електронні іони |
|---|---|---|
|
Іони, що мають |
непарні електронні іони |
парні електронні іони |
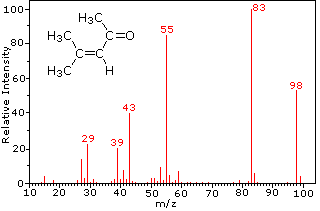
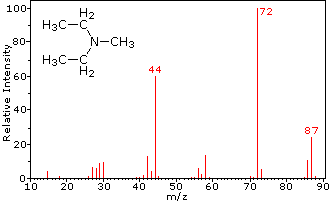
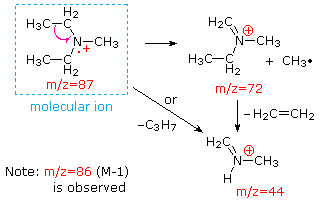
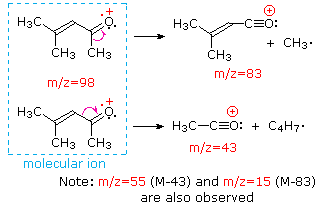
Ця відмінність добре проілюстрована наступними двома прикладами. Ненасичений кетон, 4-метил-3-пентен-2-он, зліва не має азоту, тому маса молекулярного іона (m/z = 98) - парне число. Більшість іонів фрагмента мають непарні маси, а тому є парними електронними катіонами. Діетилметиламін, з іншого боку, має один азот, а його молекулярна маса (m/z = 87) - непарне число. Більшість іонів фрагмента мають парні маси (іони при m/z = 30, 42, 56 і 58 не марковані) і є парними електронними катіонами азоту. Слабкі навіть -електронні іони при m/z = 15 і 29 обумовлені метиловими і етиловими катіонами (без атомів азоту). Фрагментації, що ведуть до головного фрагменту іонів, будуть відображені натисканням на відповідний спектр. Повторні кліки будуть циклічно відображатися.
|
 |
|
|
|
4-метил-3-пентен-2-он |
N, N-діетилметиламін |
|---|
Коли незв'язані електронні пари присутні в молекулі (наприклад, на N або O), шляхи фрагментації іноді можуть пояснюватися тим, що відсутній електрон частково локалізований на цьому атомі. Кілька таких механізмів показані вище. Розщеплення зв'язків породжує радикал і катіон, і обидва фрагменти часто поділяють ці ролі, хоча і неоднаково.
Ізотопи
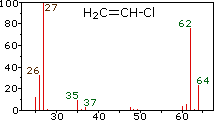
Оскільки мас-спектрометр відокремлює і виявляє іони трохи різної маси, він легко розрізняє різні ізотопи даного елемента. Це проявляється найбільш різко для з'єднань, що містять бром і хлор, про що ілюструють наступні приклади. Оскільки молекули брому мають всього два атома, спектр зліва стане несподіванкою, якщо для Br передбачається єдина атомна маса 80 Да. П'ять піків у цьому спектрі чітко демонструють, що природний бром складається з майже 50:50 суміші ізотопів, що мають атомні маси 79 та 81 Da відповідно. Таким чином, молекула брому може складатися з двох атомів 79 Br (маса 158 Da), двох атомів 81 Br (маса 162 Da) або більш ймовірної комбінації 79 Br- 81 Br (маса 160 Da). Фрагментація Br 2 до катіону брому призводить до рівних розмірів іонних піків при 79 і 81 Da.
 |
 |
 |
||
|
брому |
вінілхлорид |
метилен хлорид |
|---|
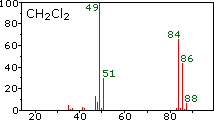
Центральний і правий спектри показують, що хлор також складається з двох ізотопів, більш рясні мають масу 35 Da, а незначний ізотоп масою 37 Da. Точний ізотопний склад хлору і брому:
- Хлор: 75,77% 35 Cl і 24,23% 37 Cl
- Бром: 50,50% 79 Br і 49,50% 81 Br
Наявність хлору або брому в молекулі або іоні легко виявити, помітивши співвідношення інтенсивності іонів, що відрізняються на 2 Da. У випадку метиленхлориду молекулярний іон складається з трьох піків при m/z = 84, 86 і 88 Da, і їх зменшувальні інтенсивності можуть бути розраховані на основі природних достатків, наведених вище. Втрата атома хлору дає два іони ізотопного фрагмента при m/z = 49 & 51 Da, чітко включаючи один атом хлору. Фтор і йод, навпаки, є моноізотопними, мають маси 19 Da і 127 Da відповідно. Слід зазначити, що наявність атомів галогену в молекулі або фрагменті іона не змінює непарних правил маси, наведених вище.
Щоб скористатися калькулятором, який прогнозує кластери ізотопів для різних комбінацій хлору, брому та інших елементів Натисніть тут. Ця програма була розроблена в Colby College.
|
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
Два інших загальних елемента, що мають корисні ізотопні сигнатури, - вуглець, 13 С - 1,1% природного достатку, а сірка, 33 S і 34 S - 0,76% і 4,22% природного достатку відповідно. Наприклад, малий пік m/z = 99 Da в спектрі 4-метил-3-пентен-2-он (вище) обумовлений наявністю в молекулярному іоні одного атома 13 С. Хоча менш важливі в цьому відношенні, 15 N і 18 O також роблять невеликий внесок у більш високі масові супутники молекулярних іонів, що включають ці елементи.
Калькулятор праворуч може бути використаний для обчислення ізотопних внесків в іонну кількість 1 і 2 Da більше молекулярного іона (M). Просто введіть відповідний індексний номер праворуч від кожного символу, залишивши ці елементи не порожніми, і натисніть кнопку «Розрахувати». Цифри, що відображаються в полах M+1 та M+2, відносно M встановлюються на рівні 100%.
Шаблони фрагментації
Фрагментація молекулярних іонів в асортимент фрагментних іонів є змішаним благословенням. Характер фрагментів часто дає підказку до молекулярної структури, але якщо молекулярний іон має термін служби менше декількох мікросекунд, він не витримає достатньо довго, щоб його спостерігали. Без молекулярного іонного піку як еталонного, складність інтерпретації масового спектру помітно зростає. На щастя, більшість органічних сполук дають масові спектри, які включають молекулярний іон, і ті, які не часто успішно реагують на використання більш м'яких умов іонізації. Серед простих органічних сполук найбільш стабільними молекулярними іонами є ті з ароматичних кілець, інших кон'югованих пі-електронних систем та циклоалканів. Спирти, ефіри та сильно розгалужені алкани, як правило, демонструють найбільшу тенденцію до фрагментації.
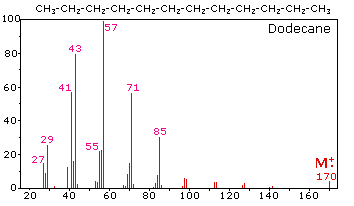
Масовий спектр додекану справа ілюструє поведінку нерозгалуженого алкана. Оскільки в цій молекулі немає гетероатомів, немає беззв'язних електронів валентної оболонки. Отже, радикально-катіонний характер молекулярного іона (m/z = 170) делокалізується по всіх ковалентних зв'язках. Фрагментація C-C-зв'язків відбувається тому, що вони зазвичай слабкіші, ніж C-H зв'язки, і це виробляє суміш алкільних радикалів і алкілкарбокатіонів. Позитивний заряд зазвичай знаходиться на меншому фрагменті, тому ми бачимо гомологічний ряд гексил (m/z = 85), пентил (m/z = 71), бутил (m/z = 57), пропілового (m/z = 43), етилового (m/z = 29) і метилового (m/z = 15). Вони супроводжуються набором відповідних алкенільних карбокатіонів (наприклад, m/z = 55, 41 & 27), утворених втратою 2 Н. Всі значні фрагментні іони в цьому спектрі є парними електронними іонами. У більшості алканових спектрів найбільш поширені пропіл і бутил-іони.
Наявність функціональної групи, особливо тієї, що має гетероатом Y з незв'язними валентними електронами (Y = N, O, S, X тощо), може різко змінити картину фрагментації сполуки. Вважається, що цей вплив відбувається через «локалізацію» радикального катіонного компонента молекулярного іона на гетероатомі. Адже легше видалити (іонізувати) незв'язний електрон, ніж той, який входить до складу ковалентного зв'язку. Локалізуючи реактивний фрагмент, будуть сприяти певним процесам фрагментації. Вони узагальнені на наступній схемі, де зелений затінений ящик вгорі відображає приклади таких «локалізованих» молекулярних іонів. Перші два шляхи фрагментації призводять до парно-електронних іонів, а елімінація (шлях #3) дає непарно-електронний іон. Зверніть увагу на використання різних криволінійних стрілок, щоб показати зсуви одиночних електронів порівняно зі зміщеннями електронних пар.
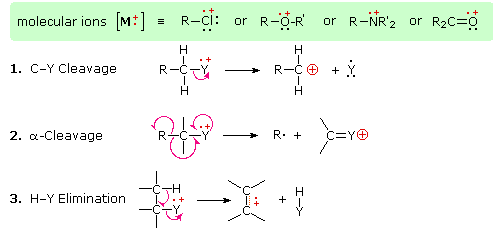
Показані вище розподіли зарядів є загальними, але для кожного процесу розщеплення заряд іноді може переноситися іншими (нейтральними) видами, і спостерігаються обидва фрагментні іони. З трьох реакцій розщеплення, описаних тут, альфа-розщеплення, як правило, сприяє азоту, кисню та сполук сірки. Дійсно, в раніше відображених спектрах 4-метил-3-пентен-2-он і N, N-діетилметиламін основні іони фрагментів надходять з альфа-розщеплення. Подальші приклади впливу функціональної групи на фрагментацію наводяться підбіркою сполук, які можна вивчити натисканням лівої кнопки нижче. Корисні таблиці загальних іонів фрагментів і нейтральних видів можна переглянути натисканням правої кнопки.
|
|
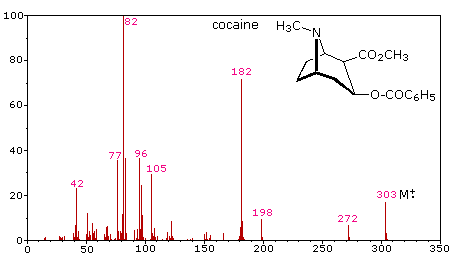
Складність фрагментаційних моделей призвела до того, що масові спектри використовуються як «відбитки пальців» для ідентифікації сполук. Забруднювачі навколишнього середовища, залишки пестицидів на харчових продуктах та ідентифікація контрольованих речовин - лише кілька прикладів цього застосування. Для такого аналізу достатньо вкрай невеликих зразків невідомого речовини (мікрограма або менше). Наступний масовий спектр кокаїну демонструє, як криміналістична лабораторія може визначити природу невідомого вуличного наркотику. Незважаючи на те, що відбулася велика фрагментація, багато з більш рясних іонів (ідентифікованих пурпуровими числами) можуть бути раціоналізовані трьома механізмами, показаними вище. Правдоподібні призначення можна побачити, натиснувши на спектр, і слід зазначити, що всі є парно-електронними іонами. Іон m/z = 42 може бути будь-яким або всім наступним: C 3 H 6, C 2 H 2 O або C 2 H 4 N. Точне призначення може бути зроблено з високої роздільної здатності m/z значення (наступний розділ).
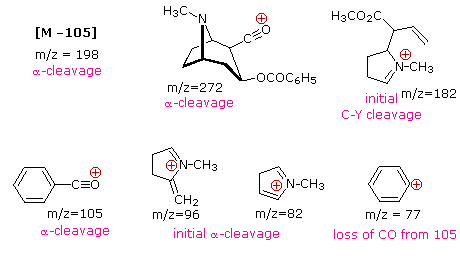
Іони непарного електронного фрагмента часто утворюються характерними перебудовами, при яких втрачаються стійкі нейтральні фрагменти. Механізми деяких з цих перебудов були ідентифіковані шляхом проходження курсу ізотопічно маркованих молекулярних іонів. Кілька прикладів цих механізмів перестановки можна побачити, натиснувши наступну кнопку.
|
Вправа
7. Які маси всіх компонентів в наступних фрагментаціях?

- Відповідь
-
7.