11.7: Мас-спектрометрія - введення
- Page ID
- 23967
Цілі навчання
Після завершення цього розділу ви повинні мати можливість
- намалюйте просту діаграму, щоб показати основні особливості мас-спектрометра.
- визначити піки в простому масовому спектрі і пояснити, як вони виникають.
Ключові умови
Переконайтеся, що ви можете визначити та використовувати в контексті ключові терміни нижче.
- батьківський пік (молекулярно-іонний пік)
- відносна достаток
- мас-спектроскопія
- молекулярний іон (M+·)
- відношення маси до заряду (м/z)
Навчальні примітки
Ви можете пам'ятати із загальної хімії першого року, як мас-спектроскопія була використана для встановлення атомної маси та великої кількості ізотопів.
Мас-спектрометри великі і дорогі, і зазвичай експлуатуються тільки повністю підготовленим персоналом, тому у вас не буде можливості використовувати такий прилад в рамках даного курсу. Дослідження хіміків часто досить сильно покладаються на масові спектри, щоб допомогти їм у ідентифікації сполук, і вам потрібно буде інтерпретувати прості масові спектри як в завданнях, так і на експертизах. Відзначимо, що в більшості спроб ідентифікувати невідоме з'єднання хіміки не покладаються виключно на результати, отримані за допомогою єдиної спектроскопічної методики. Зазвичай використовується поєднання хімічних та фізичних властивостей та спектральних доказів.
Мас-спектрометр
Для вимірювання характеристик окремих молекул мас-спектрометр перетворює їх в іони, щоб ними можна було переміщатися та маніпулювати зовнішніми електричними та магнітними полями. Три основні функції мас-спектрометра та пов'язані з ними компоненти:
- Іони сортуються і відокремлюються відповідно до їх маси і заряду. Аналізатор маси
- Потім відокремлені іони вимірюються, а результати відображаються на графіку. Детектор
Оскільки іони дуже реактивні і короткочасні, їх утворення і маніпулювання повинні проводитися у вакуумі. Атмосферний тиск становить близько 760 торр (мм ртутного стовпа). Тиск, під яким можуть оброблятися іони, становить приблизно 10 -5 до 10 -8 торр (менше мільярдної частини атмосфери). Кожне з трьох перерахованих вище завдань може бути виконано по-різному. В одній загальній процедурі іонізація здійснюється пучком високої енергії електронів, а поділ іонів досягається прискоренням і фокусуванням іонів в пучку, який потім згинається зовнішнім магнітним полем. Потім іони виявляються в електронному вигляді, а отримана інформація зберігається та аналізується в комп'ютері. Мас-спектрометр, що працює таким чином, викладено на наступній схемі. Серцем спектрометра є джерело іонів. Тут молекули зразка (чорні точки) бомбардуються електронами (світло-блакитними лініями), що виділяються з нагрітої нитки. Це називається EI (електронно-ударним) джерелом. Гази і леткі зразки рідини допускається просочуватися в джерело іонів з резервуара (як показано на малюнку). Нелеткі тверді речовини та рідини можуть вводитися безпосередньо. Катіони, утворені при бомбардуванні електронів (червоні точки), відштовхуються зарядженою відлякувальною пластиною (аніони притягуються до неї), і прискорюються в бік інших електродів, маючи щілини, через які іони проходять у вигляді пучка. Деякі з цих іонів фрагментуються на більш дрібні катіони і нейтральні фрагменти. Перпендикулярне магнітне поле відхиляє іонний пучок в дузі, радіус якої обернено пропорційний масі кожного іона. Легші іони відхиляються більше, ніж важчі іони. Змінюючи напруженість магнітного поля, іони різної маси можуть поступово фокусуватися на детекторі, закріпленому на кінці вигнутої трубки (також під високим вакуумом).
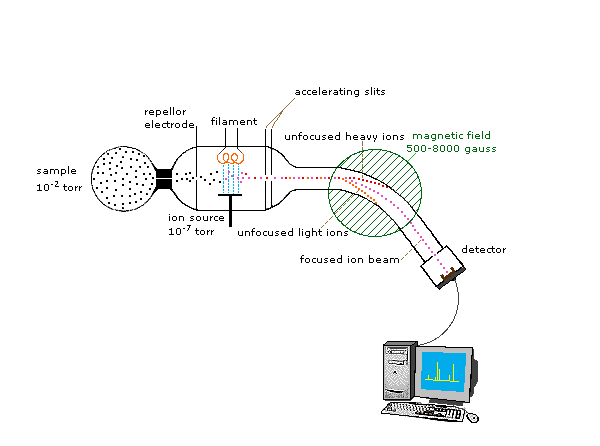
Коли електрон високої енергії стикається з молекулою, він часто іонізує її, збиваючи один з молекулярних електронів (або зв'язування, або незв'язування). Це залишає після себе молекулярний іон (пофарбований в червоний колір на наступній схемі). Залишкова енергія від зіткнення може призвести до фрагментації молекулярного іона на нейтральні шматки (пофарбовані в зелений колір) та менші іони фрагментів (кольорові рожеві та помаранчеві). Молекулярний іон є радикальним катіоном, але іони фрагмента можуть бути або радикальними катіонами (рожевими), або карбокатіонами (помаранчевими), в залежності від характеру нейтрального фрагмента. Анімоване відображення цього процесу іонізації з'явиться, якщо натиснути на джерело іонів діаграми мас-спектрометра.
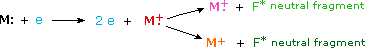
Нижче наведено типовий вихід для електронно-іонізаційного експерименту MS (дані MS нижче походять від Спектральної бази даних для органічних сполук, безкоштовної веб-служби, що надається AIST в Японії.
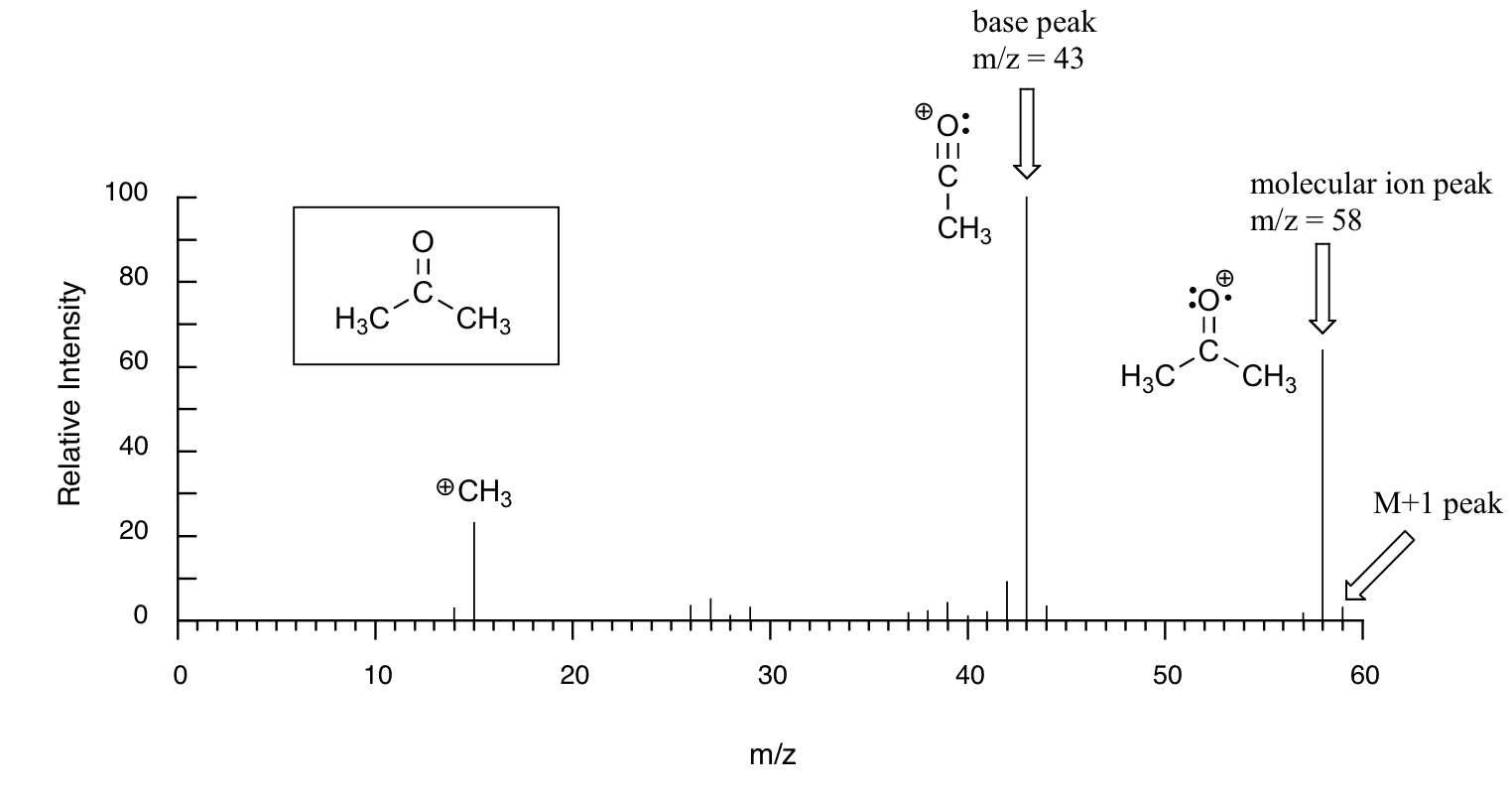
Зразок - ацетон. На горизонтальній осі - значення для m/z (як ми вже заявляли вище, заряд z майже завжди дорівнює +1, тому на практиці це те ж саме, що і маса). На вертикальній осі знаходиться відносна чисельність кожного виявленого іона. У цій шкалі найбільш поширений іон, званий базовим піком, встановлюється на 100%, а всі інші піки записуються щодо цієї величини. Для ацетону базовий пік відповідає фрагмент з m/z = 43 -. Молекулярна маса ацетону становить 58, тому ми можемо визначити пік при m/z = 58 як той, що відповідає піку молекулярних іонів, або батьківському піку. Зверніть увагу, що існує невеликий пік при m/z = 59: це називається піком M+1. Як може бути іон, який має більшу масу, ніж молекулярний іон? Просто: невелика частка - близько 1,1% - всіх атомів вуглецю в природі насправді є 13 С, а не ізотопом 12 С. Ізотоп 13 С, звичайно, важче 12 С на 1 одиницю маси. Крім того, близько 0,015% всіх атомів водню насправді є дейтерієм, ізотопом 2 Н. Таким чином, пік M+1 представляє ті нечисленні молекули ацетону в зразку, які містили або 13 C, або 2 H.