7.6: Діоксид вуглецю
- Page ID
- 17987
Вуглекислий газ (СО 2) є найбільш стійким оксидом вуглецю і утворюється в результаті спалювання вуглецю або вуглецесодержащих сполук в повітрі або надлишку кисню, (7.6.1). Для промислового застосування його зазвичай готують з розкладання карбонату кальцію (вапняку), (7.6.2), а не відділення від продуктів згоряння.
\[ \text{C + O}_2 \rightarrow \text{CO}_2\]
\[ \text{CaCO}_3 \rightarrow \text{CaO + CO}_2\]
Фазова хімія вуглекислого газу
Вуглекислий газ не існує у вигляді рідини при нормальному атмосферному тиску, але твердий CO 2 (також відомий як сухий лід) підноситься при -78,5° C (рис.\(\PageIndex{1}\)). Сухий лід (рис.\(\PageIndex{2}\)) зазвичай використовується як холодоагент для збереження харчових продуктів або біологічних зразків.


Примітка
При поміщенні сухого льоду в воду (особливо нагріту) сублімація прискорюється, і створюється малопотопає щільна хмара туману (димоподібний). Це використовується в туманних автоматах, в театрах, концертах, будинках з привидами та нічних клубах для драматичних ефектів (рис.\(\PageIndex{3}\)). Туман від сухого льоду ширяє над землею на відміну від інших машин штучного туману (які використовують часткове згоряння нафти), де туман піднімається, як дим.

Надкритичний вуглекислий газ
Як зазначалося вище, вуглекислий газ зазвичай поводиться як газ у повітрі при стандартній температурі і тиску (STP = 25° C і 1 атм) або як тверда речовина при заморожуванні. Однак, якщо температура і тиск збільшені від STP до критичної точки або вище критичної точки (рис.\(\PageIndex{1}\)), вуглекислий газ приймає властивості посередині між газом і рідиною (T c = 31,1° C і P c = 72,9 атм).
Надкритичний СО 2 став важливим промисловим розчинником завдяки своїй ролі в хімічній екстракції на додаток до низької токсичності та впливу на навколишнє середовище. У зв'язку з цим він розглядається як перспективний зелений розчинник. Одне з найбільших застосувань - це без кофеїну кави та чаю, не залишаючи залишків і дозволяючи кофеїну відокремлювати та використовувати в інших продуктах напоїв.
Структура і склеювання
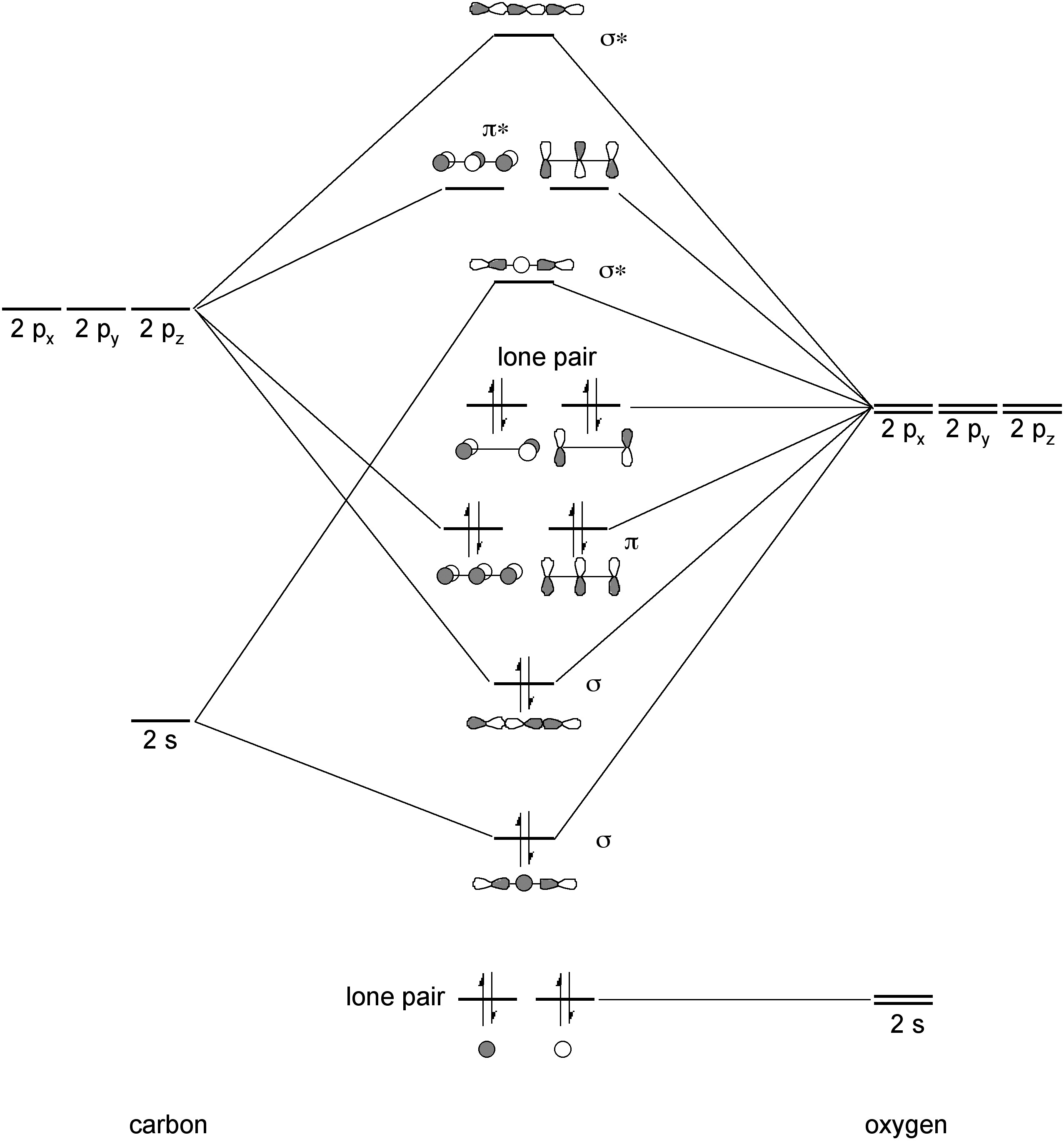
Вуглекислий газ є лінійною молекулою за рахунок π-локалізації. Склеювання в СО 2 включає 2 σ-зв'язку і 2 набори 3 центральних π-зв'язків (рис.\(\PageIndex{4}\)). Довжина зв'язку C-O 1,2 Å слід порівнювати зі значенням, що спостерігається для органічних карбонілів (наприклад, кетонів, ефірів, альдегідів) 1.2 — 1.3 Å.
Розчинення і реакція з водою
Хоча СО 2 не має дипольного моменту, він дуже полярний (діелектрична проникність = 1,60 при 0° C, 50 атм) і, отже, розчиняється в полярних розчинниках, таких як вода, до концентрації 18% (0,04 М). Більша його частина (+99%) присутня у вигляді сольватированного СО 2 (рис.\(\PageIndex{5}\)), і лише близько 0,2% реагує з утворенням вугільної кислоти (7.6.1), з подальшими рівновагами, що призводять до утворення бікарбонату (HCO 3 -) і карбонату (CO 3 2-).
\[ \text{H}_2\text{O + CO}_2 \rightarrow \text{H}_2\text{CO}_3\]
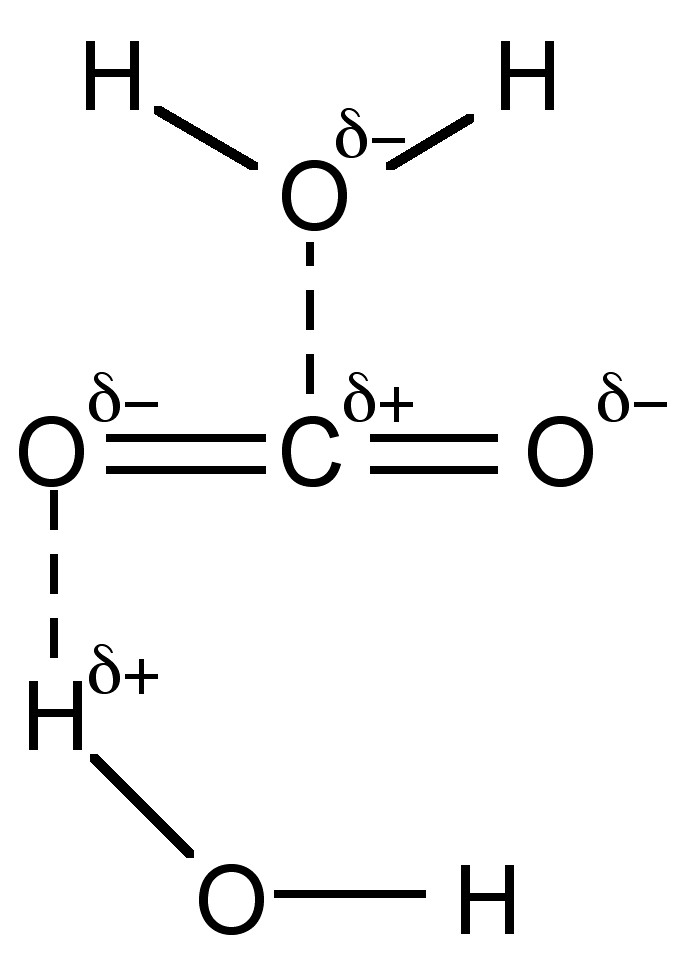
Загальна реакція передбачає ряд рівноваг. Перша рівновага - утворення вугільної кислоти, (7.6.4). Швидкість реакції, (7.6.5), знаходиться на величині 1 секунди (тобто повільної), і як наслідок, коли вуглекислий газ переноситься в організмі, присутній фермент для прискорення реакції.
\[ \text{CO}_{\text{2(solv)}} \text{ + H}_2\text{O} \xrightleftharpoons[\text{k}_{\text{H}_2\text{CO}_3}]{\text{k}_{\text{CO}_2}} \text{H}_2\text{CO}_3\]
\[ \text{K = } \dfrac{\text{k}_{\text{H}_2\text{CO}_3}}{\text{k}_{\text{CO}_2}} \text{ = } \dfrac{25}{0.04} \text{ = 600}\]
2-е рівновага є наслідком першої іонізації вугільної кислоти з утворенням бікарбонату (HCO 3 -), (7.6.6). На відміну від першої реакції, (7.6.4), ця реакція дуже швидка з K eq = 1.6 x 10 -4 @ 25° C.
\[ \text{H}_2\text{CO}_3 \rightleftharpoons \text{HCO}_3^- \text{ + H}^+ \]
3-е рівновага передбачає утворення карбонатного іона (7.6.7), і має K eq = 4,84 х 10 -11. Карбонат (CO 3 2-) - це делокалізований ліганд, який може виступати в якості моно- або бідентатної або мостової групи.
\[ \text{HCO}_3^- \rightleftharpoons \text{CO}_3^{2-} \text{ + H}^+ \]
Освіта вугільної кислоти є причиною того, що навіть при відсутності забруднюючих речовин (таких як SO 2) природна дощова вода є слабокислою через розчиненого СО 2. Рівновага, пов'язана з вугільною кислотою, також відповідає за буферизацію рН в крові.
хімія реакції
Фотосинтез у рослин знижує СО 2 до органічної речовини, але подібні реакції ще не розвинені в неживих системах.
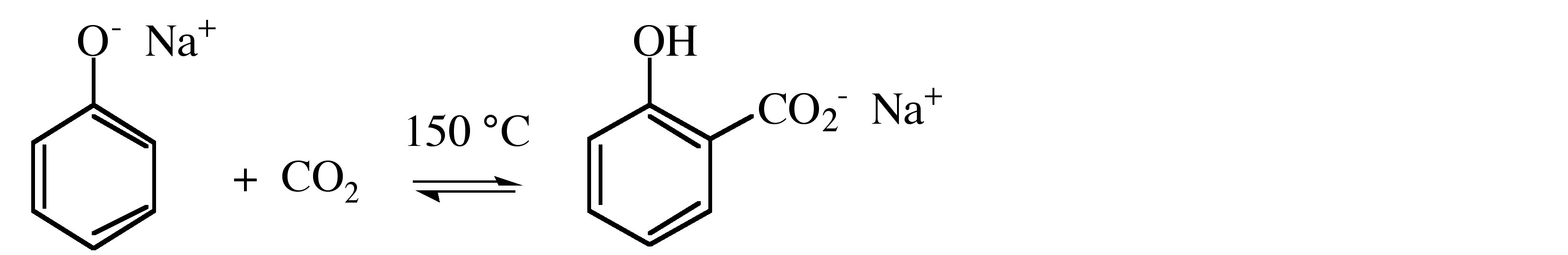
Гриньяри легко реагують з вуглекислим газом, утворюючи карбоксилат, який дає пов'язану карбонову кислоту при гідролізі, (7.6.8). Подібні реакції відбуваються і з іншими металоорганічними сполуками. Крім того, СО 2 реагує з солями лужних металів фенолів (фенолатів) з отриманням гідроксикарбоксилату.
\[ \text{RMgX + CO}_2 \rightarrow \text{RCO}_2\text{MgX} \xrightarrow{\text{H}_2\text{O}} \text{RCO}_2\text{H + HOMgX}\]
Відомий ряд комплексів СО 2 з перехідними металами, в яких координація може відбуватися через центральний вуглець (рис.\(\PageIndex{6}\) А) або зв'язок C = O (рис.\(\PageIndex{6}\) b). Як варіант, СО 2 може перемикати два металеві центри.

Глобальне потепління і вуглекислий газ
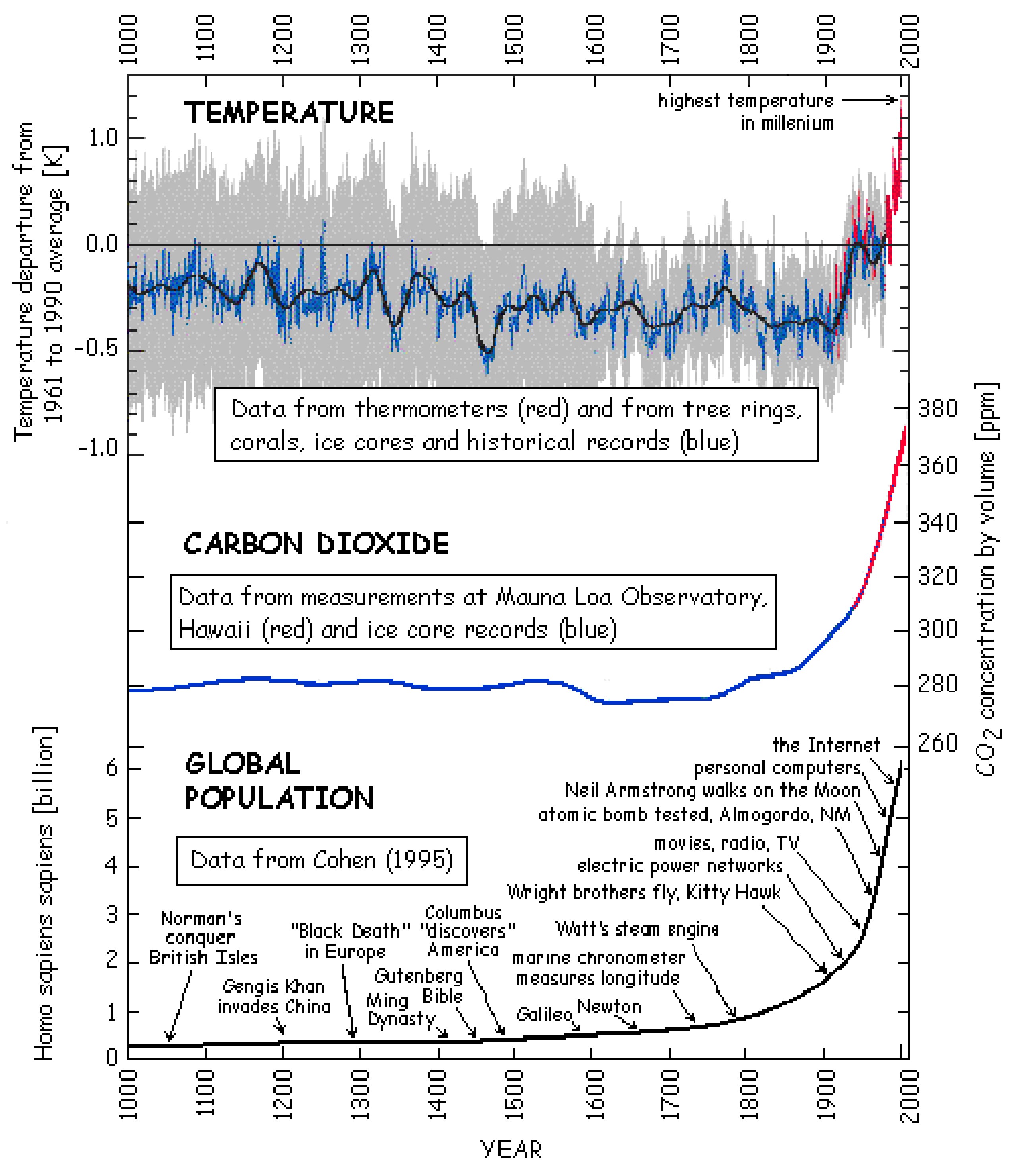
Глобальне потепління - це процес спостережуваного підвищення середньої температури приповерхневого повітря Землі і океанів з середини 20-го століття. Глобальна температура поверхні збільшилася на 0,74° C (1.33° F) між початком і кінцем 20-го століття (рис.\(\PageIndex{7}\)). Загальноприйнято вважати, що більшість цього підвищення температури відбулося з середини 20-го століття і було викликано збільшенням концентрації парникових газів внаслідок спалювання викопного палива (генерація додаткового CO 2) та вирубки лісів (втрата механізм споживання СО 2) див\(\PageIndex{7}\). Рис. Незважаючи на те, що природні явища (включаючи сонячну радіацію та вулкани) спричинили більшу частину потепління з доіндустріальних часів, масштаби змін, спричинених глобальною індустріалізацією, є більш значною.
Атмосфера Землі виконує дві функції. По-перше, озон (O 3) у верхній атмосфері екранує шкідливий УФ від досягнення поверхні Землі. По-друге, оскільки сонячне випромінювання проникає в атмосферу, частина тепла потім зберігається як наслідок СО 2 в атмосфері. Саме цей процес модулює температуру поверхні і забезпечує стабільне середовище для життя. Невдача або зміна будь-якого з цих процесів може мати різкий вплив на життєздатність планети.
Розглянемо відносне положення Венери, Землі і Марса до Сонця (рис.\(\PageIndex{8}\)). Чим ближче планета до сонця, тим більше УФ-випромінювання і тим більше нагрівання планети; однак температура також сильно модулюється атмосферою. Венера має атмосферу, що містить 95% CO 2 і має температуру поверхні приблизно 450° C. навпаки, в той час як атмосфера Марса також 95% CO 2, вона лише на 1% настільки ж щільна, як у Землі, і, таким чином, температура поверхні коливається від 40° C протягом дня (через радіаційне нагрівання) до -80 °C вночі (через відсутність збереженого тепла через тонку атмосферу). Їх слід порівнювати з земною атмосферою, яка становить 0,038% CO 2, що дозволяє зберегти правильну кількість тепла для підтримки життя. Очевидно, що будь-яка суттєва зміна вмісту CO 2 в атмосфері змінить глобальні температури планети.
Бібліографія
- Н. Стерн, Огляд Стерна: Економіка зміни клімату, Казначейство HM, Лондон.
- Гупта та Дж.-Дж. Shim, Розчинність у надкритичному діоксиді вуглецю, CRC Press (2006).
- Захоплення та зберігання вуглекислого газу: Спеціальний звіт Міжурядової групи з питань зміни клімату, Cambridge University Press (2005).
