5.4: Ртуторганічні сполуки
- Page ID
- 17960
Синтез
Найбільш поширені шляхи до ртуторганічних сполук передбачають пряму реакцію ртуті з алкілйодидом (рівняння 5.4.1) з утворенням ртутного аналога реагенту Гріньяра.
\[\text{Hg + RX} \rightarrow \text{RHgX}\]
Подальша реакція rHGi з ціанідом калію дає відповідну похідну диалкілртуті (рівняння 5.4.2).
\[ \text{2 RHgI + 2 KCN} \rightarrow \text{R}_2\text{Hg + Hg + 2 KI + (NC)}_2\]
Розв'язуйте меркурацію
Загальний процес сольвомеркурації передбачає додавання HGx 2 через алкеновую подвійну (або алкінну потрійну) зв'язок в присутності розчинника. Solvomercuration застосовується там, де HY, з Рівняння 5.4.3, є частиною системи розчинників, наприклад, у воді процес може бути описаний як гідроксиртурація.

Додавання до алкену відбувається з додаванням Марковникова, тобто шляхом утворення найбільш стійкого іона карбонію, що утворюється при додаванні ртуті до менш заміщеного вуглецю. Зв'язок Hg-C може бути розщеплений додаванням NaBH 4 для отримання зв'язку C-H. Загальноприйнято використовувати ацетат ртуті, Hg (OaC) 2 (OaC = O 2 CCH 3) з подальшою реакцією з NaCl або NaI для утворення галогеніду, а не галогеніду ртуті безпосередньо. Однак ацетат також може виступати в ролі нейрофіла, в результаті чого утворюється суміш продуктів. Порядок реактивності для алкенів слідує тенденції:
\[ \text{R}_2\text{C=CH}_2\text{ > R(H)C=CH}_2 \text{ >} cis \text{ R(H)C=C(H)R > } trans \text{ R(H)C=C(H)R > R}_2\text{C=C(H)R > R}_2\text{C=CR}_2 \]
Це пов'язано з поєднанням стеричного і електронного ефектів. Додавання відбувається в транс-/анти моди.
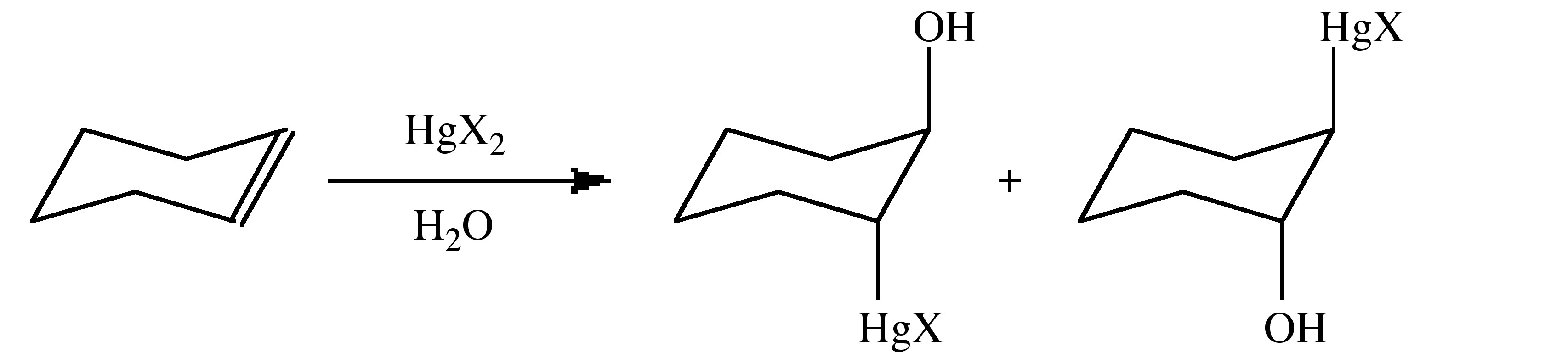
Галогеніди ртуті (II) дисоціюють у полярних розчинниках (рівняння 5.4.4), і цей вид зазвичай асоціюється з початковою стадією реакції.
\[ \text{HgX}_2 \leftrightharpoons \text{HgX}^+ \text{ + X}^-\]
Механізм сольвомеркурации найкраще описаний реакцією, показаною в.

Докази для механізму двояке:
- Додаток виключно транс.
- Не спостерігається жодної перестановки навіть для t Bu (H) C = C (H) t Bu, іон карбонію якого, як відомо, зазнає перестановки.
Ізотопні дослідження показують, що утворення зв'язку С-О присутній в перехідному стані. Міст ртуті в перехідному стані може бути не симетричним, але структура схожа на додавання Br + і AuX + до алкенів.

Фактична реакція спочатку проводилася з Hg (OaC) 2 в бензолі при 110 °С протягом декількох годин у розчині оцтової кислоти. Було встановлено, що реакція каталізувалася наявністю HClO 4, H 2 SO 4 та HNO 3, які, як було виявлено, замінюють ацетатний іон. Швидкість реакції також збільшується в 690 000 разів за рахунок використання Hg (O 2 CCF 3) 2 в HO 2 CCF 3.
Сольвомеркурация алкінів дає алкенілртутні сполуки, але реакція більш млява, ніж для реакції з алкенами, і продукт завжди є транс-ізомером.
Меркурація ароматичних сполук
Меркурація - це електрофільна реакція ароматичного заміщення, яка можлива для більшості 2n+2 π-електронних видів. Докази для π-комплексного проміжного продукту вказують УФ-спектроскопія, яка показує збільшення області 280-320 нм для реакції ароматичних сполук з Hg (O 2 CCF 3) 2 в HO 2 CCF 3. σ-комплекс виявив в рідині SO 2.

Як препаративний метод меркурація страждає відсутністю селективності, включаючи ізомеризацію від паразаміщення при низькій температурі до метазаміщення при високих температурах.
Структура
Диалкіл ртутні сполуки, R 2 Hg, як правило, стабільні на повітрі і показують мало Льюїса кислотну поведінку. Вони являють собою мономерні безбарвні рідини або низькоплавкі тверді речовини, наприклад, Bp = 92,5° C для Me 2 Hg. Розчинності у воді не спостерігається, крім (F 3 C) 2 Hg (Рівняння 5.4.5).
\[ \text{(F}_3\text{C)}_2\text{Hg + H}_2\text{O} \leftrightharpoons \text{(F}_3\text{C)}_2\text{Hg(OH)}^- \text{ + H}^+ \]
Гібридизація на ртуті включає орбіталі 6s та 6p; однак, 5d може бути задіяний. Рентгенівські кристалічні структури як для R 2 Hg, так і для RhGx показують лінійні структури. Взагалі сполуки R 2 Hg є дуже слабкими кислотами Льюїса, але аддукт утворюється, якщо алкільна група досить відводить електрони, наприклад, (C 6 F 5) 2 Hg. Геометрія кислотно-лужного комплексу Льюїса не трикутна, як передбачалося з теорії VSEPR, а Т-подібна. Спотворення від лінійної одиниці C-Hg-C незначне. Наприклад, в (C 6 F 5) 2 Hg кут C-Hg-C становить 176,2°, тоді як в [(C 6 F 5) 2 Hg] 2 (діари), де діари = Ph 2 AsCH 2 CH 2 AsPH 2, той же кут становить 173°. Крім того, відстань зв'язку атом-HG донора (наприклад, As-Hg = 3.4 Å) лише трохи коротше, ніж сума радіусів ван дер Ваала (наприклад, 3.5 Å).

Бібліографія
- Л.К. Дамуд і П.А. Дін. Дж. Органомет. Хім. , 1979, 181, 1.
- Л.К. Дамуд і П.А. Дін. Хім Дж. Соц., Хім. Комун. , 1978, 1083.
- Дж. Л. Кортнейдж, А.Г. Девіс, П. С. Грегорі, D.C. Макгучан, і С.Н. Язді. Хім Дж. Соц., Хім. Комун. , 1987, 1192.
- Хічкок, Дж. М. Кітс, і Дж. А. Лоулесс, Дж. Хім. Соц. , 1998, 120, 599.
