2.8: Ізотопи водню
- Page ID
- 18009
Фізичні ефекти
Наявність міжмолекулярного водневого зв'язку забезпечує додаткові сили привабливості між молекулами. Таким чином, впливають властивості, які залежать від внутрішньомолекулярних сил.
| Ізотоп | Водень-1 | Водень-2 | Водень-3 |
|---|---|---|---|
| Особлива назва | Водень | дейтерій | Тритій |
| Символ | Ч | D | Т |
| Атомний номер |
1 |
1 | 1 |
| Кількість нейтронів | 0 | 1 | 2 |
| Масове число | 1 | 2 | 3 |
| природне достаток | 99,9844% | 0,0156% | дуже маленький |
Синтез сполук дейтерію
Електроліз води
Електроліз водню-1 води (Н 2 О) в присутності лугу призводить до утворення водню і кисню.
\[ 2 H_2O_{(l)} \rightarrow 2H_{2(g)} + O_{2(g)} \]
Аналогічним чином гідроліз дейтрованої води (D 2 O) дає дейтерій і кисень.
\[ 2D_2O_{(l)} \rightarrow 2 D_{2(g)} + O_{2(g)} \]
Однак швидкість електролізу D 2 O трохи повільніше, ніж у Н 2 О. Таким чином, частковий гідроліз води сумішшю природних ізотопів призводить до незначного збагачення води Д 2 О. Рівень збагачення в одну стадію становить менше 1%. Для отримання високих рівнів D 2 O (наприклад, близько 30%) необхідно зменшити початковий об'єм води на 1/100 000 тис.
Хімічна рівновага
Реакції обміну протонів можуть бути використані для збагачення сполук дейтерію. Наприклад, реакція ГСД з водою, показана в (2.8.3), має незначну перевагу при утворенні Н 2 S, тобто K eq = 1.012. Таким чином, барботування ГСД через воду призводить до збагачення води в ГОД. Однак близько 30% збагачення - це приблизно найкраще, чого можна досягти цим методом.
\[ H_2O_{(l)} + HSD_{(g)} \leftrightharpoons HOD_{(l)} + H_2S_{(g)} \]
Фракційна дистиляція
Температура кипіння Н 2 О дорівнює (за визначенням) 100 ◦ С, на відміну від цього температура кипіння D 2 O дорівнює 101,4 ◦ С. Таким чином, можна відокремити Н 2 О від D 2 O шляхом фракційної перегонки. Цей метод забезпечує найбільш підходящий шлях до високоізотопного збагачення і D 2 O 99,8% може бути отриманий таким чином.
Примітка
Термін важка вода використовується для D 2 O збагачення більше 99,8%.
Використання сполук дейтерію
Можливий ядерний синтез
Найбільше використання D 2 O є в якості модератора і теплообмінника для ділення ядерних реакторів, однак, найбільшим потенційним застосуванням буде, якщо ядерний синтез буде реалізований як комерційний процес.
Злиття двох атомів дейтерію з утворенням атома гелію та енергії було б одним джерелом енергії (2.8.4), однак синтез дейтерію-тритію є найбільш перспективним (2.8.5).
\[ ^2_1H + ^2_1H \rightarrow ^3_2He + ^1_0n +energy \]
\[ ^2_1H + ^3_1H \rightarrow ^4_2He + ^1_0n +energy \]
Дейтерієва частина палива не представляє великої проблеми, оскільки приблизно 1 частина в 5000 водню в морській воді є дейтерієм. Це становить оцінку того, що в океанах понад 10 15 тонн дейтерію. Тритієва частина палива є більш проблематичною, оскільки немає значного природного джерела (табл\(\PageIndex{2}\). 9), а тритій довелося б отримати шляхом розведення тритію з літію.
\[ ^6_3Li + ^1_0n \rightarrow ^4_2He + ^3_1H\]
Оскільки галон морської води може виробляти стільки енергії, скільки 300 галонів бензину, очевидно, велика кількість енергії, яка потенційно може бути реалізована за допомогою ядерного синтезу. На жаль, ця перевага також є недоліком, оскільки досягнуті температури схожі на поверхню сонця, що випаровує будь-який звичайний контейнер. Тому експерименти з синтезу використовують магнітне поле для стримування реакції. Форма поля схожа на пляшку, звідси і термін «магнітна пляшка».
Одним з продемонстрованих процесів синтезу є так звана воднева бомба або термоядерна бомба, в якій атомна бомба поділу використовується для ініціювання реакції синтезу. Атомна бомба оточена шаром дейтериду літію. Нейтрони від атомного вибуху (поділу) призводять до перетворення літію в гелій, тритій та енергію (2.8.6). Атомний вибух також забезпечує температуру 50 000 000 ◦ C, необхідну для подальшого злиття дейтерію з тритієм (2.8.5). Тож насправді воднева бомба неправильно названа, і її слід називати бомбою дейтерію.
Примітка
Оригінальні розрахунки для моделювання водневої бомби були виконані за допомогою ENIAC (скорочення від електронного числового інтегратора та комп'ютера), який спочатку був розроблений для формування таблиць траєкторій снарядів червоного кольору з великої артилерії. Артилерійські кільцеві таблиці були зроблені жінками-математиками, яких називали калькуляторами, звідси і назва використовується сьогодні. Побудований в 1946 році ENIAC часто вважається першим програмованим електронним комп'ютером, однак, він був передбачений шістьма машинами Colossus, які були використані для успішного зламу німецького коду Enigma ще в 1944 році. Однак існування машин Колоса зберігалося в таємниці до 1975 року.
Спектроскопія
У хімічній лабораторії сполуки дейтерію зазвичай використовуються в спектроскопії для:
а) Призначення резонансів в ІЧ-, комбінаційній та ЯМР-спектроскопії.
б) Як розчинник, що містить протон, в спектроскопії 1H ЯМР.
Опис цих додатків наведено нижче.
Механізм реакції і визначення швидкості
Враховуючи більшу масу дейтерію над воднем, існує асоційована різниця в швидкості реакцій (див. Нижче), і тому дослідження з використанням аналогів водню та дейтерію можуть дати інформацію щодо механізмів реакції.
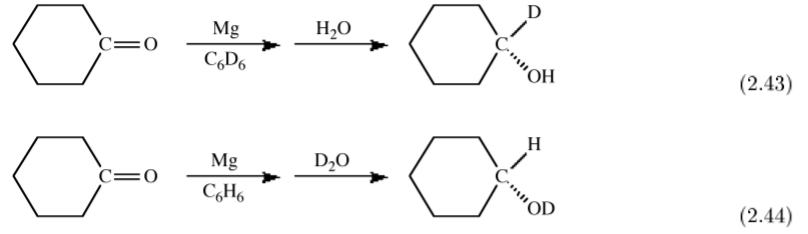
Спектроскопічні відмінності між воднем та дейтерієм також можуть бути використані як простежувач для однозначного визначення джерела певних замісників. Наприклад, зменшення магнію (або Гріньяра) кетону дає при гідролізі вторинний спирт. Якщо реакція проводиться в дейтерированном розчиннику і Н 2 О, використовуваному для гідролізу, то вторинний вуглець вторований, (2.43). На відміну від цього, якщо реакція проводиться в недейтерированном розчиннику і гідроліз здійснюється за допомогою D 2 O, то утворюється дейтрований спирт, (2.44). Ці експерименти визначають, що початкове відновлення відбувається на α -вуглецю кетону.
Вправа\(\PageIndex{1}\)
Враховуючи наступні реакції і ізотопний розподіл продуктів, припускають механізм реакції.
\ (\ Індекс сторінки {2}\) .8.1.png» src =» https://chem.libretexts.org/@api/dek...cise_2.8.1.png "/>
- Відповідь
-
\ (\ індекс сторінки {2}\) .8.1 solution.png "src =» https://chem.libretexts.org/@api/dek...1_solution.png "/>
Відмінності водню та дейтерію
Властивості, які залежать від властивостей ядер
Ядерно-магнітний момент атомного ядра виникає через спини протонів і нейтронів всередині ядра. Як наслідок, магнітний момент для водню і дейтерію сильно відрізняються і, отже, умови виявлення ЯМР дуже різні. Таким чином, при спостереженні спектра ЯМР 1 Н сполуки не тільки атоми дейтерію не спостерігаються, але зв'язок тепер H-D, а не H-H (рис\(\PageIndex{2}\). 31).
Дейтерій краще розсіює нейтрони, ніж водень. Поперечні перерізи H і D дуже чіткі і різні за знаком, що дозволяє варіювати контрастність в таких експериментах. Низька електронна щільність водню ускладнює визначення його положення рентгенівськими методами дифракції, методи нейтронної дифракції дозволяють дуже точно визначити структуру. Водень можна побачити за допомогою дифракції і розсіювання нейтронів, однак він має великий некогерентний переріз нейтронів. Це нуль для дейтерію і, таким чином, забезпечує набагато чіткіші сигнали, які можуть бути отримані для дейтеризованих зразків. Нейтронне розсіювання дейтронних зразків є незамінним для багатьох досліджень макромолекул в біології.
Властивості, які залежать від маси
Різниця в масі між воднем і дейтерієм, очевидно, призводить до різниці молекулярної маси їх аналогічних сполук. Ця різниця може бути використана для аналізу методом мас-спектрометрії, але це також призводить до різної щільності сполук. Наприклад, щільність Н 2 О при 25 ◦ С дорівнює 0,997 г/см 3, тоді як щільність D 2 O при 25 ◦ С дорівнює 1,14 г/см 3.
Частоту коливань для двоатомної молекули H-X можна визначити рівнянням:
\[ v_{H-X} = \dfrac{1}{2\pi} \sqrt{\dfrac{f_{H-X}}{\mu_{H-X}}}\]
де f H-X - константа сили зв'язку H-X, а μ H-X - зменшена маса.
\[ \mu_{H-X} = \dfrac{m_h \cdot m_X}{m_H + m_X} \]
Якщо замінити H на D, постійна сили D-X така ж, як і константа сили H-X, але зменшена маса вдвічі перевищує значення для зв'язку H-X. В результаті співвідношення частоти коливань зв'язку H-X до частоти аналогічного зв'язку D-X задається наступним рівнянням.
\[\dfrac{\mu_{D-X}}{\mu_{H-X}} = (\dfrac{\mu_{H-X}}{\mu_{D-X}})^{\dfrac{1}{2}} = \dfrac{1}{\sqrt{2}} \]
Зі зміною вібраційної енергії відбувається супутня зміна міцності зв'язку.
\[ E_{D-X} > E_{H-X} \]
Таким чином, швидкість реакцій буде швидшою для похідного водню, ніж у аналога дейтерію. Співвідношення констант швидкості буде залежати від участі H-X зв'язку розриву або формування в кроці обмеження швидкості (найповільніший крок реакції в межах загального механізму реакції). Коли зв'язок H-X зроблена або порушена в кроці обмеження швидкості, то відношення констант швидкості при заміщенні дейтерію буде:
\[ \dfrac{k_{H-X}}{k_{D-X}} \approx 7 \]
Це відомо як первинний ізотопний ефект. У цьому випадку, коли H-X зв'язок розриву або формування не є частиною кроку обмеження швидкості, то ефект ізотопу буде набагато меншим і відомий як вторинний ефект ізотопу.
Положення реакцій рівноваги, які передбачають водневий обмін, (2.8.12), буде здійснюватися наявністю дейтерію, щоб сприяти концентруванню дейтерію в більш стабільному зв'язку. Це основа концентрації ГОД з ГСД і води, (2.8.3).
\[ \text{X-H} + \text{Y-D} \leftrightharpoons \text{X-D} + \text{Y-H} \]
Бібліографія
- Б. влада, С.Г. Ботт, Дж.Л. Етвуд, і А.Р. Баррон. Дж. Хім. Соц. , 1990, 112, 3446.
- Боровик А.С. і А.Р. Баррон, Головна група Chem. 2005, 4, 135.
