1.6: Структура та склеювання - кристалічна структура
- Page ID
- 18072
Вступ
У будь-якому вигляді обговорення кристалічних матеріалів корисно почати з обговорення кристалографії: вивчення освіти, структури і властивостей кристалів. Кристалічна структура визначається як особливе повторюване розташування атомів (молекул або іонів) у всьому кристалі. Будова відноситься до внутрішнього розташування частинок, а не зовнішнього вигляду кристала. Однак вони не зовсім незалежні, оскільки зовнішній вигляд кристала часто пов'язаний з внутрішнім розташуванням. Наприклад, кристали кубічної кам'яної солі (NaCl) фізично кубічні на вигляд. Лише деякі з можливих кристалічних структур викликають занепокоєння щодо простих неорганічних солей, і вони будуть детально розглянуті, однак важливо розуміти номенклатуру кристалографії.
Кристалографія
Браве решітка
Решітка Браве є основним будівельним блоком, з якого можуть бути побудовані всі кристали. Концепція виникла як топологічна проблема пошуку кількості різних способів розташування точок у просторі, де кожна точка мала б ідентичну атмосферу. Тобто кожна точка буде оточена однаковим набором точок, як і будь-яка інша точка, так що всі точки були б невідрізнені один від одного. Математик Огюст Браве виявив, що існує 14 різних колекцій груп точок, які відомі як решітки Браве. Ці решітки потрапляють на сім різних «кристалічних систем», які диференціюються залежністю між кутами між сторонами одиничної осередку і відстанню між точками в одиничній комірці. Одинична клітина - це найменша група атомів, іонів або молекул, які при повторенні через рівні проміжки часу в трьох вимірах вироблять решітку кристалічної системи. Параметр решітки - це довжина між двома точками на кутах одиничної комірки. Кожен з різних параметрів решітки позначається буквами a, b і c. Якщо дві сторони рівні, наприклад, в чотирикутної решітці, то довжини двох параметрів решітки позначаються a і c, при цьому b опущені. Кути позначаються грецькими літерами α, β і γ, таким чином, що кут з певною грецькою буквою не підсуджується віссю з її римським еквівалентом. Наприклад, α - це включений кут між віссю b і c.
У таблиці\(\PageIndex{1}\) 8.8 показані різні кристалічні системи, тоді як на малюнку\(\PageIndex{1}\) .16 показані решітки Браве 14. Важливо розрізняти характеристики кожної з окремих систем. Приклад матеріалу, який бере на себе кожну з решіток Браве, наведено в табл\(\PageIndex{1}\). 9.
| Система | Осьові довжини і кути | Геометрія одиничної комірки |
| кубічних | а = б = с, α = β = γ= 90 ◦ | 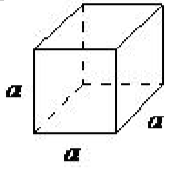 |
| тетрагональні | а = б ≠ с, α = β = γ= 90 ◦ | 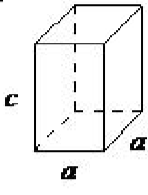 |
| орторомбічний | a ≠ б ≠ с, α = β = γ= 90 ◦ | 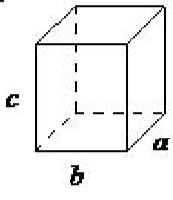 |
| ромбоедричний | а = б = с, α = β = γ ≠ 90 ◦ | 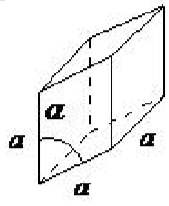 |
| шестикутний | а = б ≠ с, α = β = 90 ◦, γ = 120 ◦ | 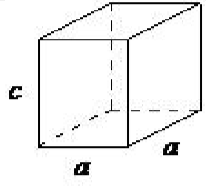 |
| моноклінічний | a ≠ б ≠ с, α = γ = 90 ◦, β ≠ 90 ◦ | 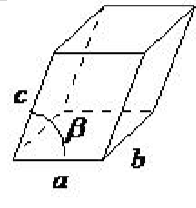 |
| триклініка | a ≠ б ≠ c, α ≠ β ≠ γ | 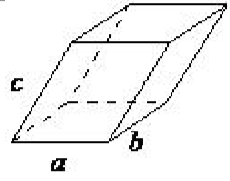 |
| Кришталева система | Приклад |
| триклініка | К 2 С 2 З 8 |
| моноклінічний | АС 4 С 4, КНО 2 |
| ромбоедричний | Рт, Сб |
| шестикутний | Zn, Co, Ніас |
| орторомбічний | Га, Фе 3 С |
| тетрагональні | В, ТіО 2 |
| кубічних | Ау, Сі, NaCl |
Кубічна решітка є найбільш симетричною з систем. Всі кути рівні 90 ◦, а всі сторони однакової довжини (a = b = c). Для повного опису цієї системи потрібна лише довжина однієї зі сторін (а). Крім простої кубічної, до складу кубічної решітки входять також кубічна і центрована кубічна кубічна (\(\PageIndex{1}\)рис. 16). Кубічний, орієнтований на тіло, є результатом присутності атома (або іона) в центрі куба, крім атомів (іонів), розташованих у вершині куба. Аналогічним чином кубічна, орієнтована на обличчя, вимагає, крім атомів (іонів), розташованих у вершині куба, присутності атомів (іонів) у центрі кожного з кубиків грані.
Тетрагональна решітка має всі свої кути, рівні 90 ◦, і має дві з трьох сторін однакової довжини (a = b). Система також включає в себе тетрагональний центр тіла (рис\(\PageIndex{1}\). 16).
В орторомбічної решітці всі кути рівні 90 ◦, при цьому всі її сторони мають нерівну довжину. Систему потрібно лише описати трьома параметрами решітки. Ця система також включає орторомбічну, орієнтовану на тіло, орторомбічну основу та орторомбію, орієнтовану на обличчя (рис\(\PageIndex{1}\). 16). Ґратка, орієнтована на основу, має, крім атомів (іонів), розташованих у вершині орторомбічної решітки, атоми (іони), розташовані лише на двох протилежних гранях.
Ромбоедрична решітка також відома як тригональна, і не має кутів, рівних 90 ◦, але всі сторони мають однакову довжину (a = b = c), що вимагає лише одного параметра решітки, а всі три кути рівні (α = β = γ ).
Гексагональна кристалічна структура має два кути, рівні 90 ◦, при цьому інший кут (γ) дорівнює 120 ◦. Щоб це сталося, дві сторони, що оточують кут 120 ◦, повинні бути рівними (a = b), тоді як третя сторона (c) знаходиться на 90 ◦ до інших сторін і може бути будь-якої довжини.
Моноклінна решітка не має сторін однакової довжини, але два кути рівні 90 ◦, причому інший кут (зазвичай визначається як β) є чимось іншим, ніж 90 ◦. Являє собою нахилену паралелограмную призму з прямокутними підставами. Ця система також включає в себе базово-центровану моноклініку (рис\(\PageIndex{1}\). 16).
У триклінічної решітці жодна зі сторін одиничної комірки не є рівною, і жоден з кутів всередині одиничної комірки не дорівнює 90 ◦. Триклінічна решітка вибирається така, щоб всі внутрішні кути були або гострими, або тупими. Ця кристалічна система має найнижчу симетрію і повинна бути описана 3 параметрами решітки (a, b, і c) і 3 кутами (α, β і γ).
Позиції атомів, напрямки кристалів та показники Міллера
Позиції атома та кришталеві осі
Структура кристала визначається відносно одиничної комірки. Оскільки весь кристал складається з повторюваних одиничних осередків, цього визначення достатньо для представлення всього кристала. Усередині одиничної комірки атомне розташування виражається за допомогою координат. Існує дві системи координат, які зазвичай використовуються, що може спричинити деяку плутанину. Обидва використовують кут одиничної клітини як своє походження. Перша, менш поширена система - це декартові або ортогональні координати (X, Y, Z). Вони зазвичай мають одиниці Ангстрем і відносяться до відстані в кожному напрямку між походженням клітини і атомом. Цими координатами можна маніпулювати таким же чином, використовуються дво- або тривимірні графіки. Тому дуже просто обчислити міжатомні відстані та кути, задані декартовими координатами атомів. На жаль, повторюваність кристала не може бути легко виражена за допомогою таких координат. Наприклад, розглянемо кубічну комірку розмірністю 3,52 Å. Зробіть вигляд, що ця комірка містить атом, який має координати (1.5, 2.1, 2.4). Тобто атом знаходиться на відстані 1,5 Å від початку в напрямку x (що збігається з віссю комірки a), 2.1 Å в y (що збігається з віссю комірки b) і 2.4 Å в z (що збігається з віссю клітинки c). У наступній одиничній комірці вздовж напрямку x буде еквівалентний атом, який матиме координати (1,5 + 3,52, 2.1, 2.4) або (5.02, 2.1, 2.4). Це був досить простий розрахунок, оскільки клітина має дуже високу симетрію і тому осі клітин, a, b і c, збігаються з декартовими осями, X, Y і Z. Однак розглянемо клітини нижньої симетрії, такі як триклінічні або моноклінні, в яких осі клітин не взаємно ортогональні. У таких випадках вираження повторюваного характеру кристала набагато складніше здійснити.
Відповідно, атомні координати зазвичай виражаються через дробові координати, (x, y, z). Ця система координат збігається з осями осередків (a, b, c) і відноситься до положення атома через дріб уздовж кожної осі. Розглянемо атом в кубічній клітині, обговорюємо вище. Атом становив 1.5 Å у напрямку від походження. Оскільки вісь довжиною 3,52 Å, атом знаходиться (1,5/ 3,52) або 0,43 осі від початку. Аналогічно він становить (2,1/3,52) або 0,60 від осі b і (2,4/3,5) або 0,68 від осі c. Отже, дробові координати цього атома є (0,43, 0,60, 0,68). Координати еквівалентного атома в наступній комірці в напрямку a, однак, легко обчислюються, оскільки цей атом знаходиться просто на 1 одиницю осередку в а Таким чином, все, що потрібно зробити, це додати 1 до координати x: (1.43, 0.60, 0.68). Такі перетворення можуть виконуватися незалежно від форми одиничної осередку. Отже, дробові координати використовуються для збереження та маніпулювання кристалічною інформацією.
Кришталеві напрямки
Позначення окремих векторів всередині будь-якої заданої кристалічної решітки здійснюється за допомогою цілих множників параметра решітки точки, в якій вектор виходить з одиничної комірки. Вектор позначається позначенням [hkl], де h, k і l - взаємно точки, в якій вектор виходить з одиничної комірки. Виникнення всіх векторів приймається як [000]. Наприклад, напрямок вздовж осі a за цією схемою буде [100], оскільки це має компонент лише у напрямку a і жодної складової вздовж осьового напрямку b або c. Вектор по діагоналі уздовж грані, визначеної віссю a і b, буде [110], тоді як перехід від одного кута одиничної комірки до протилежного кута буде в напрямку [111]. На малюнку\(\PageIndex{1}\) .17 показані деякі приклади різних напрямків в одиничній комірці. Позначення напрямку кристала складається з найнижчої комбінації цілих чисел і представляє одиничні відстані, а не фактичні відстані. Напрямок [222] ідентичний a [111], тому використовується [111]. Дроби не використовуються. Наприклад, вектор, який перехоплює центр верхньої грані одиничної комірки, має координати x = 1/2, y = 1/2, z = 1. Усі вони повинні бути інвертовані, щоб перетворити на найнижчу комбінацію цілих чисел (цілі числа); тобто [221] на рис\(\PageIndex{1}\). 17. Нарешті, всі паралельні вектори мають однаковий напрямок кристалів, наприклад, чотири вертикальні краї комірки, показані на малюнку\(\PageIndex{1}\) .17, мають напрямок кристала [hkl] = [001].
Напрямки кристалів можуть бути згруповані в сім'ї. Щоб уникнути плутанини існує умовність у виборі дужок, що оточують три числа, щоб диференціювати напрямок кристала від сімейства напрямків. Для напрямку використовуються квадратні дужки [hkl] для позначення індивідуального напрямку. Кутові дужки < hkl > вказують на сімейство напрямків. Сімейство напрямків включає будь-які напрямки, еквівалентні по довжині і типам зустрічаються атомів. Наприклад, у кубічній решітці напрямки [100], [010] та [001] належать до <100>сімейства площин, оскільки вони еквівалентні. Якби кубічна решітка оберталася на 90 ◦, напрямки a, b і c залишалися б нерозрізненими, і не було б способу сказати, на яких кристалографічних положеннях розташовані атоми, тому сімейство напрямків однакове. Однак у гексагональному кристалі це не так, тому [100] і [010] обидва були б <100>напрямками, але напрямок [001] був би різним. Нарешті, негативні напрямки ідентифікуються смужкою над негативним числом замість знака мінус.
Кришталеві літаки
Площини в кристалі можна задати за допомогою позначення, яке називається індексами Міллера. Індекс Міллера позначається позначенням [hkl] де h, k і l - взаємно площині з осями x, y і z. Для отримання індексів Міллера заданої площини потрібні наступні етапи:
- Площина, про яку йде мова, поміщається на одиничну комірку.
- Потім знаходять його перехоплення з кожною з кристалічних осей.
- Приймаються взаємні перехоплення.
- Вони множаться на скаляр, щоб застрахувати, що знаходиться в простому співвідношенні цілих чисел.
Наприклад, грань решітки, яка не перетинає вісь y або z, буде (100), тоді як площина вздовж діагоналі тіла буде площиною (111). Ілюстрація цього поряд з (111) і (110) площинами наведена на малюнку\(\PageIndex{1}\) .18.
Як і у випадку з напрямками кристалів, напрямки індексів Міллера можуть бути згруповані в сім'ї Окремі індекси Міллера наведені в дужках (hkl), а фігурні дужки {hkl} розміщені навколо індексів сімейства площин. Наприклад, (001), (100) та (010) знаходяться в сімействі площин {100} для кубічної решітки.
Опис кристалічних структур
Кристалічні структури можуть бути описані різними способами. Найпоширенішим способом є позначення розміру та форми одиничної клітини та положення атомів (або іонів) всередині клітини. Однак цієї інформації іноді недостатньо, щоб дозволити зрозуміти справжню структуру в трьох вимірах. Розгляд декількох одиничних клітин, розташування атомів відносно один одного, кількість інших атомів, з якими вони контактують, і відстані до сусідніх атомів часто забезпечать краще розуміння. Для опису розширених твердотільних структур доступний ряд методів. Найбільш застосовним щодо елементарного та складного напівпровідника, металів та більшості ізоляторів є близький підхід до упаковки.
Закрити упаковані конструкції: шестикутна закрита упаковка та кубічна закрита упаковка
Багато кристалічних структур можна описати, використовуючи концепцію тісної упаковки. Ця концепція вимагає, щоб атоми (іони) були розташовані так, щоб мати максимальну щільність. Для того, щоб зрозуміти тісну упаковку в трьох вимірах, слід розглянути найбільш ефективний спосіб для однакових розмірів сфер, щоб бути упаковані в двох вимірах.
Найбільш ефективний спосіб упаковки однакових за розміром сфер у двох вимірах показаний на малюнку\(\PageIndex{1}\) .19, на якому видно, що кожна сфера (темно-сіра затінена сфера) оточена шістьма іншими сферами і контактує з ними (світло-сірі сфери на рис.\(\PageIndex{1}\) 19). Слід зазначити, що контакт з шістьма іншими сферами максимально можливий - сфери однакового розміру, хоча можлива упаковка меншої щільності. Близько упаковані шари утворюються повторенням на нескінченний аркуш. У цих тісно упакованих шарах присутні три тісно упаковані ряди, показані пунктирними лініями на\(\PageIndex{1}\) рис. 19.
Найефективніший спосіб для рівних розмірів сфер, щоб бути упаковані в три виміри є укладання близько упакованих шарів один на одного, щоб дати тісно упаковану структуру. Існує два простих способи, за допомогою яких це можна зробити, в результаті чого або шестикутна, або кубічна щільно упакована конструкція.
Шестигранний закрити упакований
Якщо два тісно упакованих шару A і B розміщені в контакті один з одним таким чином, щоб максимально збільшити щільність, то сфери шару В будуть спиратися в порожнині (вакансії) між трьома сферами в шарі А. Це продемонстровано на малюнку\(\PageIndex{1}\) .20. Атоми другого шару, B (затінений світло-сірим), можуть займати одне з двох можливих положень (\(\PageIndex{1}\)рис. 20а або б), але не обидва разом або сумішшю кожного. Якщо третій шар розміщений поверх шару B таким чином, щоб він точно покривав шар А, подальше розміщення шарів призведе до наступної послідовності... ABABAB... Це відомо як гексагональна тісна упаковка або hcp.
Гексагональна тісно упакована комірка є похідною гексагональної гратчастої системи Браве (рис.\(\PageIndex{1}\) 16) з додаванням атома всередині одиничної клітини за координатами (1/3, 2/3, 1/2). Базальна площина одиничної осередку збігається з тісно упакованими шарами (\(\PageIndex{1}\)рис. 21). Іншими словами, щільно упакований шар становить сімейство кришталевих площин {001}.
Фракція упаковки в гексагональній тісно упакованій комірці становить 74,05%, тобто 74,05% від загального обсягу зайнята. Фракція або щільність упаковки отримують, припускаючи, що кожен атом є твердою сферою, що контактує зі своїми найближчими сусідами. Визначення фракції упаковки здійснюється шляхом обчислення кількості цілих сфер на одиницю осередку (2 в hcp), обсягу, зайнятого цими сферами, і порівняння із загальним обсягом одиничної осередку. Число дає уявлення про те, наскільки відкритою або заповненою є конструкція. Для порівняння, фракція упаковки для кубічного кубічного (рис\(\PageIndex{1}\). 16) становить 68%, а для алмазного кубічного (важлива напівпровідникова структура, яка буде описана далі) - 34%.
Купік закрити упакований: кубічний по центру обличчя
Аналогічно формуванню гексагональної тісно упакованої структури укладають два тісно упакованих шару (рис.\(\PageIndex{1}\) 19), однак третій шар (С) укладають таким чином, щоб він точно не покривав шар А, сидячи в наборі жолобів в шарі В (рис.\(\PageIndex{1}\) 22), потім при повторенні послідовність упаковки буде... ABCABCABC... Це відомо як кубічна тісна упаковка або ccp.
Одинична комірка кубічної тісно упакованої структури насправді є кубічною решіткою Браве, орієнтованої на обличчя. У решітці fcc тісно упаковані шари складають площини {111}. Як і у випадку з гратчастою упаковкою hcp фракція в кубічній тісно упакованій (FCC) осередку становить 74,05%. Оскільки кубічна кубічна або fcc з центром обличчя частіше використовується в перевазі кубічного закритого упакованого (ccp) при описі структур, перший буде використаний у всьому цьому тексті.
Номер координації
Координаційне число атома або іона всередині розширеної структури визначається як кількість найближчих сусідніх атомів (іонів протилежного заряду), які контактують з ним. Трохи інше визначення часто використовується для атомів всередині окремих молекул: кількість донорських атомів, пов'язаних з центральним атомом або іоном. Однак ця відмінність є досить штучною, і обидва можуть бути використані.
Координаційні числа атомів металів у молекулі або комплексі зазвичай 4, 5 та 6, але відомі всі значення від 2 до 9, і повідомлялося про кілька прикладів вищих координаційних чисел. На відміну від них, загальні координаційні числа в твердому стані - 3, 4, 6, 8 і 12. Наприклад, атом в центрі кубічної решітки, орієнтованої на тіло, має координаційне число 8, оскільки він стосується восьми атомів у кутах одиничної клітини, тоді як атом у простій кубічній структурі мав би координаційне число 6. Як у решітках fcc, так і в hcp кожен з атомів має координаційне число 12.
Восьмигранні і чотиригранні вакансії
Як було сказано вище, фракція упаковки як в FCC, так і в HCP клітині становить 74,05%, залишаючи 25,95% обсягу незаповненим. Незаповнені ділянки решітки (міжвузли) між атомами в клітці називаються інтерстиціальними ділянками або вакансіями. Форма і відносний розмір цих ділянок мають важливе значення при контролі положення додаткових атомів. Як в FCC, так і в hcp клітині більша частина простору в цих атомах знаходиться в межах двох різних сайтів, відомих як октаедричні сайти і тетраедричні сайти. Різниця між ними полягає в їх координаційному числі або кількості атомів, що оточують кожну ділянку. Тетраедричні ділянки (вакансії) оточені чотирма атомами, розташованими по кутах тетраедра. Аналогічно, октаедричні ділянки оточені шістьма атомами, які складають верхівки октаедра. Для даної тісно упакованої решітки октаедрична вакансія буде більше чотиригранної вакансії.
У межах граней центрованої кубічної решітки вісім чотиригранних ділянок розташовані всередині комірки, за загальною дробовою координатою (n/4, n/4, n/4), де n = 1 або 3, наприклад, (1/4, 1/ 4 , 1/4), (1/4, 1/4, 3/4) і т.д. восьмигранні ділянки розташовуються в центрі одиничної клітини (1/2, 1/2, 1/2, 1/ 2), а також на кожному з країв осередку, наприклад, (1/2 ,0,0). У гексагональної тісно упакованої системі чотиригранні ділянки знаходяться в (0,0, 3/8) і (1/3, 2/3, 7/8), а восьмигранні ділянки знаходяться в (1/3, 1/3 , 1/4) і всіх рівнозначних позицій симетрії.
Важливі типи конструкцій
Більшість кристалічних матеріалів не мають структури, яка переходить в один атом на одну ділянку простої решітки Браве. Знайдено ряд інших важливих кристалічних структур, однак лише деякі з цих кристалічних структур є тими, які трапляються для елементарних та складних напівпровідників, і більшість з них походять від решіток fcc або hcp. Кожен структурний тип, як правило, визначається архетипом, матеріалом (часто природним мінералом), який має структуру, про яку йдеться, і з яким пов'язані всі подібні матеріали. Що стосується зазвичай використовуваних елементарних та складних напівпровідників, важливими структурами є алмаз, цинкова суміш, Вурцит та меншою мірою халькопірит. Однак кам'яна сіль, β -олово, кіновар та хлорид цезію спостерігаються як фази високого тиску або високої температури і тому також обговорюються. Нижче наведено короткий виклад цих структур. Детально про весь спектр твердотільних структур наведено в інших місцях.
Діамант Кубічний
Алмазна кубічна структура складається з двох взаємопроникаючих гранецентричних кубічних решіток, з одним зміщенням 1/4 куба по діагоналі куба. Він також може бути описаний як грань центрованої кубічної решітки, в якій половина чотиригранних ділянок заповнена, тоді як всі восьмигранні ділянки залишаються вакантними. Клітина кубічної одиниці діаманта показана на малюнку\(\PageIndex{1}\) .23. Кожен з атомів (наприклад, C) має чотири координати, і найкоротша міжатомна відстань (C-C) може бути визначена з параметру одиничної комірки (a).
\[ C-C = a\dfrac{\sqrt{3}}{4} \approx 0.442a \]
Цинкова суміш
Це бінарна фаза (ME) і названа на честь її архетипу, поширеної мінеральної форми сульфіду цинку (ZnS). Як і у випадку з алмазною решіткою, цинкова суміш складається з двох взаємопроникаючих решіток FCC. Однак в цинковій купажі одна решітка складається з одного з типів атомів (Zn в ZnS), а інша решітка - другого типу атома (S в ZnS). Він також може бути описаний як грань центрованої кубічної решітки атомів S, в якій половина чотиригранних ділянок заповнена атомами Zn. Всі атоми в структурі змішування цинку є 4-координатними. Осередок блоку цинкової бленди показаний на малюнку\(\PageIndex{1}\) .24. Ряд міжатомних відстаней може бути розрахований для будь-якого матеріалу з одиничною коміркою змішаного цинку за допомогою параметра решітки (a).
\[ Zn-S = a\dfrac{\sqrt{3}}{4} \approx 0.442a \]
\[ Zn-Zn = \dfrac{a}{\sqrt{2}} \approx 0.707a \]
Халькопірит
Мінерал халькопірит CuFeS 2 є архетипом цієї структури. Структура є тетрагональною (a = b ≠ c, α = β = γ = 90 ◦ і по суті є надрешіткою на основі цинкової суміші. Таким чином, найпростіше уявити, що халькопіритова решітка складається з решітки атомів сірки, в якій чотиригранні ділянки заповнені шарами,... FeCuCuFe... і т.д. (рис.\(\PageIndex{1}\) 25). У такій ідеалізованій структурі c = 2 a, однак, це стосується не всіх матеріалів з халькопіритовими структурами.
Кам'яна сіль
Як випливає з назви, архетипною структурою кам'яної солі є NaCl (кухонна сіль). Спільно зі структурою цинкової суміші кам'яна сіль складається з двох взаємопроникаючих граноцентричних кубічних решіток. Однак друга решітка зміщена на 1/2 а вздовж осі одиничної осі комірки. Він також може бути описаний як кубічна решітка, в якій заповнені всі восьмигранні ділянки, в той час як всі чотиригранні ділянки залишаються вакантними, і, таким чином, кожен з атомів у структурі кам'яної солі є 6-координатними. Осередок кам'яної солі показаний на малюнку\(\PageIndex{1}\) .26. Ряд міжатомних відстаней може бути розрахований для будь-якого матеріалу зі структурою кам'яної солі за допомогою параметра решітки (а).
\[ Na-Cl = \dfrac{a}{2} \approx 0.5a \]
\[ Na-Na = Cl-Cl = \dfrac{a}{\sqrt{2}} \approx 0.707a\]
Кінобар
Кінавар, названий на честь архетипу ртутного суфілда, HgS, являє собою спотворену структуру кам'яної солі, в якій отримана клітина є ромбоедричною (тригональною), причому кожен атом має координаційне число шість.
Вурцит
Це гексагональна форма сульфіду цинку. Він ідентичний за кількістю і типами атомів, але побудований з двох взаємопроникаючих решіток hcp на відміну від решіток fcc в цинковій бленді. Як і у випадку з цинковою сумішшю, всі атоми в структурі wurtzite є 4-координатними. Осередок одиниці вюрциту показана на малюнку\(\PageIndex{1}\) .27. Кількість міжатомних відстаней може бути розрахована для будь-якого матеріалу з коміркою Вюрциту за допомогою параметра ґратки (a).
\[ Zn-S = a\sqrt{\dfrac{3}{8}} \approx 0.612a = \dfrac{3c}{8} = 0.375c\]
\[Zn-Zn = S-S = a = 1.632c\]
Однак слід зазначити, що ці формули не обов'язково застосовуються, коли співвідношення a/c відрізняється від ідеального значення 1.632.
Хлорид цезію
Структура хлориду цезію зустрічається в матеріалах з великими катіонами і відносно невеликими аніонами. Він має просту (примітивну) кубічну осередок (рис.\(\PageIndex{1}\) 16) з хлоридним іоном по кутах куба і іоном цезію в центрі тіла. Координаційні числа як Cs+, так і Cl-, при цьому внутрішні атомні відстані визначаються від постійної решітки комірки (a).
\[Cs-Cl = \dfrac{a\sqrt{3}}{2} = 0.866a\]
\[Cs-Cs = Cl-Cl = a\]
β-Tin
Алотроп олова кімнатної температури становить β -олово або біле олово. Він має тетрагональну структуру, в якій кожен атом олова має чотирьох найближчих сусідів (Sn-Sn = 3.016 Å), розташованих у дуже сплющеному тетраедрі, і двох наступних найближчих сусідів (Sn-Sn = 3,175 Å). Загальна структура β -олова складається з сплавлених шестикутників, кожен з яких пов'язаний зі своїм сусідом за допомогою чотиричленного кільця Sn 4.
Дефекти кристалічних твердих речовин
До цього моменту ми займалися лише ідеальними структурами для кристалічних твердих тіл, в яких кожен атом займає визначену точку в кристалічній решітці. На жаль, дефекти зазвичай існують в рівновазі між кристалічною решіткою і її середовищем. Ці дефекти бувають двох загальних типів: точкові дефекти і розширені дефекти. Як випливає з їх назви, точкові дефекти пов'язані з ділянкою монокристалічної решітки, тоді як розширені дефекти виникають у більшому діапазоні.
Точкові дефекти: занадто багато або занадто мало або просто неправильно
Точкові дефекти істотно впливають на властивості напівпровідника, тому важливо розуміти класи точкових дефектів і характеристики кожного типу. Рисунок\(\PageIndex{1}\) .28 узагальнює різні класи нативних точкових дефектів, однак їх можна розділити на два загальні класи; дефекти з неправильною кількістю атомів (дефіцит або надлишок) та дефекти, де ідентичність атомів неправильна.
Інтерстиціальна домішка
Інтерстиціальна домішка виникає, коли зайвий атом розташовується в місці решітки, який повинен бути вакантним в ідеальній структурі (\(\PageIndex{1}\)рис. 28b). Оскільки всі сусідні ділянки решітки заповнені, додатковий атом повинен буде втиснути себе в межтканинную ділянку, в результаті чого відбувається спотворення решітки і зміна локального електронного поведінки структури. Малі атоми, такі як вуглець, воліють займати ці інтерстиціальні ділянки. Інтерстиціальні домішки легко розсіюються через решітку за допомогою інтерстиціальної дифузії, що може призвести до зміни властивостей матеріалу в залежності від часу. Домішки кисню в кремнію, як правило, розташовані як міжклітинні.
Вакансії
Зворотне значення інтерстиціальної домішки - це коли в певній області решітки не вистачає атомів. Вони називаються вакансіями. Вакансії існують в будь-якому матеріалі вище абсолютного нуля і збільшення концентрації з температурою. У випадку зі складними напівпровідниками вакансіями можуть бути або катіонні вакансії (\(\PageIndex{1}\)рис. 28в), або аніонні вакансії (\(\PageIndex{1}\)рис. 28д), в залежності від того, якого типу атома відсутні.
Заміна
Заміна різних атомів в нормальну структуру решітки є загальною і використовується для зміни електронних властивостей як складних, так і елементних напівпровідників. Будь-який домішковий елемент, який закладений під час росту кристалів, може займати місце решітки. Залежно від домішки дефекти заміщення можуть сильно спотворити решітку і/або змінити електронну структуру. В цілому катіони будуть намагатися займати ділянки катіонної решітки (рис.\(\PageIndex{1}\) 28е), а аніон буде займати ділянку аніонів (\(\PageIndex{1}\)рис. 28f). Наприклад, домішка цинку в GaAs займатиме ділянку галію, якщо це можливо, тоді як атоми сірки, селену та телуру спробують замінити миш'як. Деякі домішки займатимуть будь-який сайт без розбору, наприклад, Si та Sn займають як Ga, так і As сайти в GaAs.
Антисайтові дефекти
Антисайтові дефекти є особливою формою дефекту заміщення і є унікальними для складних напівпровідників. Антисайтовий дефект виникає при недоречному розміщенні катіона на ділянці аніонної решітки або навпаки (\(\PageIndex{1}\)рис. 28г і ч). Залежно від розташування вони позначаються як або антисайтові дефекти АВ, або антисайтові дефекти BA. Наприклад, якщо атом миш'яку знаходиться на місці решітки галію, дефект буде дефектом AsgA. Антисайтові дефекти припускають втягування в ділянку решітки атомів іншого розміру, ніж решта решітки, і тому це часто призводить до локалізованого спотворення решітки. Крім того, катіони та аніони матимуть різну кількість електронів у своїх валентних оболонках, тому ця заміна змінить локальну концентрацію електронів та електронні властивості цієї області напівпровідника.
Розширені дефекти: дислокації в кристалічній решітці
Розширені дефекти можуть створюватися або під час росту кристалів, або як наслідок напруги в кристалічній решітці. Пластична деформація кристалічних твердих тіл відбувається не так, що всі зв'язки вздовж площини розриваються і реформуються одночасно. Замість цього деформація відбувається через дислокацію в кристалічній решітці. На малюнку\(\PageIndex{1}\) .29 показано схематичне зображення дислокації в кристалічній решітці. Дві особливості цього виду дислокації - наявність додаткової кристалічної площини, і великої порожнечі у дислокаційного ядра. Домішки мають властивість відокремлюватися до ядра дислокації, щоб зняти напругу від їх присутності.
Епітаксія
Епітаксія, являє собою транслітерацію двох грецьких слів epi, що означають «на», і taxis, що означає «впорядкований». Що стосується зростання кристалів, то це стосується процесу вирощування тонких кристалічних шарів на кристалічній підкладці. У епітаксіальному зростанні існує точна орієнтація кристалів lm по відношенню до підкладки. Зростання епітаксійних плівок може здійснюватися низкою методів, включаючи молекулярно-променеву епітаксію, атомно-шарову епітаксію та хімічне осадження пари, всі з яких будуть описані пізніше.
Епітаксія того ж матеріалу, такого як арсенід галію lm на підкладці арсеніду галію, називається гомоепітаксією, тоді як епітаксія, де лм і матеріал підкладки різні, називається гетероепітаксією. Зрозуміло, що в гомоепітаксії підкладка і lm матимуть однакову структуру, однак при гетероепітаксії важливо використовувати там, де це можливо, підкладку з однаковою структурою та подібними параметрами решітки. Наприклад, селенід цинку (цинкова бленда, а = 5,668 Å) легко вирощується на арсеніді галію (цинкова бленда, a = 5,653 Å). Крім того, епітаксійний ріст кристалів може відбуватися там, де існує проста залежність між структурами підкладки та кристалічного шару, наприклад, спостерігається між Al2O3 (100) на Si (100). Який би маршрут не був обраний, потрібна близька відповідність параметрів решітки, інакше деформації, викликані невідповідністю решітки, призводять до спотворення lm і утворення дислокацій. Якщо невідповідність значне епітаксіальне зростання не є енергетично сприятливим, що призводить до вирощування текстурованого lm або полікристалічного нетекстурованого lm. Як правило, епітаксія може бути досягнута, якщо параметри решітки двох матеріалів знаходяться в межах приблизно 5% один від одного. Для якісної епітаксії це повинно бути менше 1%. Чим більше невідповідність, тим більше деформація в лм. У міру того, як lm стає товщі і товщі, він буде намагатися зняти напругу в лм, що може включати втрату епітаксії зростання вивихів. Важливо відзначити, що <100>напрямки лм повинні бути паралельні <100>напрямку підкладки. У деяких випадках, таких як Fe на MgO, напрямок [111] паралельно підкладці [100]. Епітаксійна залежність задається наданням спочатку площини в плівці, яка паралельна підкладці [100].
Бібліографія
- Міжнародні таблиці для рентгенівської кристалографії. Вип. IV; Кіноч Преса: Бірмінгем, Великобританія (1974).
- Джонсон, у всебічній неорганічній хімії, Пергамон Прес, Том 4, глава 52 (1973).
- Захід, Хімія твердого тіла та її застосування, Вілі, Нью-Йорк (1984).
