Глава 6.1: Правило 18 електронів
Підрахунок електронів в комплексах перехідних
У цьому розділі ми навчимося рахувати валентні електрони в координаційних сполуках. Підрахунок електронів важливий, оскільки кількість електронів у комплексі може багато розповісти нам про стабільність і реакційну здатність в координаційній сполуці. Крім того, це дозволяє певною мірою прогнозувати і розуміти структури. Підрахунок електронів звучить тривіально, але це не так тривіально, як здається, насправді існує навіть два різних методу підрахунку електронів. Кожен метод призводить до одного і того ж результату. Який метод ви віддаєте перевагу - це «особистий смак», але кожен метод приблизно однаково поширений в літературі, тому вам потрібно знати обидва з них.
Метод нейтрального атома
Перший метод називається «методом нейтрального атома». Як випливає з назви, ми розбиваємо комплекс на нейтральні фрагменти, і порахуємо електрони, які сприяють зв'язуванню в кожному з фрагментів. Метод нейтрального атома здійснюється відповідно до наступних трьох етапів. Спочатку порахуємо кількість валентних електронів металу. Метал ми розглядаємо як нейтральний атом. Число валентних електронів таке ж, як і номер групи перехідного металу в таблиці Менделєєва. Для перехідних металів число групи варіюється від 3 до 12. На другому етапі враховуємо іонний заряд комплексу, якщо комплекс не нейтральний. Це зменшить кількість електронів для складного катіона, і збільшить кількість валентних електронів для складного аніону. На третьому етапі нам потрібно визначити, скільки електронів вносить кожен ліганд. Це найскладніший крок. Для визначення кількості електронів необхідно розщепити кожен металево-лігандний зв'язок так, щоб в результаті вийшов фрагмент ліганду, який є нейтральним. Потім ми підраховуємо кількість електронів на ліганді, які сприяли зв'язку. Потім підсумовується кількість електронів, внесених кожним лігандом. Це сума потім додається до кількості електронів, визначених попередніми кроками. Це дає загальну кількість валентних електронів.
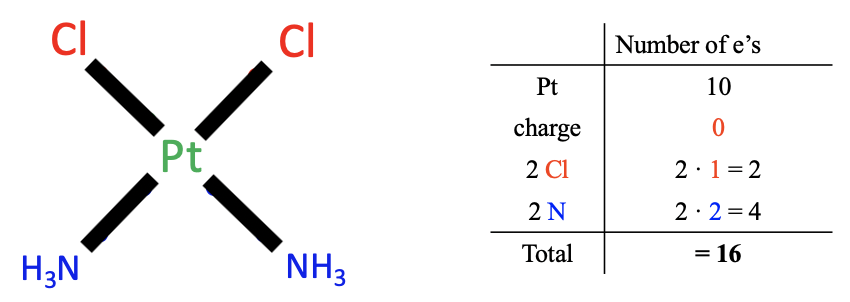
Малюнок\(\PageIndex{1}\): Example of neutral atom method
Застосовуємо ці правила на прикладі, цис-платинового комплексу (рис.\(\PageIndex{1}\)). Для початку потрібно порахувати кількість електронів металу. Металом є платина, яка знаходиться в групі 10 таблиці Менделєєва. Тому нейтральний атом платини має десять валентних електронів.
Далі дивимося на заряд комплексу. При цьому заряду немає, а тому електрони не додаються і не віднімаються.
Нарешті, підраховуємо електрони лігандів. Існує два типи лігандів, хлор-ліганди та амінові ліганди. Тепер наше завдання полягає в тому, щоб розщепити зв'язок PT-ліганду так, щоб вийшли нейтральні фрагменти ліганду. Ми бачимо, що для хлор-лігандів ми повинні розщепити зв'язок Pt-Cl, гомолептично, тобто посередині, привласнюючи один електрон Pt і один електрон Cl, тому що це створює нейтральний атом хлору. Те, що ми розщепили зв'язок гомолептично, означає, що хлороліганд вніс один електрон. Оскільки у нас є два хлороліганди, загалом є два електрони.
Тепер давайте подумаємо про те, скільки електронів вносять амінові ліганди. У цьому випадку нам потрібно розщепити металево-лігандний зв'язок гетеролептично, щоб отримати нейтральний фрагмент ліганду. Обидва сполучних електрона закріплені за лігандом. При цьому утворюється нейтральна молекула NH 3. Це означає, що кожен аміновий ліганд вносить два електрони. Загалом, це робить чотири електрони, тому що у нас є два амінових ліганди.
Нарешті, нам потрібно підсумувати електрони з усіх трьох кроків. Тобто десять електронів від Pt, нульові електрони за рахунок заряду, два електрони з хлоролігандів і чотири електрони з амінових лігандів, що дорівнюють 16 валентних електронів загалом. Це кінцевий результат.
Метод «Стан окислення»
Метод окислення також складається з трьох етапів. Перший крок такий же, як і в методі нейтрального атома. Визначено кількість електронів нейтрального металу, яке збігається з його груповим номером у таблиці Менделєєва. Наступний крок інший, хоча. Він вимагає визначення ступеня окислення металу. Як ми можемо це визначити? Спочатку розщеплюємо метал-лігандні зв'язки гетеролептично так, щоб всі сполучні електрони були закріплені за лігандами. Потім визначаємо заряд лігандів. Ліганди можуть бути як нейтральними, так і негативно зарядженими. Визначаємо загальну кількість зарядів у лігандів. Різниця між цим числом і зарядом комплексу полягає в ступені окислення металу. Ми або додаємо, або віднімаємо електрони в залежності від ступеня окислення металу. Якщо ступінь окислення позитивна, віднімаємо електрони, якщо вона негативна, що рідко, то додаємо електрони. Третій крок підраховує кількість електронів, внесених лігандами. Оскільки ми розщепили всі зв'язки гетеролептично, всі сполучні електрони вважаються внесеними лігандами, і ми підраховуємо їх відповідно. Нарешті, ми підсумовуємо електрони всіх трьох кроків, що дає загальну кількість електронів.
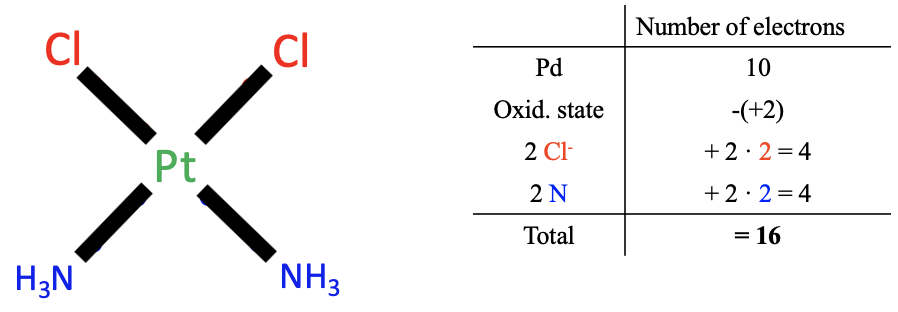
Застосовуємо метод до попереднього прикладу cis-platinum. Застосування першого кроку дає нам 10 валентних електронів для платини.
Далі нам потрібно визначити ступінь окислення Pt. Для цього тепер ми повинні розщепити всі метало-лігандні зв'язки гетеролептично, так що всі сполучні електрони були призначені ліганду. До речі, це еквівалентно тому, що ми ставимося до всіх зв'язків як до давальних зв'язків з усіма електронами, що надходять від лігандів, як донорів. Коли ми робимо це для хлоролігандів, ми бачимо, що це створило хлоридні аніони з 1 зарядом. Розщеплення Pt-N зв'язків гетеролептично призводить до нейтральних молекул NH 3. Тому загальна кількість зарядів у лігандів становить 2x (-1) +2x0=-2. Заряд на комплексі дорівнює нулю, тому ступінь окислення Pt дорівнює 0- (-2) =+2. Тому ми повинні відняти два електрони з 10 електронів платини.
Тепер треба визначити кількість електронів, що надходять від лігандів. Оскільки всі зв'язки розглядаються як давальні зв'язки, хлороліганди вносять по два електрони кожен, а амінові ліганди вносять по два електрони кожен. Це робить загалом вісім електронів.
У сумі 10 електронів від нейтрального атома Pt мінус два електрони через ступінь окислення Pt +2 плюс 2x2=4 електрони від Cl плюс 2x2=4 електрони з NH 3 дають загалом 16 електронів. Ми бачимо, що ми отримали ті ж результати, що і у випадку з методом окислення.
Ми також можемо обговорити переваги та недоліки обох методів. Метод нейтральних атомів має ту перевагу, що нам не доводиться думати про заряди при лігандах та станах окислення. Однак доводиться думати про те, як розщеплювати зв'язки, щоб створити нейтральні фрагменти. Можливо, нам доведеться розщеплювати зв'язки таким чином, що не відображає донорсько-акцепторний характер координаційної сполуки. Метод окислення враховує донорно-акцепторний характер координаційної сполуки, оскільки зв'язки вважаються давальними зв'язками, а електрони відповідно призначаються лігандам та металам. Нам не потрібно думати, як розщеплювати зв'язки, тому що ми розщеплюємо зв'язки завжди гетеролептично. Однак це вимагає від нас задуматися про заряди на лігандах для визначення ступенів окислення, що є додатковим, нетривіальним кроком.
Підрахунок електронів: Внески лігандів
Найскладнішим етапом підрахунку електронів зазвичай є визначення кількості електронів, які забезпечує ліганд. Тому давайте практикуємо це на кількох прикладах.
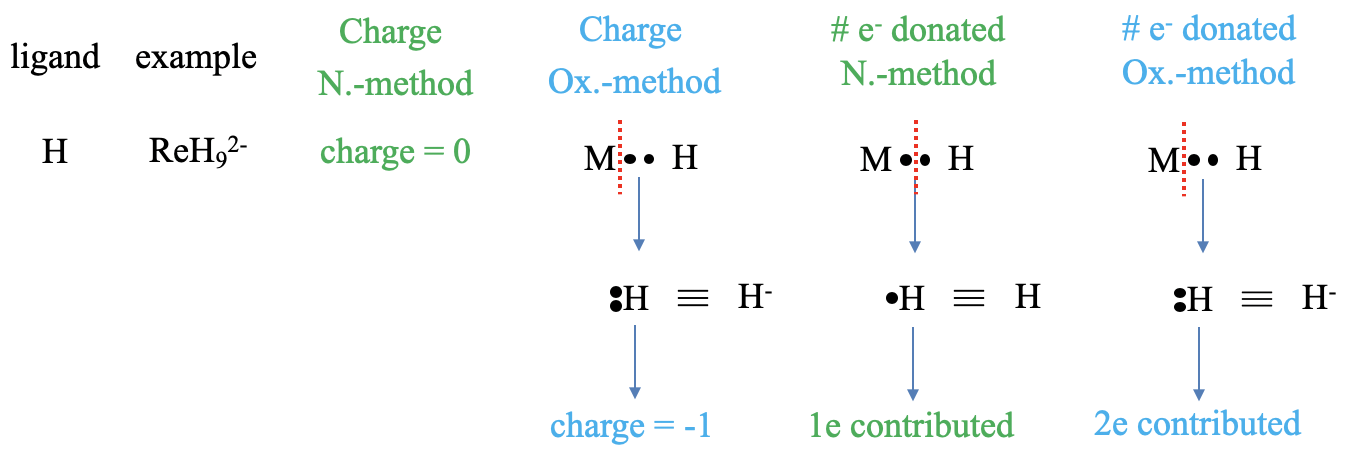
Давайте спочатку розглянемо гідридоліганд, який, наприклад, присутній у нонагідридоргенатному (2-) комплексному аніоні (рис.\(\PageIndex{3}\)). Що таке заряд у ліганда двома методами? У методі нейтрального атома заряд завжди дорівнює нулю, це безглуздо. У випадку методу затвердження окислення нам потрібно розглядати зв'язок як давальну зв'язок, а це означає, що ми повинні розщепити зв'язок гетеролептично, щоб обидва зв'язкові електрони могли бути призначені ліганду. Атом Н з двома електронами - гідридний аніон із зарядом -1. Далі подумаємо про кількість подарованих електронів. У методі нейтральних атомів нам потрібно виробляти фрагменти нейтрального ліганду. Для цього ми повинні гомолептично розщепити зв'язок М-Н, оскільки це створить нейтральний атом водню. Скільки електрона це сприятиме? Це сприятиме одному електрону, тому що ми розщепили зв'язок гомолептично, призначивши лише один з двох зв'язкових електронів H. У методі стану окислення гідридоліганд вносить два електрони, оскільки зв'язок вважався давальним і тому розщеплювався гетеролептично. Обидва сполучних електрона були закріплені за лігандом, тому ліганд вносить два електрони.
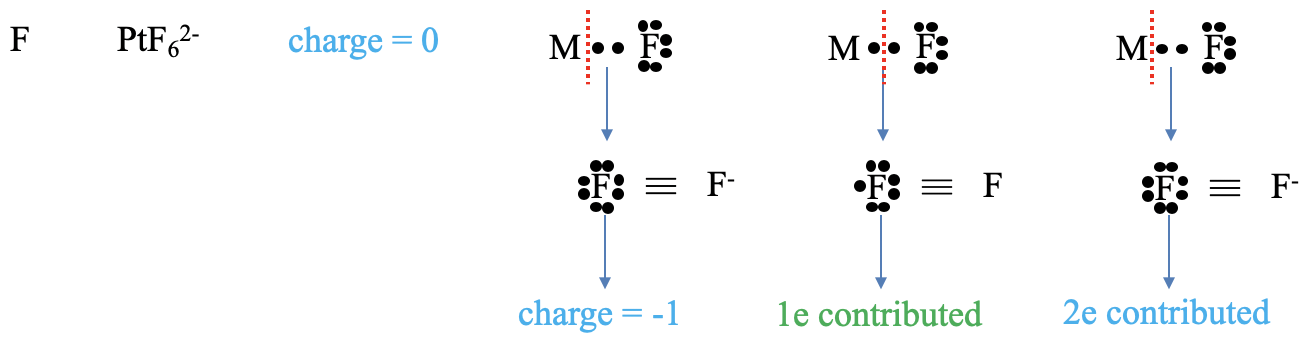
Далі розглянемо галогенідний ліганд (рис.\(\PageIndex{4}\)). Що таке заряд у ліганда? Для методу нейтрального атома відповідь тривіальна, заряд завжди дорівнює нулю. У методі стану окислення обидва зв'язуючі електрони в зв'язці метал-ліганд присвоюються ліганду. Це дає ліганду -1 заряд. Яке число внесених електронів? У методі нейтрального атома нам потрібно ще раз подумати, як розщепити зв'язок метал-ліганд, щоб створити нейтральний фрагмент ліганду. Ми повинні визнати, що ми повинні розщепити зв'язок гомолептично, щоб отримати цей фрагмент. Розщеплення зв'язку гомолопетично означає, що ліганд вніс один електрон. У методі стану окислення ми розщеплюємо зв'язок завжди гетеролептично так, що всі сполучні електрони закріплюються за лігандом. Таким чином, ліганд вносить два електрони.
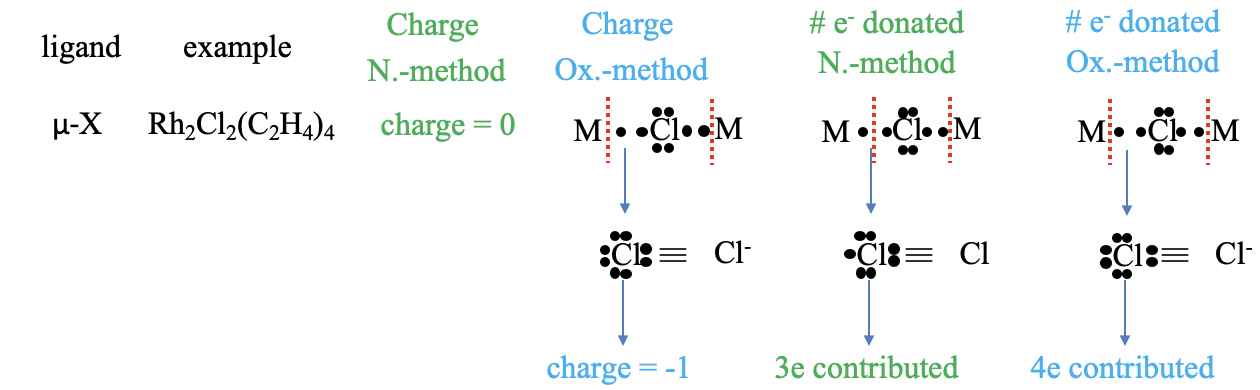
Галогенідний аніон як ліганд не може бути тільки кінцевим, але і мостовим. Прикладом може служити комплекс μ-дихлоробіс (тетраетиленородій (I)), в якому два хлор-ліганди з'єднують два атоми родію. Що таке заряд в методі нейтрального атома? Звичайно, він дорівнює нулю. Що таке заряд в методі ступеня окислення? Ми бачимо, що якщо розглядати як метало-лігандні зв'язки давальними зв'язками, так і розщеплювати зв'язки гетеролептично, то атом Cl оточений вісьмома нерозділеними електронами, що дає йому -1 заряд. Скільки електронів вноситься в метод нейтрального атома? Щоб відповісти на це питання, нам потрібно вирішити, чи потрібно розщеплювати зв'язки гомо- або гетеролептично, щоб отримати нейтральний атом Cl. Ви бачите це? Відповідь така: один зв'язок ми повинні розщепити гомолептично, а іншу гетеролептично. Скільки електронів тоді вносить хлорліганд? Це два електрони з гетеролептично розщепленого зв'язку, і один електрон з гомолептично розщепленого зв'язку. Таким чином, загалом це три електрони. А як щодо методу ступеня окислення? При цьому обидві зв'язки розщеплюються гетеролептично, а це означає, що в цілому вносяться чотири електрони.
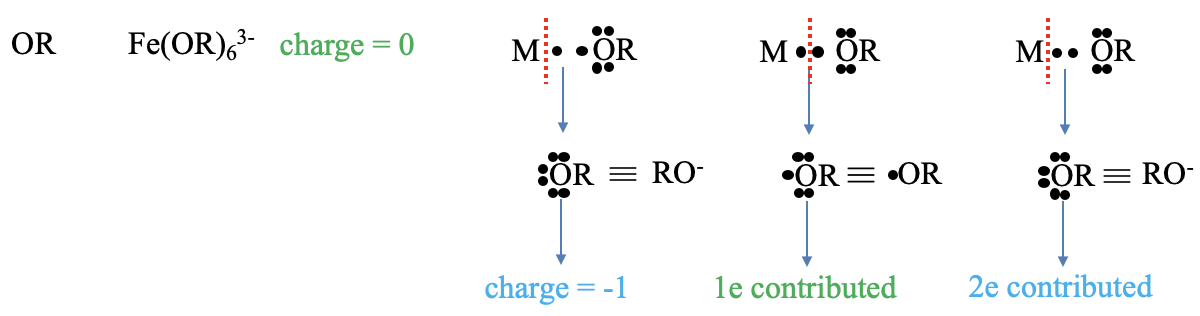
Які заряди та електрони сприяють алкоксиліганд (АБО), Рисунок\(\PageIndex{6}\)? Прикладом для комплексу з таким як ліганд є гексафеноксиферрат (3-). Заряд за методом нейтрального атома дорівнює нулю. У методі ступеня окислення ми розщеплюємо зв'язки гетеролептично, і наш ліганд стає алкоксидним аніоном. Цей аніон має 1- заряд. Скільки електронів вносить ліганд? Щоб отримати нейтральний фрагмент, ми повинні розщепити зв'язок гомолептично. Це фактично виробляє алкоксирадикал. Цей радикал сприяє своєму радикальному електрону, таким чином є один внесений електрон. У методі стану окислення ми розглядаємо зв'язок як давальний зв'язок і розщеплюємо зв'язок гетеролептично. Тому два електрони вносяться відповідно до методу ступеня окислення.
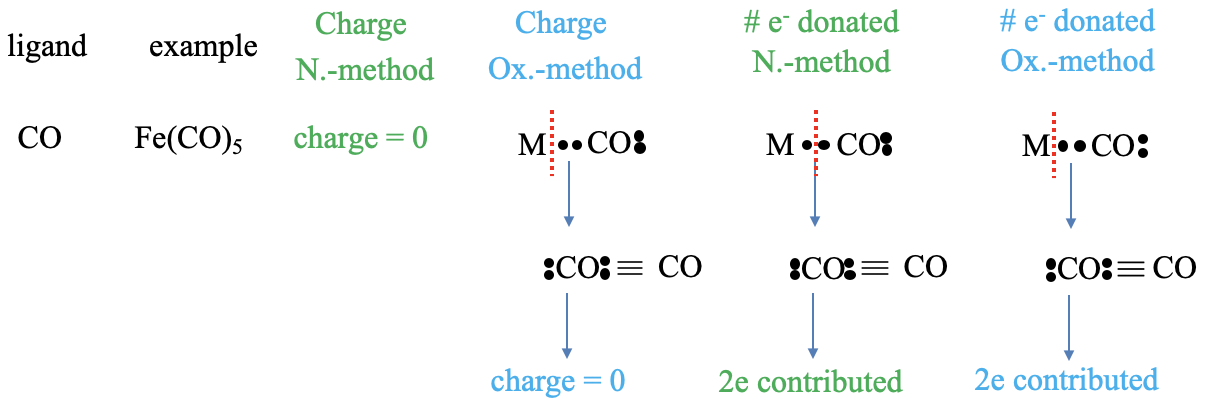
Далі застосуємо підрахунок електронів до карбонільного ліганду. Наприклад, п'ять молекул чадного газу утворюють з залізом пентакарбоніловий комплекс заліза. Заряд у ліганда в методі нейтрального атома дорівнює нулю. У методі стану окислення ми призначаємо обидва зв'язкових електрони ліганду, і це виробляє нейтральну молекулу чадного газу. Зверніть увагу, що атом вуглецю формально негативно заряджений, тому що оточений 5 електронами, але атом кисню заряджений позитивно, оскільки оточений п'ятьма електронами. Отже, в цілому молекула нейтральна. Яка кількість електронів, внесених в метод нейтрального атома? Щоб отримати нейтральний ліганд, ми повинні розщепити зв'язок гетеролептично. При цьому утворюється нейтральна молекула чадного газу. Оскільки ми розщепили зв'язок гетеролептично, ліганд вносить два електрони. У методі стану окислення ми завжди розщеплюємо зв'язки гетеролептично, і, таким чином, два електрони надходять з ліганду, теж.
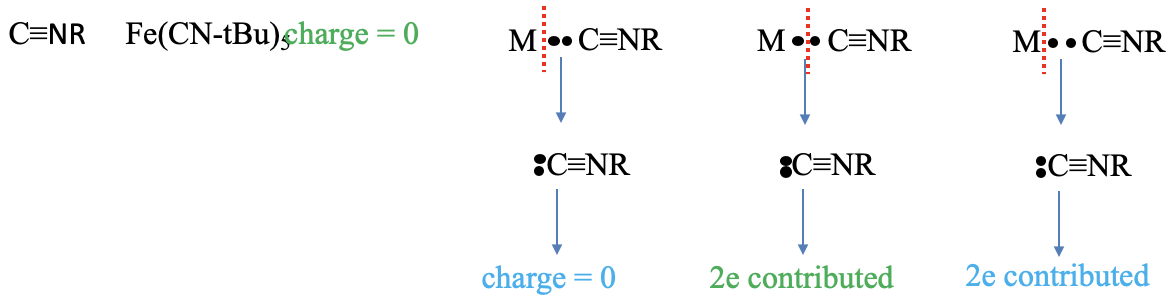
Останній ліганд, який ми тут обговорюємо, - ізонітриловий ліганд. Прикладом може служити молекула заліза пентакіс- (трет-бутилізонітрил). Заряд ліганда дорівнює нулю в методі нейтрального атома, але що це таке в методі ступеня окислення? Давайте подивимося, що відбувається, коли ми привласнюємо обидва сполучні електрони ліганду. Ми бачимо, що вуглець тепер оточений п'ятьма електронами. Три знаходяться в потрійному зв'язку вуглець-азот, а інші два походять від електронної одинокої пари на атомі вуглецю. Це означає, що атом вуглецю має -1 формальний заряд. Тепер давайте подивимося на атом N. Ми бачимо, що він оточений чотирма електронами, три виходять з потрійної зв'язку C-N, і один з зв'язку C-R. Це означає, що атом N має заряд +1. В цілому молекула нейтральна і не несе заряду. Як щодо кількості електронів, внесених? Ми бачимо, що ми повинні розщепити зв'язок гетеролептично, щоб отримати нейтральний ізонітрил, в методі нейтрального атома вносяться два електрони. Метод ступеня окислення повинен розщеплювати зв'язок гетеролептично, отже, кількість внесених електронів також дорівнює двом.
Правило 18 електронів
Підрахунок електронів важливий у контексті важливого правила координаційної хімії: правило 18 електронів. Правило 18 електронів стверджує, що для d-блокових елементів зазвичай комплекси з 18 електронами в оболонці (конфігурація ns 2 (n-1) d 10 np 6) є найбільш стійкими. Якщо цього числа не досягти, вид координатно ненасичений і має тенденцію додавати більше лігандів. Він також має тенденцію зменшуватися, оскільки додавання електронів призводить до комплексу або, принаймні, ближче до 18 електронів. Тому координаційно ненасичені комплекси, як правило, мають більш високу реакційну здатність.
Визначення: Координаційно ненасичені комплекси
Комплекс є координатно ненасиченим, коли 18 електронів не досягаються в (ns 2 (n-1) d 10 np 6 конфігурації) оболонки. Він має тенденцію додавати більше лігандів, і, як правило, зменшується. Він пов'язаний з більш високою реактивністю.
Якщо вид має більше 18 електронів, він координатно перенасичений і має тенденцію втрачати ліганди. Зазвичай він легко окислюється. Як втрати лігандів, так і окислення зменшуються до кількості електронів до або, принаймні, ближче до 18.
Визначення: Координаційно перенасичені комплекси
Комплекс координатно перенасичений, коли він має більше 18 електронів в оболонці (конфігурація ns 2 (n-1) d 10 np 6). Він, як правило, втрачає ліганди і має тенденцію до окислення.
Правило 18 електронів має багато винятків, і тому його потрібно застосовувати з обережністю. Зокрема, комплекси групи 3, 4 і 10 часто відхиляються від правила 18 електронів.
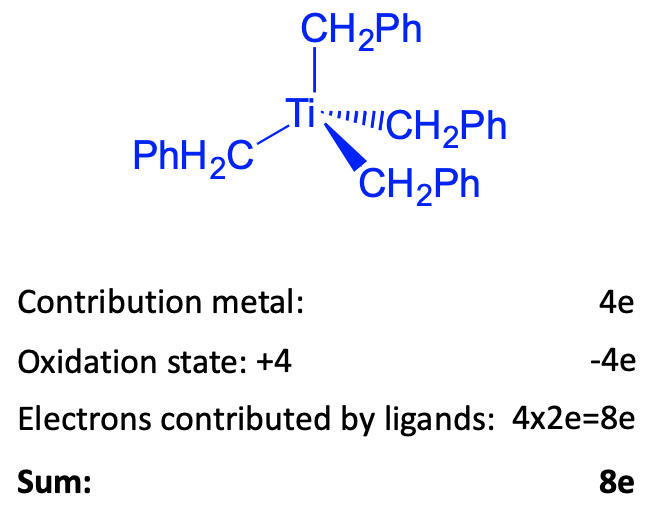
Для ілюстрації порахуємо кількість електронів тетраедричного тетрабензилтитану (0) комплексу методом окислення. Ми також могли б використовувати метод нейтрального атома, який дав би ті ж результати. Цей комплекс являє собою комплекс групи 4, оскільки титан знаходиться в групі 4. Скільки електронів сприятиме титан? Оскільки кількість електронів завжди таке ж, як і номер групи, це сприятиме чотири електрони. Далі, що таке ступінь окислення Ti? Для його визначення ми повинні визначити заряд у лігандів. Для цього ми розщеплюємо зв'язки гетеролептично. Це дасть бензилат-аніони з -1 зарядом. Всього цих іонів чотири, і тому в цілому буде чотири негативних заряду. Комплекс заряд-нейтральний, і, таким чином, ступінь окислення становить +4, тому що -4+4 = 0. Тому нам потрібно відняти чотири електрони. Оскільки ми розщепили зв'язок гетеролептично, кожен ліганд вносить два електрони, даючи загалом вісім електронів, що надходять від чотирьох лігандів. Це означає, що ми маємо загалом вісім електронів, або 8-електронний комплекс. Це далеко, далеко від 18 електронів. Тим не менш, комплекс стабільний. Як ми можемо це пояснити? Відповідь полягає в тому, що для досягнення 18 електронів потрібно було б додати п'ять додаткових лігандів, якщо кожен ліганд вважається 2-електронним донором. Це збільшить координаційне число до 9, що занадто високо, щоб створити стабільний комплекс. Для того, щоб зменшити комплекс до 18-електронного комплексу, потрібно було б додати 10 електронів. Це створило б комплекс із зарядом -10, який є шлях до високого рівня, щоб бути стабільним. Аргументи є узагальнюваними для комплексів групи 3 та 4 групи. Оскільки ці елементи мають лише кілька електронів d, ліганди повинні були б внести багато електронів, щоб створити 18 електронний комплекс. Це вимагатиме занадто багато лігандів, щоб додати. Координаційні цифри стали б занадто високими. Якщо замість лігандів додаються електрони, негативний заряд у комплексі буде занадто високим, щоб бути стабільним на основі електронно-електронних відштовхувальних аргументів.
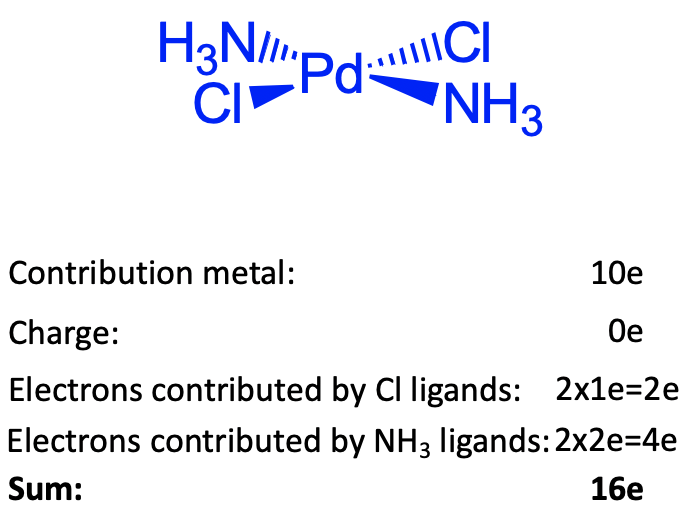
Ці аргументи не можуть бути застосовані для елементів групи 10, оскільки ці елементи мають багато d електронів. Пояснення в цьому випадку полягає в тому, що ці елементи люблять складати квадратні площинні комплекси, коли в окислювальному числі є +2. Квадратні площинні комплекси воліють 16 замість 18 електронів. Ми дізнаємося пізніше, коли обговорюємо склеювання в координаційних сполуках, чому це так. Ви можете бачити, що представлений квадратний плоский діамміндихлор паладій комплекс є квадратним площинним і має шістнадцять електронів. Є 10 електронів, що надходять від Pd. Якщо ми використовуємо метод нейтрального атома, електрони не потрібно додавати або віднімати через заряд в комплексі. Комплекс зарядно-нейтральний. Щоб оцінити, скільки електронів надходить з лігандів, нам потрібно розщепити зв'язки так, щоб утворювалися нейтральні ліганди. Зв'язки Pd-Cl потрібно розщеплювати гомолептично, зв'язки Pd-N потрібно розщеплювати гетеролептично. Тому два хлороліганди є донорами 1e, а два амінові ліганди є донорами 2e. Це дає 10+4+2=16 електронів.