1.3: Періодичні властивості атомів
- Page ID
- 18346
Періодична таблиця елементів
Розібравшись в принципі Ауфбау, ми тепер можемо зрозуміти періодичну таблицю елементів. Періодична таблиця була фактично винайдена задовго до того, як була розроблена квантово-механічна модель атомів. Вперше його ввели Менделєєв і Мейєр, які впорядкували елементи відповідно до їх масами поспіль. Всякий раз, коли елемент мав властивість, подібну до елемента, який вже вважався раніше, починається новий рядок. Це дало таблицю з рядками і стовпцями. У рядку маса елементів збільшувалася б, всередині стовпця можна було б знайти елементи, які мали подібні властивості. Рядки називатимуться періодами, а стовпці називатимуться групами, звідси і назва періодичної таблиці елементів. У той час, коли Менделєєв і Мейєр винайшли таблицю Менделєєва, все ще було багато невідкритих елементів, видимих як «дірки» всередині таблиці Менделєєва. Однак з часом таблиця Менделєєва стала повною (рис.1.3.1).
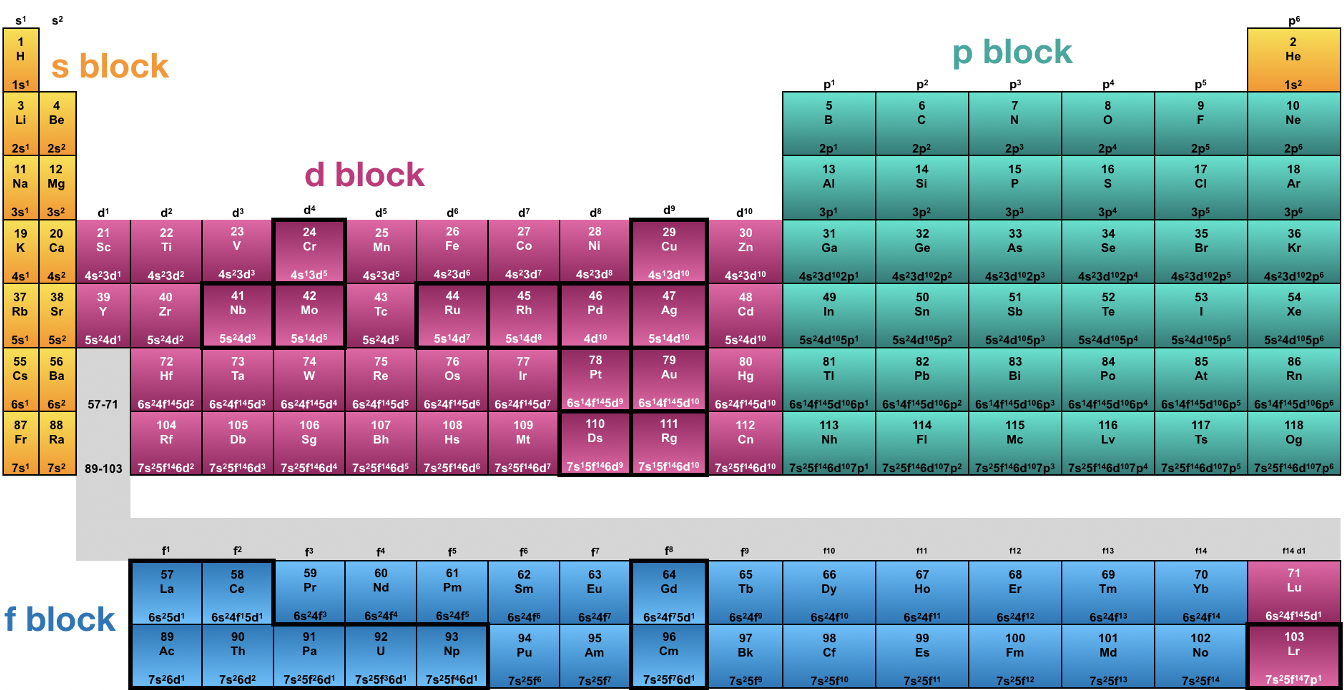
Сьогодні ми знаємо 118 елементів, що завершують сім періодів та 18 груп. Сьогодні елементи впорядковані не за масою, а за атомним номером (кількістю протонів), однак це не сильно змінило вихідну періодичну таблицю, оскільки, крім дуже небагатьох елементів, маса елементів слідує за атомним номером. До розробки квантово-механічної моделі не було зрозуміло, чому елементи в межах однієї групи мають схожі властивості. Коли ви аналізуєте електронну конфігурацію атомів, ви можете побачити, що всі атоми в одній групі мають однаковий тип найвищих електронів, також званих валентними електронами. Ці електрони - електрони, які мають найбільшу відстань від ядра і мають найвищі енергії. Оскільки вони мають найвищі енергії, вони також є електронами, які є найбільш реактивними, і визначають хімічні та фізичні властивості елемента. Наприклад, у першій групі всі елементи мають один s електрон як валентний електрон. Оскільки ці електрони мають найвищу енергію і є найбільш реактивними, вони визначають властивості атома, і таким чином елементи в першій групі мають схожі властивості.
Коли ви дивитеся в групу 2, всі електрони мають два s електрони як валентні електрони. Винятком є елемент гелій, який поміщений в групу 18, яка називається групою благородних газів. Інші елементи групи 18 мають два s і шість p електронів того ж квантового числа n, що і валентні електрони. Поведінка Він набагато більше схожий на поведінку інших елементів групи 18, а саме це газ з надзвичайно низькою реакційною здатністю. Це властивість обумовлено тим, що, як і інші благородні гази, він має повноцінну оболонку. Елементи з повною оболонкою особливо нереактивні, оскільки повні оболонки представляють особливо стабільні електронні конфігурації, які також називають конфігураціями благородних газів.
Група 1, група 2 і Він називаються s-блоком періодичної таблиці, оскільки вони є елементами, які мають лише s електрони як валентні електрони. З групи 3 до групи 12 є елементи з s і d електронами у вигляді валентних електронів. Ці елементи є d-блоком таблиці Менделєєва. d-блок починається з групи 3, де є тільки один d електрон разом з двома s електронами, і закінчується групою 12, де є десять d і два s електронів. У групі 12 d підоболонка повністю заповнена електронами. З групи 13 до групи 18 ми знаходимо електрони, які мають p електронів як валентні електрони. Існує шість груп, оскільки p орбіталі можуть вмістити до шести p електронів. У групі 13 є тільки один p валентний електрон, в групі 14 два, в групі 15 три, в групі 16 чотири, в групі 17 п'ять, а в групі 18 шість, крім гелію, про який ми вже обговорювали раніше. Група 13 - 18 називається блоком p таблиці Менделєєва. S-блок і p елементи блоку разом ще називають основними груповими елементами, елементи d-блоку називаються перехідними металами. Елементи основних груп мають специфічні назви. Елементи 1 групи, крім водню, називаються лужні метали, елементи групи 2 - лужні метали, елементи групи 13 - трієлі, елементи групи 14 - тетрели, елементи групи 15 - пніктиди, елементи групи 16 - халькогени, елементи групи 17 - галогени, а група 18 - благородні гази.
Нарешті, є блок f таблиці Менделєєва. F-блок містить елементи з f-валентними електронами. Оскільки існує сім f-орбіталей для заданого квантового числа n, орбіталі f можуть вмістити до 14 електронів, і, таким чином, існує 14 груп. Блок f фактично розташований між блоком s та блоком d періодичної таблиці, але зазвичай записується під рештою періодичної таблиці. Це робиться тому, що періодична таблиця стала б занадто широкою, якби вона була розміщена між блоком s та d. Зверніть увагу, що елементи f-блоку не мають номера групи. Відзначимо також, що елементи на лівому кінці f-блоку, лантан і актиній, фактично не мають f-валентних електронів. Вони є фактично групою 3 елементів, розташованих під елементами скандію і ітрію. Перший ряд f-блоку називається лантаноїдами, що є грецьким, що означає елементи, що слідують за лантаном. Тільки наступні за лантаном елементи мають f-валентні електрони. Аналогічно, актиній не є фактичним елементом f-блоку, а лише елементами, які слідують за актинієм. Їх називають актинідами.
Квантова механічна модель атомів також пояснює, чому періодична таблиця має періоди. Кожен період пов'язаний з квантовим числом n, першим періодом з n=1, другим періодом з n=2 тощо. Протягом періоду заповнюються наявні s і p валентні орбіталі певного квантового числа n. Підоболонки меншого квантового числа також можуть бути заповнені протягом періоду. Наприклад, 3d підоболонка заповнюється протягом четвертого періоду, а підоболонка 4f заповнюється в 6-му періоді.
Елементи з електронними конфігураціями, що відхиляються від очікуваної електронної конфігурації, виділені жирним шрифтом (рис. 1.3.1). Є лише винятки для елементів d-block і f-block. Деякі з них ми вже обговорювали, наприклад Cr і Cu. Крім того, наприклад, Pd має електронну конфігурацію 4d 10 замість 5s 2 4d 8, а Pt має електронну конфігурацію 6s 1 5d 9 замість 6s 2 5d 8. Ми можемо пояснити ці винятки при розгляді складних електростатичних і магнітних взаємодій електронів в багатоелектронних атомах. Не все можна пояснити простими поняттями правил Слейтера і правління Гунда.
Як хіміки, ми завжди повинні знати нашу таблицю Менделєєва. Навчання легше з музикою, і є казкова пісня Тома Лерера, яка може допомогти вам вивчити таблицю Менделєєва. Посилання на відповідне відео YouTube наведено нижче.
Атомні радіуси
Давайте тепер розглянемо, як називається періодичні властивості атомів. Це властивості, які змінюються через положення елемента в періодичній таблиці. Розглянемо спочатку, як залежать атомні радіуси атомів від положення атома в таблиці Менделєєва, рис.1.3.2.
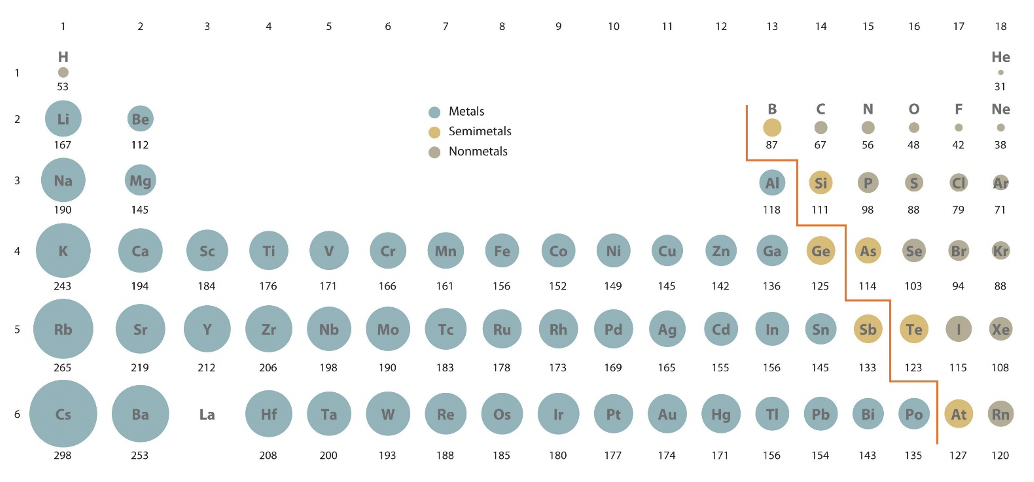
Коли ви подивитеся на те, як змінюються атомні радіуси протягом певного періоду, ви можете легко побачити, що вони зменшуються зліва направо в таблиці Менделєєва. Зменшення є більш значущим для елементів блоків s і p порівняно з блоковими елементами d. Пояснити цей ефект можна за допомогою концепції ефективного ядерного заряду. Коли ми йдемо зліва направо в таблиці Менделєєва, ми додаємо електрони до тієї ж оболонки. Оскільки також протон додається до ядра з кожним доданим електроном, електрон відчуває більшу привабливу силу від ядра. Цей ефект має тенденцію до збільшення ефективного ядерного заряду. Однак є і зворотний ефект. Оскільки є ще один електрон, існує більше ефектів відштовхування електронів та екранування, і це має тенденцію до зменшення ефективного ядерного заряду. Оскільки новий електрон додається до тієї ж оболонки, екрануючі ефекти не повністю компенсують додаткову кулонівську силу, що надходить від додаткового протона в ядрі, і, таким чином, збільшується ефективний ядерний заряд. Цей більш ефективний ядерний заряд тягне електрони ближче до ядра, і таким чином розмір атома зменшується. Для елементів d-блоку нові d електрони додаються до більш внутрішньої підоболонки, наприклад, для елементів d-блоку 4-го періоду d електрони додаються до 3d підоболонки. Через це ці 3d електрони можуть більш ефективно захищати ядерний заряд від двох електронів 4s, і, таким чином, зменшення атомного радіуса менш виражено. Підсумовуючи:
Тенденція 1: Атомний радіус безперервно зменшується протягом певного періоду.
Друга тенденція полягає в тому, що кожен раз, коли починається новий період, атомний радіус різко скаче. Наприклад, він стрибає з 31 вечора до 167 вечора, коли ми переходимо від гелію до літію, і з 38 вечора до 190 вечора, коли ви переходите від неону до натрію. Ця тенденція пояснюється тим, що електрони заповнюються в нову, більш зовнішню оболонку, коли починається новий період. Ця зовнішня оболонка розташована набагато далі від ядра, і таким чином збільшується радіус атома. Крім того, електрони у внутрішніх оболонках можуть дуже ефективно захистити ядерний заряд від електрона, доданого до нової оболонки, яка має тенденцію до збільшення радіуса атома. Підсумовуючи:
Тренд 2: Атомний радіус скаче, коли починається новий період.
Як третя тенденція ви можете побачити, що атомні радіуси збільшуються, коли ви йдете вниз по групі. Це пов'язано з тим, що всередині групи є однакова кількість і тип валентних електронів, але валентні електрони знаходяться в більш зовнішній оболонці, пов'язаній з більш високим квантовим числом n У дещо іншому погляді ми також можемо стверджувати, що перші дві тенденції складаються, щоб дати третій тренд. Ефект стрибка атомного радіуса при початку нового періоду більше, ніж ефект зниження радіуса протягом періоду. Як результат, радіус має тенденцію до збільшення, коли ви йдете вниз по групі. Підсумовуючи:
Тенденція 3: Атомний радіус безперервно збільшується всередині групи.
Визначення атомного радіуса не так банально може здатися. Отримати його можна або за допомогою квантових механічних розрахунків, або визначити експериментальним шляхом. Якщо його обчислити, то радіус визначається як радіус, який визначає обсяг, в якому електрон можна спостерігати з 90% ймовірністю. Радіуси, які ви бачите на малюнку 1.3.2, насправді обчислюються радіусами. Якщо визначити радіус експериментальним шляхом, то з'являються знову різні підтипи радіусів. Так звані металеві, або кришталеві радіуси, радіуси Вандерваальса та ковалентні радіуси. Ковалентний радіус - це половина відстані між двома однаковими атомами в молекулі, що утримуються разом в одному ковалентному зв'язку.
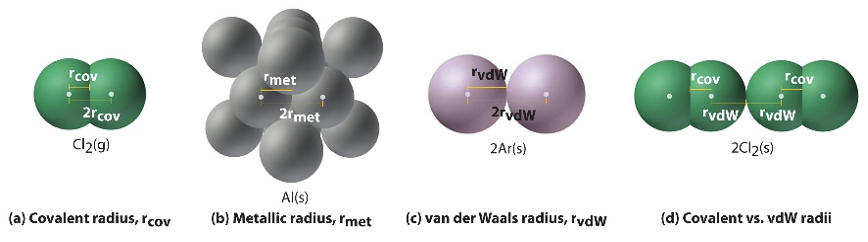
Це однозначно для молекул, таких як Cl 2, інші галогени, а також для інших випадків, таких як водень, вуглець (як алмаз), сірка та кілька інших випадків. Однак для кисню, O 2, ситуація менш зрозуміла, оскільки порядок киснево-кисневого зв'язку становить 2. В цьому випадку необхідно зробити висновок ковалентного радіуса з молекул, що містять O-O одиночні зв'язки або з молекул, що містять одинарний зв'язок Е-Х (Е = елемент), в яких відомий ковалентний радіус X. Радіус ван дер Ваальса становить половину відстані між двома однаковими атомами в кристалі, коли між атомом немає фактичного зв'язку, крім слабких сил ван дер Ваальса. Наприклад, в твердому аргоні між атомами є лише сили ван дер Ваальса, а половина відстані між атомами в твердому аргоні становить радіус Ван дер Ваальса. Для хлору, наприклад, радіус ван дер Ваальса становить половину відстані між двома атомами хлору двох різних молекул Cl 2 в твердому Cl 2. Відзначимо, що ван дер Ваальса радіус хлору відрізняється від ковалентного радіуса хлору. Це знову показує, що існує певна неоднозначність при визначенні атомного радіуса, і тому завжди важливо сказати, яке визначення атомного радіуса ви використовуєте. Нарешті, існує також металевий радіус, який застосовується до твердих металів, в яких атоми металів утримуються металевим зв'язком. Металевий радіус визначається як половина відстані між центрами двох атомів металу всередині металу.
Перша енергія іонізації
Перша енергія іонізації - ще одна важлива періодична властивість елементів. Він визначається як енергія, необхідна для видалення електрона з нейтрального атома в газовій фазі. Важливо розуміти, що ми маємо на увазі атом в газовій фазі тут, тому що тільки в газовій фазі атоми істотно не взаємодіють один з одним. Тому тільки при погляді на атом в газовій фазі ми можемо по-справжньому визначити властивості одиночних, ізольованих атомів. Давайте розглянемо два зображення (рис. 1.3.4), щоб визначити періодичні тенденції.
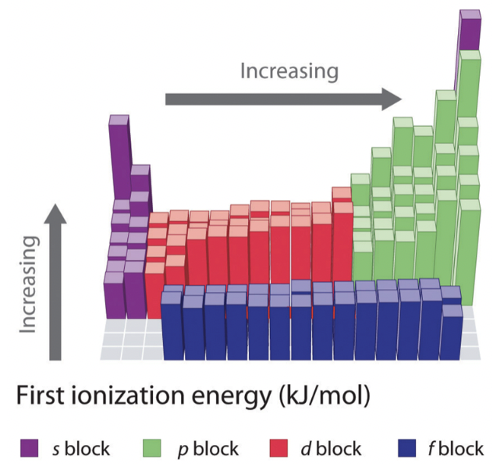
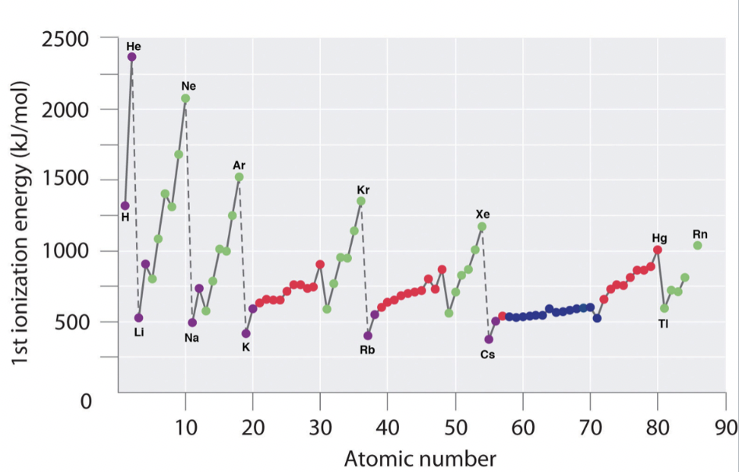
Перш за все потрібно усвідомити, що всі 1-й енергії іонізації позитивні. Це означає, що для видалення електрона з нейтрального атома завжди потрібна енергія. Ви можете зрозуміти це, якщо врахувати, що всі електрони в атомі пов'язані з ядром за допомогою енергії зв'язку. Якщо енергія іонізації була негативною, то це означало б, що атом мимовільно втратить електрон і спонтанно іонізуватися. Це було б нерозумно.
Тепер давайте подивимося, як змінюється перша енергія іонізації протягом певного періоду. Ми бачимо, що він збільшується, коли ми йдемо зліва направо протягом певного періоду. Цю тенденцію можна пояснити тим, що ефективний ядерний заряд збільшується зліва направо протягом певного періоду. Зі збільшенням ефективного ядерного заряду тяга ядра на найвищий електрон збільшується, і, таким чином, тим важче видалити цей електрон з атома. Однак ви можете бачити, що всередині основних елементів групи тенденція порушена два рази. Елементи групи 13 мають меншу енергію іонізації, ніж елементи групи 2, а елементи групи 16 мають меншу енергію іонізації, ніж елементи групи 15. Це явище можна пояснити тим, що заповнені і напівзаповнені підоболонки в групі 2 і групі 15 представляють особливо стабільні електронні конфігурації, і, таким чином, електрони всередині цих підоболонок мають незвично низьку енергію. З цієї причини ці електрони важче видалити з атомів. Елементи групи 2 мають заповнені s підоболонки, а елементи групи 15 мають напівзаповнені p підоболонки. Також можна помітити, що збільшення енергії іонізації менш виражено всередині d-блоку, а ще менш виражено при в f-блоці. Це пов'язано з тим, що ефективний ядерний заряд на найвищих електронах не збільшується так сильно, оскільки внутрішні d і f орбіталі заповнюються. Також можна помітити, що елементи групи 13 мають меншу енергію іонізації, ніж елементи групи 12. Це пов'язано з тим, що в групі 13 починається нова підоболонка p і нові електрони додаються до самої оболонки, де екрануючі ефекти менші.
Як друга тенденція можна побачити, що щоразу, коли починається новий період, енергія іонізації різко падає. Це пояснюється тим, що новий електрон додається до нової, більш зовнішньої оболонки, де ефективний ядерний заряд, що діє на новий електрон, набагато менший. Третя тенденція полягає в тому, що енергія іонізації стає меншою, коли ми йдемо вниз по групі. Це пов'язано з тим, що ефективний ядерний заряд на валентних електронах зменшується, оскільки квантове число n валентних електронів збільшується. Є одна особливість, яка потребує додаткового пояснення. Падіння енергії іонізації від водню до літію в першій групі надзвичайно велике. Це тому, що водень є єдиним елементом, для якого немає екрануючих ефектів, просто тому, що водень має лише один електрон. З цієї причини валентний 1-й електрон водню набагато важче видалити, ніж валентні s електрони інших елементів групи 1.
спорідненість до електронів
Тепер розглянемо спорідненість першого електронів (рис. 1.3.5). Він визначається як енергія, необхідна або виділяється при додаванні електрона до нейтрального атома в газовій фазі. Знову ж таки, ми дивимося на атом в газовій фазі, тому що ми хочемо розглянути ізольований атом, який не робить значних взаємодій з іншими атомами.
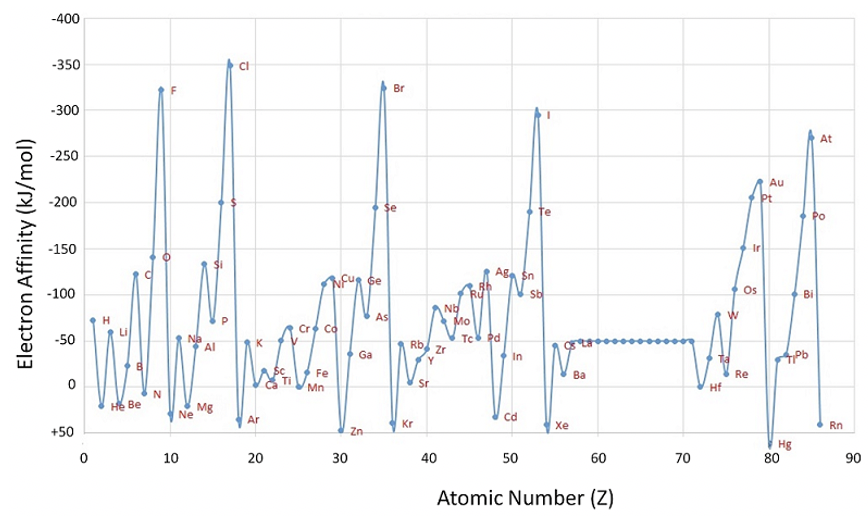
З графіка видно, що більшість елементів мають негативну електронну спорідненість, що означає, що додавання вільного електрона до нейтрального атома є екзотермічним і вивільняє енергію, однак це не завжди так. Деякі елементи мають негативну електронну спорідненість, зокрема благородні гази, але також Be, N, Mg, Zn, Cd та Hg. Zn, Cd та Hg - це 12 елементів групи з повною d підоболонкою, яка особливо стабільна. Додатковий електрон потрібно було б додати до p орбіти вищої оболонки, що енергетично досить несприятливо. Аналогічно, Be і Mg заповнили s підоболонки, які також є досить стабільними. Додавання додаткового електрона потрібно буде запустити нову підоболонку, яка енергетично не сприятлива. Ви можете бачити, що Ca і Sr мають електронну спорідненість близько 0, а Ba лише трохи негативний, показуючи, що більш високі періоди роблять додавання електрона до нової оболонки р трохи більш сприятливим. Азот має напівзаповнену p підоболонку, яка також є досить стабільною електронною конфігурацією, і тому додавання електрона не є сприятливим. Додавання електрона трохи сприятливіше для інших елементів групи 15, однак вони також, як правило, мають досить низьку електронну спорідненість.
Як правило, для елементів основної групи спорідненість електронів має тенденцію до збільшення від групи 1 до групи 17. Однак тенденція порушена для елементів групи 2 та групи 15, оскільки ці елементи мають повні та напівзаповнені підоболонки відповідно. Крім того, примітно, що елементи групи 1 мають більш високу електронну спорідненість, ніж елементи групи 3. Це пов'язано з тим, що додавання електрона до елемента групи 1 створює повну s підоболонку, яка є досить стабільною. Для елементів d-блоку спорідненість електронів має тенденцію до збільшення від групи 3 до групи 11, але тенденція порушується кілька разів, показуючи, що кожен елемент потрібно досліджувати окремо, що тут виходить за рамки. Відбувається велике падіння спорідненості електронів з групи 17 до групи 18, що легко пояснюється тим, що додавання електрона до елемента групи 17 виробляє заповнену оболонку, тоді як елемент групи 18 вже має повну оболонку, і додавання електрона почне нову оболонку. Аналогічно відбувається різке падіння спорідненості електронів з групи 11 до групи 12, оскільки додавання електрона до атома групи 11 виробляє повну підоболонку, тоді як додавання електрона до елемента групи 12 вимагатиме початку нової, більш зовнішньої підоболонки. Для елементів p-блоку спорідненість електронів має тенденцію спочатку збільшуватися від періоду 2 до 3, а потім зменшуватися. Для s-блоку спостерігається стійке зниження групи вниз. Для d блокових елементів немає чіткої тенденції спорідненості електронів.
Електронегативність
Нарешті, вивчимо електронегативність як періодичну властивість. Електронегативність - це міра здатності атома притягувати електрони всередині хімічного зв'язку. Це пов'язано з спорідненістю електронів в тому сенсі, що обидві властивості періоду вимірюють силу, за допомогою якої електрон притягується до нейтрального атома. Однак спорідненість електронів пов'язана з ізольованими атомами, які не роблять зв'язку з сусідніми атомами, тоді як електронегативність відноситься до атомів, які пов'язані з сусідніми атомами. Важливість електронегативності багато в чому пов'язана з її здатністю передбачати і розуміти природу зв'язку між атомами, зокрема, ковалентного, іонного та металевого зв'язку.
Шкали електронегативності
Електронегативність була концепцією, вперше розробленою Лінусом Полінгом для опису відносної полярності зв'язків і молекул. Він стверджував, що електронегативність атома може бути отримана з енергетичних відмінностей зв'язку між гомолептичними та гетеролептичними зв'язками (ур. 1.3.1).

Рівняння 1.3.1 Електронегативність за Полінгом, eV = електронвольти.
Наприклад, енергія, необхідна для розриву зв'язку в Н 2, дорівнює 432 кДж моль -1, а для F 2 - 159 кДж моль -1. Однак енергія, необхідна для розриву зв'язку в ВЧ, становить 565 кДж моль -1, що набагато вище, ніж очікувалося лише за рахунок усереднення енергії двох гомоядерних зв'язків (296 кДж моль -1). Паулінг стверджував, що різниця може бути призначена для електростатичних атракціонів між F і H «кінцями» молекули, завдяки чому кінець F має більшу електронну щільність, а кінець H має меншу електронну щільність. Чим більше різниця між середньою енергією гомолептичних зв'язків і гетеролептичних зв'язків, тим більше різниця електронегативності між атомами, і тим більше полярність гетеролептичного зв'язку.
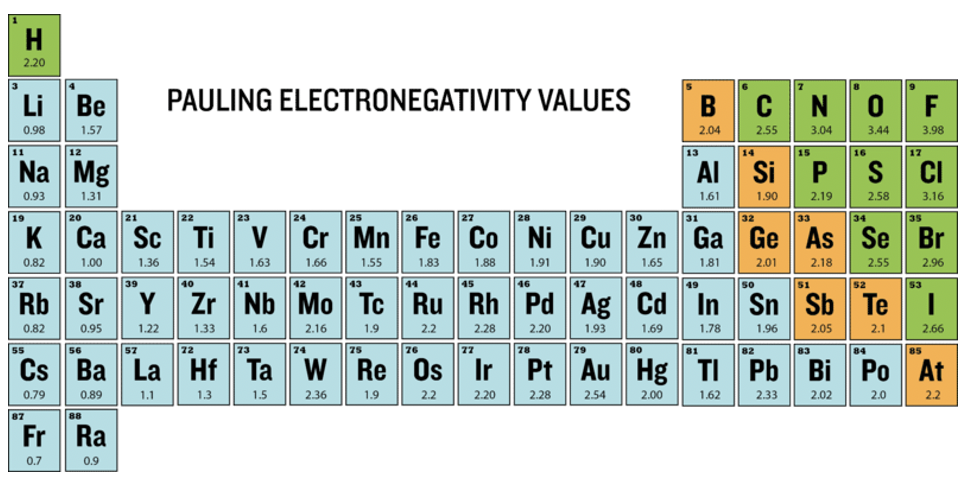
Спочатку Паулінг використовував арифметичні засоби енергій гетеролептичного зв'язку, пізніше він використовував геометричні засоби, тому що емпірично виявив, що воно працює краще (Рівняння 1.3.1). Середнє геометричне енергій гомолептичних зв'язків - квадратний корінь добутку енергій гомолептичного зв'язку. Цей метод лише забезпечив відмінності електронегативності. Тому йому потрібно було визначити еталонний атом з довільно певним значенням електронегативності, а потім визначити значення електронегативності всіх інших атомів щодо цього значення. Він вибрав в якості еталону самий електронегативний атом - атом фтору і присвоїв значення 4,0. Значення всіх інших атомів варіюються в межах 0,7 (Fr) і 3,44 (O), і наведені в таблиці Менделєєва нижче (рис.1.3.6).
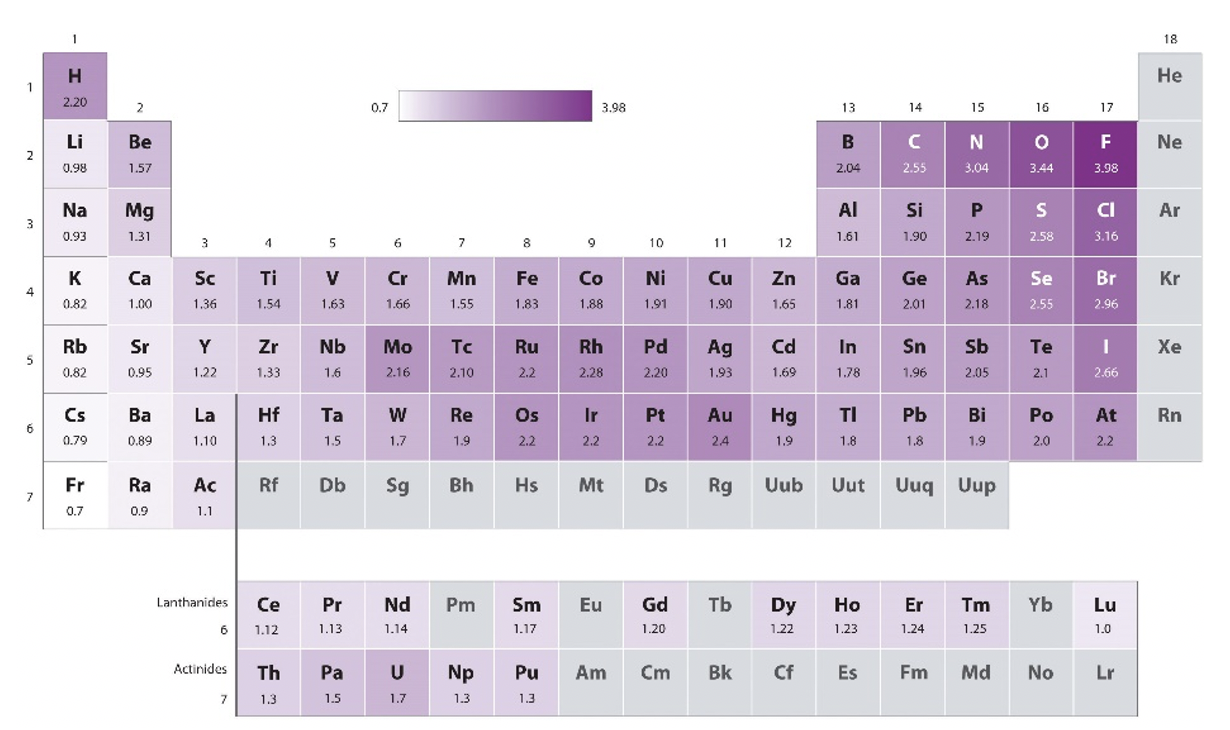
Які періодичні тенденції? Видно, що протягом певного періоду значення електронегативності основних елементів групи строго збільшуються з номером групи. Зверніть увагу, що благородні гази не мають електронегативності Паулінга, оскільки, за деякими винятками, благородні гази не утворюють сполук і, таким чином, для них не доступні енергії зв'язку. Ми також бачимо, що для основних елементів групи електронегативність строго зменшується вниз по групі. Це робить фтор найбільш електронегативним атомом, а цезій найменш електронегативним атомом. Цезій має значення електронегативності 0,7. Ми ігноруємо радіоактивний франциум тут. Для d-блоку тенденції менш суворі, але є тенденція підвищення електронегативності з групи 3 до групи 11. Всі елементи групи 12 мають меншу електронегативність порівняно з сусідньою групою 11 елементів. А як щодо тенденцій у групі? У групі 3 до групи 5 спостерігається невелике зниження електронегативності вниз по групі. Для групи 6 і 9 елементи періоду 5 мають більш високі значення, ніж їх сусідні елементи в періоді 4 і 6. Для групи з 10 до 12 електронегативність збільшується вниз по групі. Елементом d-блоку з найвищою електронегативністю є золото, воно має значення 2,4. Зауважимо, що це схоже на електронегативність таких неметалів, як I, S і P. З цих причин іноді золото може вести себе як неметал в сполуках з дуже низькою електронегативністю. Наприклад, існує сполука ауриду цезію (CSAU), яка є прозорою іонною кристалічною сполукою через високу різницю електронегативності між цезієм та золотом. Елементи f-блоку, як правило, мають низьку електронегативність.
Шкала електронегативності Паулінга походить від емпіричних даних про енергії зв'язку. Це дуже добре працює на практиці, і це актуальна найбільш використовувана шкала електронегативності. Однак це не пов'язати електронегативність з іншими періодичними властивостями, а квантово-механічною моделлю атомів. Одна шкала електронегативності, яка стосується цієї короткочасної шкали Аллерда-Рохоу. Він пов'язує електронегативність з кулонівською силою, яка діє на електрон на поверхні атома. Кулонова сила пропорційна ефективному ядерному заряду Z* і обернена пропорційна квадрату атомного радіуса. Z*/r 2 множиться на коефіцієнт 3590 і до цього терміну додається значення 0,744. Ці цифри емпірично підібрані так, щоб значення шкали Оллреда-Рохоу стали порівнянними зі шкалою Полінга.
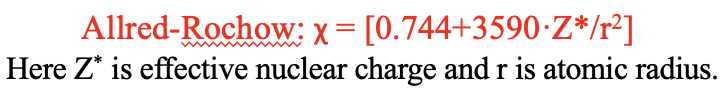
Рівняння 1.3.2 Визначення електронегативності Аллерда-Рохоу
Ще одна часто використовувана шкала - шкала електронегативності Маллікена. Шкала Муллікена пов'язує електронегативність до суми першої енергії іонізації IE та спорідненості першого електронів ЕА. Ми б інтуїтивно домовилися, що здатність атома притягувати електрони всередині хімічного зв'язку тим вище, чим важче видалити електрон з ізольованого атома, і тим легше додати електрон до ізольованого атома. Числа 0,118 та -0,207 емпірично підібрані, щоб зробити можливим порівняння зі шкалою Паулінга. Шкала Маллікена пов'язана зі шкалою Аллерда-Рочоу в тому сенсі, що можна пояснити енергії іонізації і електронну спорідненість атомів поняттям ефективного ядерного заряду.

Рівняння 1.3.3 Визначення електронегативності за Маллікеном
Ще одна шкала електронегативності була розроблена Leland C. Allen. Він призначений для основних групових елементів зокрема. Він стверджує, що електронегативність пропорційна середній енергії s і p валентних електронів в атомі. Ця концепція електронегативності також має відношення до концепції Оллреда-Рохоу, оскільки орбітальні енергії можна обчислити з ефективного ядерного заряду.
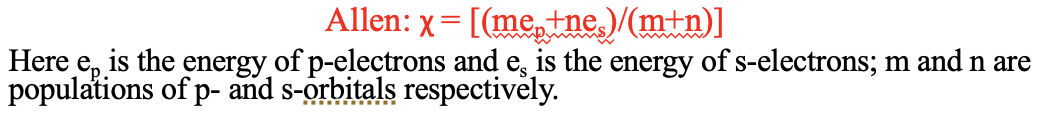
Рівняння 1.3.4 Визначення електронегативності Леланда Аллена
Загалом, ви можете бачити, що шкали електронегативності взаємопов'язані, вони кажуть, по суті, однакові, але присутні електронегативність з дещо іншої точки зору.
Електронегативність елементів і хімічне зв'язування
Одним з найпотужніших атрибутів електронегативності є те, що він може передбачити, який тип хімічного зв'язку слід очікувати в елементах і сполуках. Давайте спочатку розглянемо скріплення між елементами.
У зображеній таблиці Менделєєва (рис. 1.3.7) можна побачити тип хімічного зв'язку між атомами, позначений різними кольорами. Існує металеве з'єднання в металах, позначене кольором синього кольору. У металевих зв'язках електрони поділяються між атомами, але делокалізовані над багатьма атомами в металі. Зелений колір вказує на ковалентний зв'язок, що спостерігається в неметалах. У ковалентному зв'язку електрони діляться, але локалізуються між типово двома атомами. Металоїди мають хімічний зв'язок із сумішшю ковалентного та металевого характеру, показаного помаранчевим кольором. Відбувається розподіл електронів з помірним ступенем делокалізації. Значення електронегативності Паулінга елементів записуються під символами елементів.
Чи можемо ми співвідносити значення електронегативності з хімічним зв'язком в елементах? Ми можемо чітко бачити, що елементи з високими значеннями електронегативності значно вище 2,0, неметали, як правило, утворюють ковалентні зв'язки між ними. Всі металоїди з гібридним ковалентно-металевим характером, мають проміжну електронегативність близько 2,0. Більшість металів мають низькі значення електронегативності нижче 2,0, за винятком благородних металів, таких як Pt і Au. Загалом, можна сказати, що існує чітка залежність між типом зв'язку в елементі та його електронегативністю. Тепер давайте подивимося, чи може електронегативність також передбачити хімічне з'єднання в сполуках.
Трикутник Кетелаара
Здатність електронегативності прогнозувати тип зв'язку в сполуках можна зрозуміти трикутником Кетелаара, названим на честь Дж.А.А.
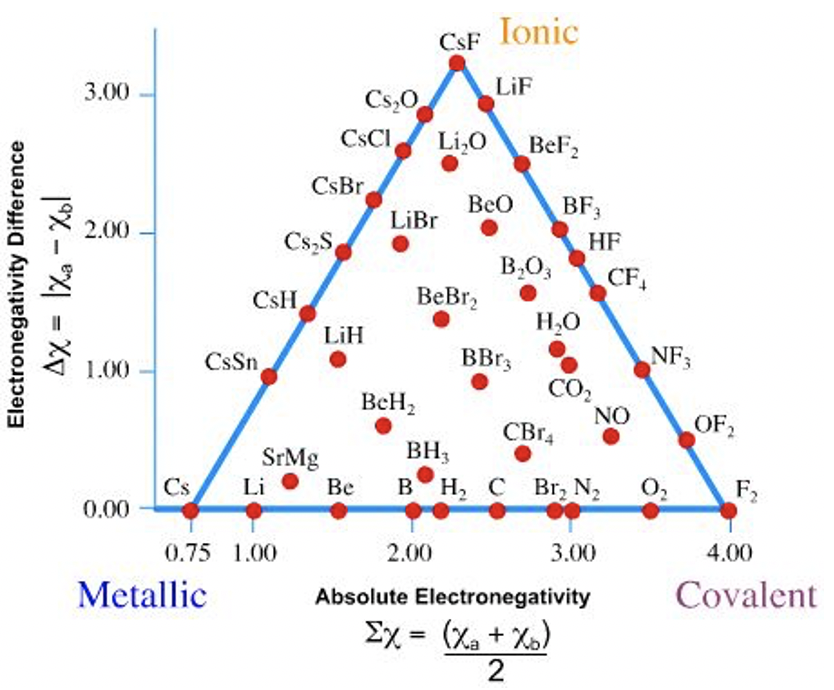
Можна помітити, що трикутник Кетелаара має три кути (рис. 1.3.8). Два кути займають елементи F і Cs, а третій кут займають CSF. Всі елементи розташовані на горизонтальному краю трикутника, і там багато з'єднання позначено точками або на двох інших краях, або всередині трикутника. За межами трикутника немає з'єднань або елементів. Як ми можемо зрозуміти цей трикутник і що він говорить про зв'язок між характером зв'язку і електронегативністю? Щоб зрозуміти це, подивіться на дві осі. Горизонтальна вісь x являє собою середню електронегативність атомів в елементі або з'єднанні. Вертикальна вісь y являє собою різницю електронегативності між атомами в елементах або сполуці. Для елементів різниця електронегативності між атомами дорівнює нулю, тому що в елементі всі атоми одного типу. Тому всі елементи лежать на горизонтально орієнтованому краю трикутника. Оскільки Cs є елементом з найменшою електронегативністю, він лежить найдалі лівіше на цьому краю. Фтор є елементом з найвищою електронегативністю, і таким чином лежить найдалі з правого боку. Інші елементи знаходяться в розташованих між цезієм і фтором на краю. Чим вище електронегативність елементів, тим далі правильніше їх положення на цьому краю трикутника.
Для з'єднань різниця електронегативності між атомами ніколи не дорівнює рівному нулю, тому всі сполуки розташовуються вище горизонтального краю трикутника. З'єднання з найбільшою різницею електронегативності - це CSF. Його середня електронегативність - це сума електронегативності Cs і F, поділена на 2: Отже, CSF визначає третій кут трикутника. Всі інші склади повинні лежати по краях або всередині трикутника. Всі сполуки цезію розташовані на краю між Cs і CsF, а всі сполуки фтору розташовані на краю між CsF і F2. З'єднання всіх інших елементів знаходяться всередині трикутника. Положення з'єднання на або в трикутнику визначає його характер зв'язку. Чим ближче положення з'єднання до кута Cs, тим металевіше, тим ближче положення до кута F2, тим більше ковалентне, і чим ближче воно до кута CsF, тим іонніше. Наприклад, Li 2 O розташований близько до CF, і зв'язок був би переважно іонним, хоча існує також невелика ступінь ковалентного і металевого зв'язку. На відміну від цього, SrMg має здебільшого металевий зв'язок, трохи ковалентного зв'язку та ще менше іонного зв'язку. Ситуація зв'язку в LiH знаходиться між металевим та іонним, з трохи ковалентного характеру зв'язку, змішаним в. Зверніть увагу, що 100% іонний зв'язок неможливий, оскільки різниця електронегативності є кінцевою, і, таким чином, завжди повинна бути певна ступінь спільного використання електронів. На відміну від цього, 100% ковалентний зв'язок можливий, оскільки електрони можуть бути однаково розподілені між двома атомами, коли різниця електронегативності дорівнює нулю.
Візьміть додому повідомлення полягає в тому, що в сполуках і елементах зазвичай існує суміш типів склеювання, і жоден тип склеювання, навіть через один тип склеювання може сильно домінувати. Поняття електронегативності, і трикутник Кетелаара, зокрема, надзвичайно корисно передбачити, в якій мірі три типи зв'язку присутні в речовині.
