8.1: Каталітичні реакції
- Page ID
- 20350
Каталізатори знижують енергію активації реакцій і підсилюють швидкість специфічних реакцій. Тому вони мають вирішальне значення в хімічній промисловості, обробці вихлопних газів та інших хімічних реакціях. Хоча хімічна сутність каталізу незрозуміла, на основі накопичення емпіричних знань були розроблені практичні каталізатори. Однак, хоча поступово ми зрозуміли механізми гомогенного каталізу через розвиток неорганічної хімії, наше розуміння поверхневих реакцій у твердих каталізаторах також поглиблюється.
(a) Гомогенний каталіз
Хімія каталізаторів, розчинних у розчинниках, чудово розвинулася з моменту відкриття епохи (1965) каталізатора Wilkinson, [rHCl (pPH 3) 3]. Цей комплекс являє собою пурпурно-червону сполуку, яка утворюється при нагріванні rHCl 3 • 3 H 2 O і pPH 3 під рефлюксом в етанолі. При розчиненні в органічному розчиннику цей комплекс є відмінним каталізатором гідрування ненасичених вуглеводнів Н 2 при температурах навколишнього середовища і тиску з утворенням насичених вуглеводнів, а також реакцій гідроформулювання олефінів з Н 2 і СО до утворюють альдегіди.
У минулому механізм каталітичних реакцій взагалі був не дуже чітким. Перед каталізатором Вілкінсона був виявлений процес Реппе, який олігомеризує ацейлени або каталізатори Циглера-Натта, що полімеризують олефіни та дієни, і були проведені детальні дослідження однорідного каталізу з точки зору хімії комплекси. Отже, каталітичні реакції зараз встановлюються як цикл поєднання декількох елементарних стадій, які відбуваються на металах каталізаційних комплексів.
Координація та дисоціація
Повинен бути процес, в якому реагенти, такі як олефіни, активуються і вступають в реакцію з іншими реагентами після узгодження з центральним металом комплексу, і вони відділяються від металу як продукти.
Окислювальне додавання
Окислювальне додавання є однією з небагатьох ключових елементарних реакцій комплексів металів. Це реакція таких сполук, як галогеніди лужних металів, RX, кислоти, HX або дигідроген, H2, на метал в комплексі, які потім дисоціюють на R і X, H і X, або H і H, які пов'язані з металом у вигляді двох фрагментів аніонів. Якщо інші ліганди на стартовому комплексі не видаляються, координаційне число збільшується на два. Оскільки алкільні, галогенні та гідридні ліганди є більш електронегативними, ніж центральний метал, вони після координації розглядаються як формально аніонні ліганди. Тому число окислення центрального металу збільшується після реакції приєднання. Оскільки це реакція приєднання, що супроводжується окисленням центрального металу, її називають окислювальним додаванням.
Наприклад, в реакції додавання алкілгалогеніду до тетракоординатного комплексу іридію (I) [iRCl (CO) (pPH 3) 2],
\[[Ir^{I} Cl (CO) (PPh_{3})_{2}] + RI \rightarrow [Ir^{III}(Cl)(I)(R)(CO)(PPh_{3})_{2}]\]
іридій стає гексакоординатним і піддається двоелектронному окисленню від +1 до +3. Так як додається нейтральна молекула RI, зміни заряду всього комплексу бути не повинно, а якщо алкіл і йод є аніонами, то число окислення центрального металу має збільшитися на 2. Подібні зміни відбуваються при утворенні двох гідридних лігандів в результаті додавання дигідрогену.
Зворотна реакція називається редуктивної елімінацією. Як окислювальна, так і відновна реакції дуже важливі як елементарні етапи в механізмі гомогенного каталізу за участю вуглеводнів і диводню.
Вправа\(\PageIndex{1}\)
Як змінюється число окислення родію при відновному виведенні дигідрогену з [RhCl (H) 2 (pPH 3) 2 (Sol)]?
- Відповідь
-
Він змінюється на Rh (I) від Rh (III).
Реакція вставки
У реакції алкілу або гідридного ліганду на перехід до карбонільного або олефінового ліганду, що співіснує на центральному металі, результуючий комплекс з'являється так, ніби між зв'язком M-R або M-H вставлений карбоніл або олефін. Це називається реакцією вставки.
Реакція скоординованого ліганда
Це процес, при якому узгоджений реагент реагує на утворення продукту. Погоджуючись на метал, реагенти приймають геометрично та електронно відповідні конформації. Це основа конструкції каталізатора для контролю цих умов реакції.
Оскільки реакція повторюється в той час як комплекс, який використовується в якості каталізатора, залишається незмінним шляхом формування циклу реакцій, співвідношення реагентів/комплекс дуже мало, збігаючись з визначенням каталізатора. Каталітичний цикл при гідруванні етилену проілюстрований на рис\(\PageIndex{1}\).
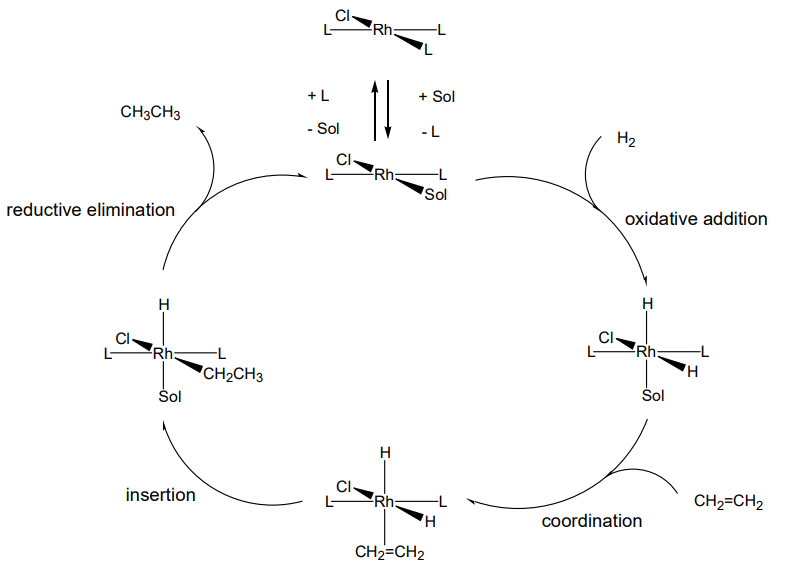
Якщо трифенілфосфіновий ліганд P (C 6 H 5) 3 в каталізаторі Уилкінсона замінений оптичним активним фосфіном, реалізується асиметричне гідрування. Асиметричний каталіз, еквівалентний реакціям ферментів, був розроблений завдяки вмілому дизайну асиметричних лігандів. Зокрема, привернула увагу асиметрична індукція бінафтилдифосфіну (BINAP).
(б) Твердотільний каталіз
Твердий каталізатор також називають гетерогенним каталізатором, і сприяє реакції реагентів в газовій або рідкій фазах, що контактують з твердим матеріалом. Оскільки адсорбція реагентів на поверхні каталізатора є початковим етапом, для хорошої ефективності каталізу потрібна велика площа поверхні. Часто використовуються поліфазні системи, які несуть активні каталізатори на таких матеріалах, як цеоліти з малими порами молекулярних розмірів, а також гамма-оксид алюмінію і силікагель з великою площею поверхні.
Раніше твердотільний каталіз пояснювався як виникає внаслідок загадкової активації реагентів внаслідок адсорбції, але все більш зрозуміло, що каталіз приписується поверхневим хімічним реакціям. А саме дія твердотільних каталізаторів залежить від активації реагентів поверхневими кислотами або основами, і від координації з поверхнею металу. Спостерігати за цими взаємодіями можна за допомогою різних спектроскопій (інфрачервона спектроскопія, EXAFS (розширена тонка структура поглинання рентгенівського випромінювання), електронні спектри), електронна мікроскопія або STM (скануюча тунельна мікроскопія).
Оскільки механізми гомогенного каталізу були значно з'ясовані, тверді поверхневі реакції також можна проаналізувати шляхом введення таких понять, як «поверхневі комплекси» або «поверхневі органометалічні сполуки». Однак, на відміну від гомогенного каталізу, в якому бере участь тільки один або кілька металевих центрів, багато активних ділянок беруть участь в каталізі твердого стану. Оскільки однорідність поверхні і відтворюваність важко підтримувати, основні частини реакційних механізмів незрозумілі навіть для таких простих реакцій, як синтез аміаку.
При безпосередньому виробництві аміаку з азоту і дигідрогену відбуваються реакції з використанням каталізаторів заліза, що містять оксиди лужних металів або лужноземельних металів в якості активаторів при високих температурах (близько 450 °С) і при високих тисках (близько 270 атм). До епохального відкриття цього процесу Ф.Хабером (1909) всі сполуки азоту надходили з природних ресурсів. Реалізація цього відкриття мала незмірний вплив на хімічну промисловість, оскільки аміак незамінний для виготовлення добрив, пороху та інших неорганічних сполук, що містять азот. На знак визнання цього за цей винахід Ф.Хаберу була присуджена Нобелівська премія (1918 р.). Величезний обсяг досліджень з з'ясування механізму реакції синтезу аміаку був проведений до теперішнього часу, оскільки реакція азоту і диводню на залізні каталізатори є хорошою моделлю твердотільного каталізу.