5.4: Група 13 Метали
- Page ID
- 20121
Алюміній, Al, серед металів групи 13 (табл.\(\PageIndex{4}\)) існує як алюмосилікати в земній корі і є більш багатим, ніж залізо. Найважливішим мінералом для металургії є боксит, AlO x (OH) 3-2x (0 < x < 1). Хоча метал Al був таким же цінним, як благородні метали в 19 столітті, ціна різко впала після того, як він став виготовлятися у великих кількостях електролізом глинозему, Al 2 O 3, розплавленого в кріоліті, Na 3 AlF 6. Однак оскільки його виробництво вимагає споживання великої кількості електроенергії, металургія алюмінію економічно доцільна тільки в країнах, де ціна на електроенергію невисока. Тому Японія вийшла з виплавки алюмінію, але за споживанням металу Японією поступається тільки США. Властивості алюмінію добре відомі, оскільки він широко використовується і зустрічається в повсякденному житті, наприклад, в монетах однієї ієни, алюмінієвої фольги, каструлі для приготування їжі, алюмінієвих віконних стулок тощо Алюмінієвий метал зазвичай перевищує чистоту 99%, а сам метал і його сплави, як дюралюміній, широко використовуються.
| мп (°C) |
бп (°C) |
d (20° C) (г см -3) |
Е 0 (В) М 3+ +3е - |
Я перший |
(кДж моль -1) секунда |
третя |
|
|---|---|---|---|---|---|---|---|
| Аль | 660 | 2519 | 2.70 | -1.66 | 577 | 1816 | 2744 |
| Га | 29.8 | 2204 | 5.90 | -0.55 | 579 | 1979 | 2962 |
| В | 157 | 2072 | 7.31 | -0.34 | 558 | 1820 | 2704 |
| Тл | 304 | 1473 | 11.9 | +0.74 | 589 | 1971 | 2877 |
Алюмінієвий метал розчиняється в мінеральних кислотах, крім концентрованої азотної кислоти, і в водних розчині гідроксидів лужних металів, що виділяють водень. Алюміній утворює сполуки з більшістю неметалевих елементів і показує багату хімію, але на відміну від бору, ніякі кластерні гідриди не відомі. Оскільки оксид і галогеніди вже були описані (4.3 (c), 4.5 (d)), тут будуть згадані органо-алюмінієві сполуки.
Алюмінійорганічні сполуки
Органоалюмінієві сполуки використовуються у великих кількостях для полімеризації олефінів, і вони промислово виготовляються з металу алюмінію, водню та олефіну наступним чином.
\[\ce{2 Al + 3 H2 + 6 CH2 = CHR \rightarrow Al_{2} (CH2CH2R)6}\]
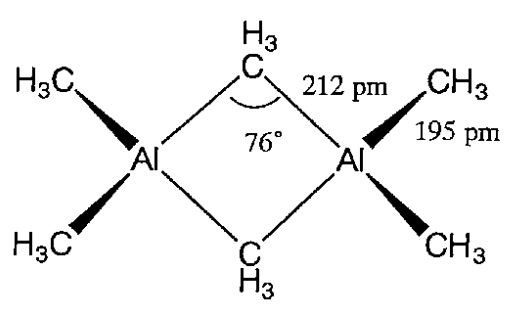
Вони є димерами, крім тих, що мають громіздкі гідрокарбільні групи. Наприклад, триметилалюміній, Al 2 (CH 3) 6, являє собою димер, в якому метильні групи з'єднують атоми алюмінію за допомогою електронно-дефіцитних зв'язків (рис.\(\PageIndex{2}\)).
Органоалюмінієві сполуки дуже реактивні і мимовільно горять на повітрі. Вони бурхливо реагують з водою і утворюють насичені вуглеводні, а алюміній змінюється на гідроксид алюмінію наступним чином.
\[\ce{Al(CH2CH3)3 + 3 H2O \rightarrow 3 C2H6 9 Al(OH)3}\]
Тому з ними слід обробляти в лабораторії в ідеально інертній атмосфері. Каталізатор Ziegler-Natta, що містить органо-алюмінієву сполуку та сполуку перехідного металу, був епохальним каталізатором полімеризації олефінів, розробленим у 1950-х роках, за який була присуджена Нобелівська премія (1963).
Алкільна сполука перехідного металу утворюється, коли органоалюмінієва сполука реагує зі сполукою перехідного металу. Утворену таким чином алкільну сполуку перехідного металу можна виділити, коли стабілізаційні ліганди узгоджуються з металевим центром.
Галій, Ga, має найбільшу різницю температур температури плавлення та температури кипіння серед усіх металів. Оскільки він плавиться трохи вище кімнатної температури, діапазон температур рідкого стану дуже широкий і його використовують як термометр високої температури. В останні роки метал використовується для виготовлення з'єднаних напівпровідників арсеніду галію, GaAs і фосфіду галію, GaP.
Індій, В, є м'яким металом також з низькою температурою плавлення. Він є сировиною для з'єднання напівпровідників InP, InAs і т.д. індій має два стабільних стану, In (I) або In (III), а In (II) сполуки вважаються змішано-валентними сполуками одновалентного і тривалентного In.
Талій, Tl, також має два стабільних стану, Tl (I) і Tl (III), а Tl (II) - змішана валентна сполука одновалентного і тривалентного Tl. Оскільки елемент дуже отруйний, з металом і його з'єднаннями слід звертатися обережно. Оскільки він є слабким відновником порівняно з Na (C 5 H 5), циклопентадієнід талію, Tl (C 5 H 5) іноді використовується для отримання циклопентадієнільних сполук і є корисним реагентом в металоорганічної хімії.
Вправа\(\PageIndex{3}\)
Наведіть приклад металів, для яких існують стабільні іони, що відрізняються числами окислення.
- Відповідь
-
В (I), В (III), Тл (I), Тл (III), Sn (II), Sn (IV).
Реакція органіко-алюмінієвих сполук
Органоалюмінієві сполуки були синтезовані вперше в 1859 році, але вони не розглядалися настільки важливими, як реагенти Гріньяра або органолітієві сполуки як синтетичні реагенти протягом деякого часу. Частково це пов'язано з низькою реакційною здатністю ефірних аддуктів, R 3 Al:Oet 2, які були присутні через часте використання ефіру в якості розчинника. Дослідження К.Циглера змінили цю ситуацію. К.Циглер також відкрив олігомеризацію етилену органоалюмінієвими сполуками і утворення вищих органоалюмінієвих сполук шляхом введення етилену в алюміній-вуглецеві зв'язки. Оскільки спирти утворилися в результаті гідролізу органоалюмінієвих сполук, ці відкриття мали важливе значення для органічного синтезу.
Виявлення дії слідової кількості нікелю в реакційній посудині для отримання лише бутену з етилену призвело до дослідження впливу перехідних металів на цю реакцію. Багато солей перехідних металів були досліджені і Циглер виявив, що сполуки титану дають найвищий ступінь полімеризації етилену. Це було народження так званих каталізаторів Циглера. Слід пам'ятати, що це велике відкриття 1950-х років сталося, коли нафтохімічна промисловість почала розвиватися і зробила революцію в хімічній промисловості вищих полімерів.