5.1: Метали групи 1
- Page ID
- 20103
Метали 1 групи називаються лужними металами. Лужних металів багато в мінералах і морській воді. Особливо вміст натрію, Na, в земній корі займає четверте місце після Al, Fe і Ca. Хоча існування іонів натрію або калію було визнано протягом багатьох років, ряд спроб виділити метали з водних розчинів їх солей не вдалося через їх високу реакційну здатність з водою. Калій (1807) і згодом натрій були виділені електролізом розплавленої солі КОН або NaOH H Деві в 19 столітті. Літій Li був відкритий як новий елемент (1817), і Деві незабаром виділив його електролізом розплавленої солі Li 2 O. Rubidium, Rb і Cesium, Cs, були виявлені як нові елементи спектроскопією в 1861 році. Франціум, о., був виявлений за допомогою радіохімічної техніки в 1939 році. Його природне достаток дуже низький.
| мп (°C) |
бп (°C) |
d (20° C) (г см -3) |
Е 0 (В) М + е - |
I (кДж моль -1) |
|
|---|---|---|---|---|---|
| Лі | 181 | 1342 | 0,534 | -3.04 | 520 |
| Na | 98 | 883 | 0,968 | -2.71 | 496 |
| К | 63 | 759 | 0,856 | -2.93 | 419 |
| Рб | 39 | 688 | 1.532 | -2.98 | 403 |
| Cs | 28 | 671 | 1,90 | -3.03 | 376 |
Як показано в таблиці\(\PageIndex{1}\), температури плавлення, температури кипіння і щільності лужних металів низькі, і вони є м'якими металами. Оскільки зовнішня оболонка містить всього один с-електрон, енергія іонізації дуже низька, і моно катіони лужних металів утворюються легко. Якісний аналіз лужних металів можливий за допомогою реакцій полум'я з використанням характерних ліній люмінесценції. Особливо помаранчева D-лінія натрію використовується в натрієвій лампі. Лужні метали окислюються водою, що виділяє водневий газ через їх низькі відновні потенціали. За винятком літію, важчі лужні метали бурхливо реагують з водою, і при їх поводженні слід дотримуватися достатньої обережності.
Вправа\(\PageIndex{1}\)
Охарактеризуйте реакційну здатність лужних металів у воді.
- Відповідь
-
Реактивність літію найнижча, натрій бурхливо реагує, а калій, рубідій та цезій реагують вибухонебезпечно.
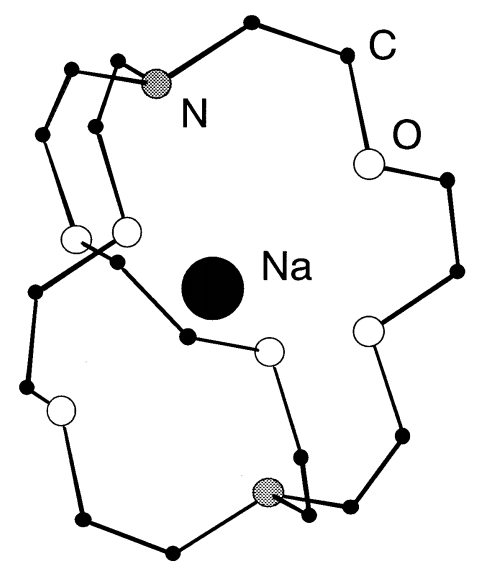
Лужні метали також мають високу реакцію до кисню або галогенів. Оскільки лужні метали дуже відновлюють, вони широко використовуються як відновники. Через високу спорідненість лужних металів до галогенів, вони важливі в органічних і неорганічних синтезах, які виробляють галогеніди лужних металів в результаті реакцій конденсації та метатезу. Хоча, як правило, важко розчиняти метали в розчинниках, щоб зробити атомні диперсії, лужні метали можуть бути дисперговані в рідких розчинах аміаку, амальгамах, а також у вигляді криптанду (рис.\(\PageIndex{1}\)), нафталіну або бензофенону (C 6 H 5) 2 комплексів СО.
Аміак кипить при -33,35° C, але рідкий аміак можна легко обробляти. Лужні метали легко розчиняються в рідкому аміаку, а розведені розчини сині, але концентровані мають бронзовий колір. Метал відновлюється при випаровуванні аміаку з металевих розчинів. Розчини лужних металів мають однаковий колір незалежно від виду лужних металів, оскільки колір обумовлений розчиненими електронами. А саме розчинення супроводжується поділом атомів лужного металу на катіони металів і електрони, розчинені аміаком, згідно з наступним рівнянням.
\[M + n\; NH_{3} \rightarrow M^{+} [e^{-} (NH_{3})]\]
Рідкий розчин аміаку лужного металу є провідним і парамагнітним. Високо відновлюючий розчин використовується для спеціальних реакцій відновлення або синтезу комплексів лужних металів і полігалогенідів.