4.5: Халькогени та халькогеніди
- Page ID
- 20451
(а) Прості речовини
Сірка, селен і телур називаються халькогенами. Прості речовини і сполуки кисню і елементів цієї групи в більш пізні періоди мають значно різні властивості. В результаті наявності набагато меншої електронегативності, ніж кисень, вони показують знижену іонність і підвищену ковалентність зв'язку, що призводить до меншого ступеня водневого зв'язку. Оскільки вони мають доступні орбіталі d, халькогени мають підвищену гнучкість валентності і можуть легко зв'язуватися з більш ніж двома іншими атомами. Катенація - це зв'язок між одними і тими ж атомами халькогену, і як прості речовини, так і іони халькогенів приймають найрізноманітніші структури.
Основними ізотопами сірки є 32 S (95,02% чисельності), 33 S (0,75%), 34 S (4,21%) та 36 S (0,02%), а також шість радіоактивних ізотопів. Серед них 33 S (I = 3/2) можуть бути використані для ЯМР. Оскільки ізотопне співвідношення сірок з різних локацій відрізняється, точність атомного ваги обмежена 32.07+0,01. Оскільки електронегативність сірки (\(\chi\)= 2,58) набагато менша, ніж у кисню (\(\chi\)= 3,44), а сірка є м'яким елементом, іонність в зв'язках сірчаних сполук низька і водневе з'єднання не має значення. Елементарна сірка має багато алотропів, таких як S 2, S 3, S 6, S 7, S 8, S 9, S 10, S 11, S 12, S 18, S 20 та S \(\alpha\), що відображають катенаційна здатність атомів сірки.
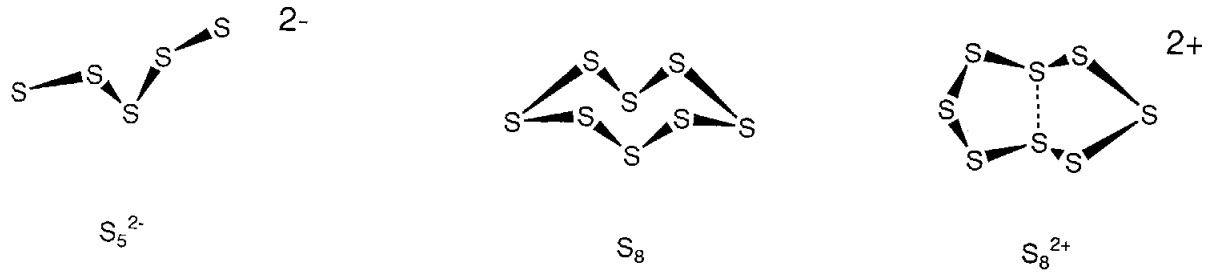
Елементарна сірка зазвичай являє собою жовту тверду речовину з температурою плавлення 112,8° C, звану орторомбічною сіркою (\(\alpha\)сіркою). Фазовий перехід цього поліморфа виробляє моноклінну сірку (\(\beta\)сірку) при 95,5 °С. 1935 р. встановлено, що це короноподібні циклічні молекули (рис.\(\PageIndex{18}\)). Будучи молекулярними, вони добре розчиняються в органічних розчинниках, таких як CS 2. Відомі не тільки 8-членні кільця, але і кільця S 6-20, а спіральний полімер сірки - нескінченно кільцева сірка. Двоатомна молекулярна S 2 і триатомна молекулярна S 3 існують в газоподібній фазі. При нагріванні сірки вона розріджується і при охолодженні стає гумоподібної макромолекулою. Різноманітність структур катенованої сірки також спостерігається в структурах полісірчаних катіонів або аніонів, що виникають в результаті окислювально-відновних реакцій катенованих видів.
Вважається, що селен має шість ізотопів. 80 Se (49,7%) є найбільш поширеним і 77 Se, з ядерним спіном I = 1/2 корисний в ЯМР. Точність атомної маси селену, 78,96+0,03, обмежена двома знаками після коми через зміну складу його ізотопів. Серед багатьох алотропів селену так званий червоний селен є молекулою Se 8 з короноподібною структурою і розчинний в CS 2. Сірий металевий селен - це полімер з гвинтоподібною структурою. Чорний селен, який є складним полімером, також в достатку.
Телур також має вісім стабільних ізотопів і атомну масу 127,60+0,03. 130 Te (33,8%) і 128 Te (31,7%) є найбільш поширеними ізотопами, а 125 Te і 123 Te з I = 1/2 можуть бути використані в ЯМР. Існує лише одна кристалічна форма телуру, яка представляє собою спірально-ланцюговий полімер, який показує електропровідність.
(b) Багатоатомні катіони халькогену та аніони
Хоча вже давно визнано, що розчини елементів халькогену в сірчаній кислоті демонстрували красиві сині, червоні та жовті кольори, полікатіонні види, що породжують ці кольори, S 4 2+, S 6 2+, S 6 4+, S 8 2+, S 10 2+, S 19 2+ або інші атоми халькогену були виділені реакцією з AsF 5 тощо та визначені їх структури. Наприклад, на відміну від нейтрального S 8, S 8 2+ приймає циклічну структуру, яка має слабку сполучну взаємодію між двома трансколцевих атомами сірки (рис.\(\PageIndex{18}\)).
З іншого боку, солі лужних металів Na 2 S 2, K 2 S 5 і сіль лужноземельних металів BaS 3, сіль перехідного металу [Mo 2 (S 2) 6] 2-, комплекс Cp 2 W (S 4) і т. д. синтезовані полісульфідні аніони S x 2- (x = 1-6), в яких атоми сірки пов'язані взаємно і визначено їх структури. Як видно з того факту, що елементарна сірка сама утворює молекули S 8, сірка, на відміну від кисню, має тенденцію до катенату. Тому можливе утворення полісульфідних іонів, в яких пов'язано багато атомів сірки, і фактично синтезований ряд полісульфанів H 2 S x (x = 2-8).
(c) Сульфіди металів
Стратифіковані дисульфіди, MS 2, важливі в сульфідах перехідних металів. Вони показують два типи конструкцій. Один має метал у трикутному призматичному координаційному середовищі, а інший має метал у середовищі восьмигранної координації.
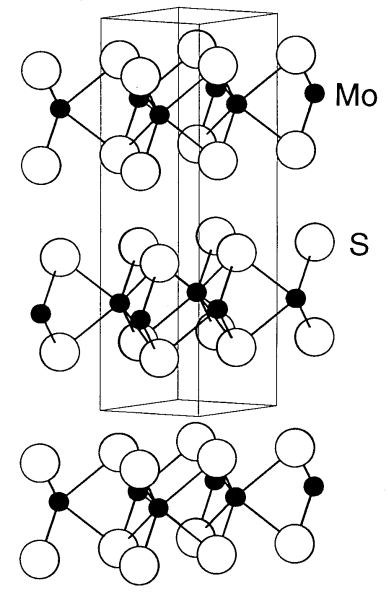
MoS 2 є найбільш стабільною чорною сполукою серед сульфідів молібдену. Полінг визначив структуру MoS 2 в 1923 році. Конструкція побудована шляхом ламінування двох шарів сірки, між якими інтеркалюється шар молібдену (рис.\(\PageIndex{19}\)). Як варіант, укладають два шари сірки і між ними вставляють шар молібдену. Тому координаційним середовищем кожного молібдену є трикутна призма атомів сірки. Оскільки між шарами сірки немає зв'язуючої взаємодії, вони можуть легко ковзати, в результаті чого утворюється графітоподібна мастильна здатність. MoS 2 використовується як тверда мастило, що додається в бензин, а також як каталізатор реакцій гідрування.
ZrS 2, TaS 2 тощо приймають структуру типу CDi 2, що містить атоми металів у восьмигранному координаційному середовищі, побудованому атомами сірки.
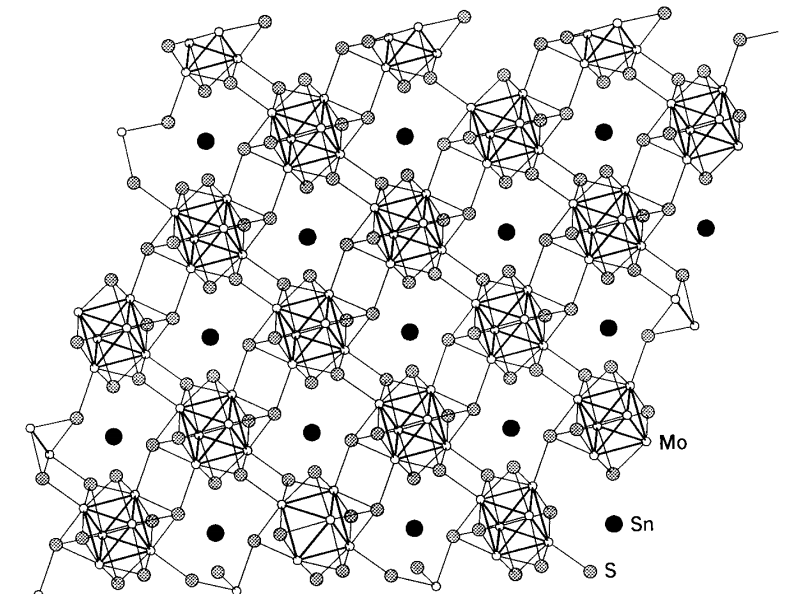
Фазові з'єднання Chevrel
Існують надпровідні сполуки, звані фазами Chevrel, які є важливими прикладами халькогенідних сполук молібдену. загальна формула описується M x Mo 6 X 8 (M = Pb, Sn і Cu; X = S, Se, і Te), а шість атомів молібдену утворюють регулярний октаедричне скупчення, а вісім халькогенідних атомів закривають вісім трикутних граней скупчення. Блоки кластера з'єднуються 3-мірно (рис.\(\PageIndex{20}\)). Оскільки кластерна структура атомів молібдену аналогічна структурі дихлориду молібдену, MoCl 2, (= (Mo 6 Cl 8) Cl 2 Cl 4 /2), структурна хімія цих сполук привернула стільки ж уваги, скільки і їх фізичні властивості.