6.4: Кристалічні структури металів
- Page ID
- 19853
Кристалічна природа металів
Всі металеві елементи (крім Cs, Ga і Hg) є кристалічними твердими речовинами при кімнатній температурі. Як і іонні тверді речовини, метали та сплави мають дуже сильну тенденцію до кристалізації, незалежно від того, виготовлені вони термічною обробкою або іншими методами, такими як зменшення розчину або гальванічне покриття. Метали легко кристалізуються і важко сформувати склоподібний метал навіть при дуже швидкому охолодженні. Розплавлені метали мають низьку в'язкість, і ідентичні (по суті сферичні) атоми можуть дуже легко упакувати в кристал. Склоподібні метали можуть бути виготовлені, однак, шляхом швидкого охолодження сплавів, особливо якщо складові атоми мають різні розміри. Різні атоми не можуть упакувати в просту одиничну клітинку, іноді роблячи кристалізацію досить повільною, щоб утворити скло.
|
Кубічний кубічний |
|
hcp (ліворуч) і fcc (праворуч) тісна упаковка сфер |
Кристалічні структури
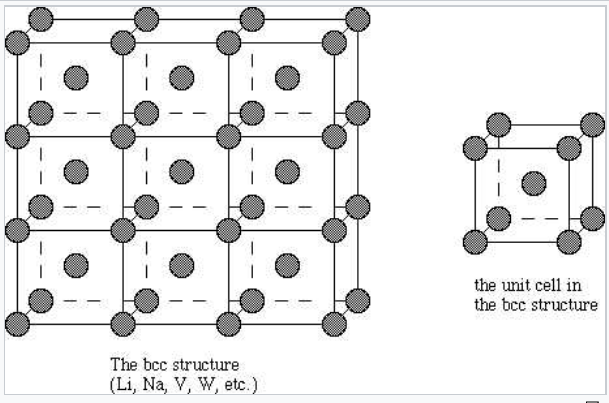
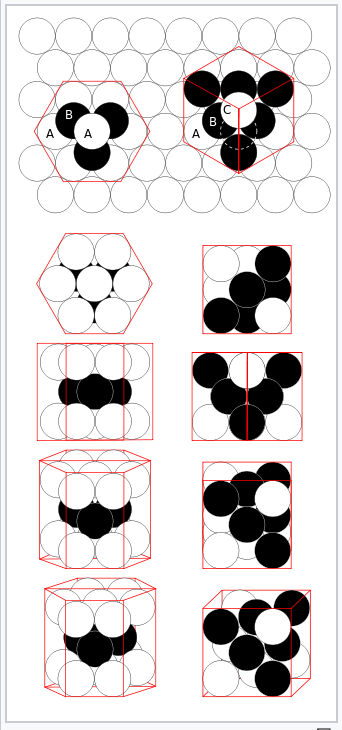
Більшість металів і сплавів кристалізуються в одній з трьох дуже поширених структур: кубічна кубічна (ОЦК), гексагональна близько упакована (hcp), або кубічна близько упакована (ccp, також називається кубічним центром обличчя, fcc). У всіх трьох структурах координаційне число атомів металу (тобто кількість рівновіддалених найближчих сусідів) досить велике: 8 для ОЦК, і 12 для hcp і ccp. Ми можемо протиставити це з низькими координаційними числами (тобто низькими валентностями - як 2 для O, 3 для N або 4 для C), знайденими в неметалах. У структурі bcc найближчі сусіди знаходяться по кутах куба, що оточує атом металу в центрі. У структурах hcp та ccp атоми упаковуються, як складені гарматні ядра або більярдні кулі, шарами з шестикоординатним розташуванням. У кожного атома також є ще шість найближчих сусідів з шарів зверху і знизу. Послідовність укладання - ABCABC... у решітці ccp та ABAB... у hcp. В обох випадках можна показати, що сфери заповнюють 74% обсягу решітки. Це найвища об'ємна частка, яку можна заповнити гратами рівних сфер.
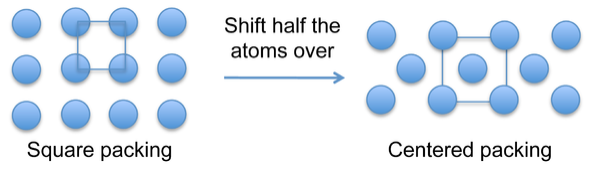
Атоми в металевих кристалах мають тенденцію упаковувати в щільні композиції, які ефективно заповнюють простір. Проста квадратна упаковка (вище), на якій базується проста кубічна структура, неефективна і, отже, рідкісна серед металевих кристалічних структур. Конструкції, орієнтовані на тіло або обличчя, заповнюють простір ефективніше і більш поширене.
Періодичні тенденції структури та металевої поведінки
Згадайте, де ми знаходимо металеві елементи в таблиці Менделєєва - скрізь, крім правого верхнього кута. Це означає, що коли ми йдемо вниз по групі в р-блоці (скажімо, група IVA, група вуглецю або група VA, група азоту), властивості елементів поступово змінюються від неметалів до металоїдів до металів. Вуглецева група красиво ілюструє перехід. Починаючи з верхньої частини, елемент карбон має два стійких аллотропа - графітовий і алмазний. У кожному з них валентність атомів вуглецю точно задовольняється шляхом створення чотирьох електронних парних зв'язків з сусідніми атомами. У графіті кожен вуглець має трьох найближчих сусідів, і тому є дві одинарні зв'язки і одна подвійна зв'язок. У діаманті є чотири найближчих сусідів, розташованих у вершині тетраедра, і тому існує єдиний зв'язок до кожного з них.
Два елементи прямо під вуглецем (кремній і германій) в таблиці Менделєєва також мають алмазну структуру (нагадаємо, що ці елементи не можуть легко зробити подвійні зв'язки з собою, тому графітовий алотроп для Si або Ge не існує). Хоча алмаз є хорошим ізолятором, і кремній, і германій є напівпровідниками (тобто металоїдами). Механічно вони тверді, як алмаз. Як і вуглець, кожен атом Si і Ge задовольняє свою валентність чотирьох, роблячи поодинокі зв'язки чотирма найближчими сусідами.
Наступний елемент під германієм - олово (Sn). Олово має два алотропи, один з алмазною структурою, а один зі злегка спотвореною структурою ОЦК. Останній має металеві властивості (металевий блиск, податливість), а провідність приблизно в 10 9 разів вище, ніж Si. Нарешті, свинець (Pb), елемент під Sn, має структуру ccp, а також є металевим. Відзначимо тенденції в координаційному числі і провідні властивості:
| Елемент | Структура | Корд. немає. | Провідність |
|---|---|---|---|
| C | графіт, алмаз | 3, 4 | напівметалеві, ізолятор |
| СІ | алмаз | 4 | напівпровідниковий |
| Ге | алмаз | 4 | напівпровідниковий |
| Сн | алмаз, спотворений ОЦК | 4, 8 | напівпровідник, метал |
| Пб | ккп | 12 | метал |

Елементи C, Si і Ge підкоряються правилу октету, і ми можемо легко ідентифікувати зв'язки електронної пари в їх структурах. Sn і Pb, з іншого боку, приймають структури з високими координаційними числами. Їм не вистачає валентних електронів, щоб зробити електронно-парні зв'язки з кожним сусідом (це загальна риса металів). Що відбувається в цьому випадку, так це те, що валентні електрони стають «розмазаними» або делокалізованими над усіма атомами в кристалі. Найкраще думати про зв'язок в металах як про кристалічному розташуванні позитивно заряджених сердечників з «морем» спільних валентних електронів, що склеюють структуру між собою. Оскільки електрони не локалізуються в якомусь конкретному зв'язку між атомами, вони можуть рухатися в електричному полі, тому метали добре проводять електрику. Ще один спосіб опису зв'язку в металах - ненаправлений. Тобто найближчі сусіди атома оточують його у всіх напрямках, а не в декількох конкретних напрямках (як у кутах тетраедра, як ми знайшли для алмазу). Неметали (ізолятори та напівпровідники), з іншого боку, мають спрямоване з'єднання. Оскільки склеювання ненаправлене, а координаційні числа високі, відносно легко деформувати координаційну сферу (тобто розірвати або розтягнути зв'язки), ніж у випадку з неметалом. Ось чому такі елементи, як Pb, набагато більш податливі, ніж C, Si або Ge.