2.11: Ланцюги та кільця π-сполучених систем
- Page ID
- 19960
 Етилен: π система аналогічна π-склеюванню в Н 2
Етилен: π система аналогічна π-склеюванню в Н 2
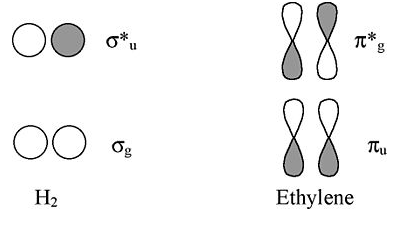
Розглядаючи зверху або знизу, етиленові π-орбіталі виглядають як орбіталі H 2 σ. Таким чином, ми можемо відображати рішення з ланцюгів і кілець атомів Н на ланцюги і кільця π-орбіталів (як ми це робили для триорбітального випадку O 3).
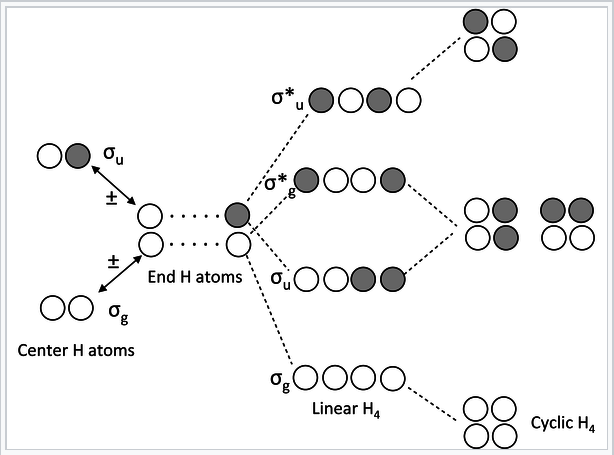
Ланцюги і кільця чотирьох атомів Н або π-орбіталів (H 4 або бутадієн):
|
Діаграма МО для Н4 або бутадієну |
Кілька приміток про цю діаграму МО:
- У лінійній формі молекули комбінація AoS утворює сходи рівномірно розташованих енергетичних рівнів, які чергують g — u — g — u — u... Кожна наступна орбітальна має ще один вузол. Це загальне правило для лінійних ланцюгів σ або π орбіталей з парними числами атомів.
- У циклічній формі молекули є одна невироджена орбіталь внизу, одна вгорі, а між ними - сходи подвійно вироджених орбіталів. Це також загальне правило для циклічних молекул з парними числами атомів. Це походження правила 4n+2 для ароматичних речовин.
- Н 4 має чотири валентних електрона, а за аналогією бутадієн має чотири π-електрона. Ці електрони заповнюють найнижчі два MoS в лінійній формі молекули, що відповідають двом кон'югованим π-зв'язкам в бутадієні (H 2 C = CH-CH=CH 2).
- У циклічній формі молекули вироджені орбіталі займають поодиноко. Молекула може порушити виродження (і знизити її енергію) шляхом спотворення до зім'ятого прямокутника. Це загальне правило для антиароматичних циклічних молекул (правило 4n). Таким чином, циклобутадієн повинен бути антиароматичним і мати дві одинарні та дві подвійні зв'язки, які не делокалізовані резонансом.
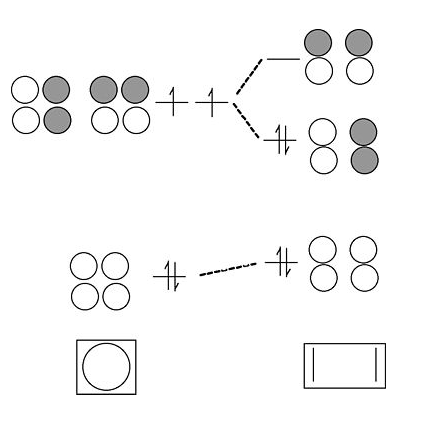
Циклобутадієн насправді є дуже нестійкою молекулою, оскільки він полімеризується, щоб зняти кільцеве напруження. Стерильно ускладнені похідні молекули мають зірвану прямокутну структуру, передбачену теорією МО.
Бензол π-орбіталі:
Як ми отримаємо від ланцюга 4 атомів до 6 атомів?
За аналогією з процесом, який ми використовували для переходу від 2-атомного ланцюга до ланцюга 4 атомів, тепер ми переходимо від 4 до 6. Почнемо з орбіталей 4-атомного ланцюга, які утворюють сходи з g і u орбіталей. Потім ми робимо g і u комбінації двох атомів, які ми додаємо на кінцях. Об'єднавши г з g і u з u, ми закінчуємо розв'язками для рядка з 6 атомів. Закриття цих орбіталів у петлю дає нам π молекулярні орбіталі молекули бензолу. Результат - три π зв'язку, як ми і очікували. Бензол відповідає правилу 4n+2 (n = 2) і тому є ароматичним.
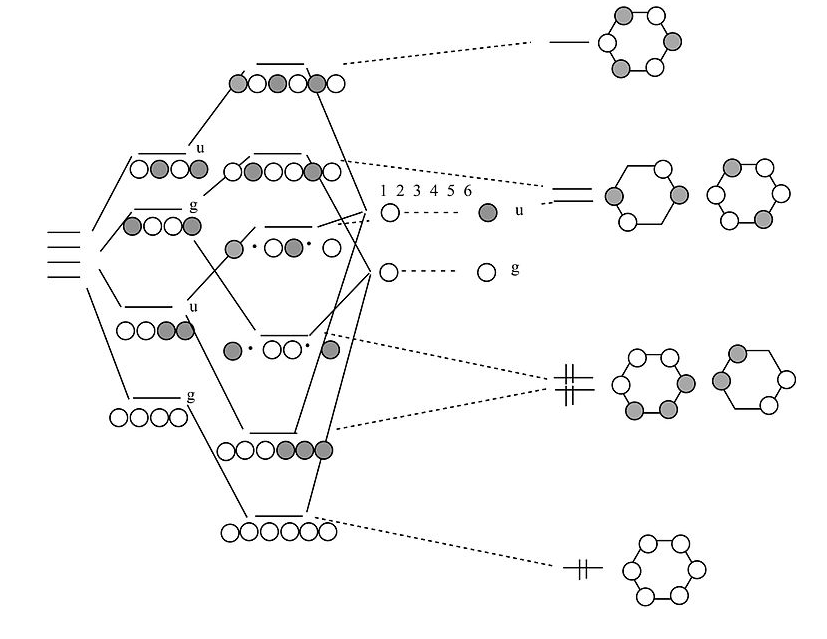
Тут ми використовували ізоглобальну аналогію для побудови діаграм МО для π-зв'язаних систем, таких як етилен і бензол, з комбінацій s-орбіталів. Виникає цікаве питання про те, чи може ароматичне правило 4n+2 застосовуватися до s-орбітальних систем, тобто якби три молекули H 2 могли зібратися разом, утворюючи ароматичну молекулу H 6. Насправді останні дослідження водню під надвисокими тисками в клітині алмазної ковадла показують, що такі структури дійсно утворюються. Існує тверда воднева фаза, яка містить аркуші спотворених шестичленних кілець, аналог повністю з'єднаної 2D-мережі шестичленних кілець, знайдених у графіті або графені. [6]
Тепер повинно бути видно з нашої побудови діаграм МО для чотирьох- і шестиорбітальних молекул, що ми можемо продовжувати додавати атомні орбіталі, щоб зробити ланцюги та кільця з 8, 10, 12... атомів. У кожному конкретному випадку орбіталі g і u утворюють сходи з MoS. На нижній сходинці драбини ланцюга N-атома в МО немає вузлів, і додаємо по одному вузлу на кожну сходинку, поки не дійдемо до вершини, де є N-1 вузли. Інший спосіб сказати це полягає в тому, що довжина хвилі електрона в орбіталі х, рахуючи знизу (1,2,3... x,... N), становить 2Na/x, де a - відстань між атомами. У розділах 6 і 10 ми знайдемо, що ми можемо багато чого дізнатися про електронні властивості металів та напівпровідників з цієї моделі, використовуючи нескінченний ланцюг атомів як модель для кристала.