8.14.8: Хімія криптону (Z = 36)
- Page ID
- 33545
Криптон є одним з шести елементів Noble Gas (Група 18), які широко відомі своєю відносною «інертністю» і труднощами в утворенні хімічних сполук з будь-якими іншими елементами, завдяки цим елементам, що мають повноцінні валентні оболонки. Однак, всупереч оригінальному мисленню, Криптон був змушений реагувати з сильно електронегативними елементами і використовується в освітленні та інших комерційних цілях.
Факти
-
- Номер елемента: 36

- Конфігурація електронів: [Ar] 3d 10 4s 2 4p 6
- Атомна вага: 83,798 г/моль
- Колір: безбарвний, без запаху, без смаку
- Світло: велика кількість спектральних ліній, найсильнішими є зелений і жовтий/білуватий випромінювання
- Твердість: біла та кристалічна/гранічно-центрована кубічна кристалічна структура
- Точка плавлення: 115,79K
- Точка кипіння: 119,92K
- Критична точка: 209,41К
- Питома теплоємність: 20.786 Дж/моль К
- 0.000108-0.000114% атмосферних
- 6 Стабільні ізотопи
- Виробляється шляхом розпаду урану і плутонію в земній корі при дуже малому%

- Номер елемента: 36
Походження та історія
Криптон знаходиться в групі 18 елементів, інакше відомих як благородні гази. У 1785 році Генрі Кавендіш припустив, що повітря містило нереактивні гази після того, як йому не вдалося отримати зразок повітря для реакції. Через століття британські хіміки Джон Релі і Вільям Ремсі почали виділяти ці інертні гази (починаючи з аргону) і відокремлювали їх у власній групі на таблиці Менделєєва, оскільки кожен з цих елементів мав повну електронну валентність оболонок. Один з таких газів, Криптон, був виявлений разом з неоном і ксеноном Релеєм і колегом-хіміком Моррісом Траверсом в 1898 році в залишку, що залишився від випаровування майже всіх компонентів рідкого повітря. Назва Криптон походить від грецького слова «kryptos», що означає «прихований». Однак інертна якість цих газів було спростовано, коли в 1962 році були створені сполуки ксенону, а через рік успішно синтезовано з'єднання криптону (KrF2). Це довело, що дана група газів не обов'язково інертна. Хоча і Kr, і Xe мають повні валентні оболонки, вони обидва найбільш легко іонізуються з групи. Просто знадобився елемент високої електронегативності, в даному випадку фтор, щоб змусити Xe і Kr реагувати при високих температурах.
Ізоляція
Він займає шосте місце за достатком в атмосфері. Як і інші благородні гази, криптон виділяється з повітря шляхом зрідження.
З'єднання та ізотопи
Хоча Криптон, природно, хімічно нереактивний, дифторид криптону був синтезований в 1963 році.
\[Kr_{(g)}+F_{2(g)} \rightarrow KrF_{2(g)}\]
It has also been discovered that Krypton can bond with other atoms besides Fluorine, however such compounds are much more unstable than krypton difluoride. For example, KrF2 can bond with nitrogen when it reacts with [HC≡NH]+[AsF−6] under -50°C to form [HC≡N–Kr–F]+. There have been other reports of successfully synthesizing additional Krypton compounds, but none have been verified. Krypton has 6 stable isotopes: 78Kr, 80Kr, 82Kr, 83Kr, 84Kr, and 86Kr. There are a total of 31 isotopes of Krypton, and the only isotope besides the six given that occur naturally is 81Kr which is a product of atmospheric reactions between the other natural isotopes.
Applications
Krypton gas is used in various kinds of lights, from small bright flashlight bulbs to special strobe lights for airport runways. Due to Krypton's large number of spectral lines, it's ionized gas is white, which is why light bulbs that are krypton based are used in photography and studio lighting in the film industry. In neon lights, Krypton reacts with other gases to produce a bright yellow light as well. The isotope 85Kr can also be used in combination with phosphors to produce materials that shine in the dark due to the fact that this particular isotope of Krypton reflects off of phosphors. Krypton is also used in lasers as a control for a desired wavelength, especially in red lasers because Krypton has a much higher light density in the red spectral region than other gases such as Neon, which is why krypton-based lasers are used to produce red light in laser-light shows.
Perhaps one of the most significant uses of Krypton is in the krypton-fluoride laser which is used in nuclear fusion energy research.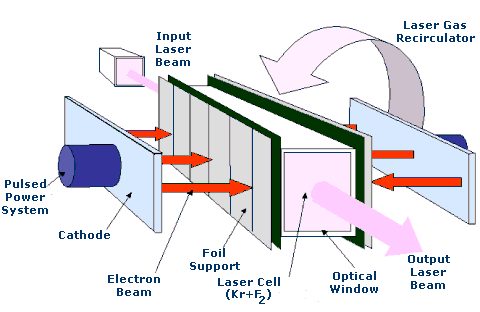
Ізотопи криптону
Ще одне важливе застосування Криптона, зокрема 83 Kr, - це магнітно-резонансна томографія (МРТ), яка використовується замість інших газів через його високий спін і менше/менш полярну електронну хмару порівняно з іншими благородними газами, такими як ксенон. Застосовується для розрізнення гідрофобних і гідрофільних областей, що містять дихальні шляхи.
У 1960 році була укладена міжнародна угода про основу довжини метра на довжині хвилі світла, випромінюваного 86 Кр (605,78 нм). Однак це було змінено в 1983 році, коли Міжнародне бюро ваг та заходів визначило метр як відстань, яку світло рухається у вакуумі за 1/299 792,458 с.Проблеми
- Як виділяється елемент Криптон?
- Чому фтор може реагувати з Криптоном з утворенням сполуки?
- Що таке електронна конфігурація Криптона?
- Які кольори найбільш виражені в спектральному випромінюванні Криптона?
- Скільки існує стабільних ізотопів Криптона?
Рішення
- Шляхом випаровування компонентів рідкого повітря.
- Оскільки фтор є високоелектронегативним, а Криптон легко іонізується.
- [Ар] 3d 10 4s 2 4р 6
- Зелений і жовтий
- 6
Посилання
- Ньютон, Девід Е. Хімічні елементи: від вуглецю до криптону 2.2 і тому. Детріот, Мічиган: UXL, 1999. Друк.
- Кодд, Сара Л., і Джозеф Д. Сеймур. Магнітно-резонансна мікроскопія: просторово вирішені методи та програми ЯМР. Бозман, Монтана: Вілі, Джон & сини, включений, 2009. Друк.
- Сайкс, А.Г. Досягнення в галузі неорганічної хімії. Сан-Дієго, Каліфорнія: Академічна преса, 1999. Друк.
Автори та атрибуція
- Меган Медоус (UCD)