8.11.3: Хімія сірки (Z = 16)
- Page ID
- 33472
Цілі навчання
- Опишіть хімію кисневої групи.
- Надають тренду різні властивості.
- Запам'ятайте назви елементів групи 16.
- Поясніть процес Фреша.
- Опишіть властивості та застосування\(\mathrm{H_2SO_4}\).
- Поясніть властивості та застосування\(\mathrm{H_2S}\).
Сірка - це хімічний елемент, який представлений хімічним символом «S» і атомним номером 16 в таблиці Менделєєва. Оскільки вона становить 0,0384% земної кори, сірка є сімнадцятим найпоширенішим елементом після стронцію. Сірка також набуває багатьох форм, які включають елементарну сірку, органо-сірчані сполуки в нафті та вугіллі, H 2 S (g) у природному газі та мінеральні сульфіди та сульфати. Цей елемент витягується за допомогою процесу Фреша (розглянутого нижче), методу, коли перегріта вода та стиснене повітря використовуються для витягування рідкої сірки на поверхню. Офшорні сайти, Техас та Луїзіана є основними ділянками, які дають велику кількість елементарної сірки. Однак елементарна сірка також може бути отримана шляхом зменшення H 2 S, зазвичай зустрічається в нафті та природному газі. Здебільшого, однак, сірка використовується для отримання SO 2 (g) і H 2 SO 4.
Відома з давніх часів (згадується в єврейських писаннях як сірка) сірка була класифікована як елемент в 1777 році Лавуазьє. Чиста сірка позбавлена смаку і запаху зі світло-жовтим кольором. Зразки сірки, часто зустрічаються в лабораторії, мають помітний запах. Сірка - десятий найпоширеніший елемент у відомому Всесвіті.
| Атомний номер | 16 |
| Атомний символ | S |
| Атомна вага | 32.07 грам на моль |
| Структура | орторомбічний |
| Фаза при кімнатній температурі | твердий |
| Класифікація | неметалічні |
Фізичні властивості сірки
Сірка має атомарну масу 32.066 грам на моль і входить до групи 16, сімейства кисню. Він є неметалом і має питому теплоємність 0,706 Дж г -1 о С -1. Спорідненість електронів 200 кДж моль -1 і електронегативність 2,58 (безодинична). Сірка зазвичай зустрічається у вигляді світло-жовтого, непрозорого та крихкого твердого речовини у великій кількості дрібних орторомбічних кристалів. Сірка не тільки має вдвічі більшу щільність води, вона також не розчиняється у воді. З іншого боку, сірка добре розчинна в сірковуглецевому сірку і слабо розчинна у багатьох поширених розчинниках. Сірка також може відрізнятися за кольором і чорніє при кип'ятінні через вуглецевих домішок. Навіть лише 0,05% вуглецевої речовини значно темніє сірку.
Більшість сірки відновлюється безпосередньо як елемент з підземних родовищ шляхом впорскування перегрітої води і трубопроводу розплавленої сірки (сірка плавиться при 112 o С). У порівнянні з іншими елементами сірка має найбільше аллотропів. Хоча кільце S 8 є найпоширенішим алотропом, існує 6 інших структур з до 20 атомів сірки на кільце.
- У відповідних умовах пари сірки можуть містити\(S\),\(S_2\),\(S_4\),\(S_6\), і\(S_8\).
- При кімнатній температурі ромбічна сірка (S α) є стабільною твердою речовиною, що складається з циклічних\(S_8\) молекул.
- При 95,5° С ромбічна сірка стає моноклінною сіркою (S β). Кристалічна структура, виявлена в моноклінній сірці, відрізняється від структури ромбічної сірки. Моноклінна сірка також складається з\(S_8\) молекул.
- Моноклінна сірка стає рідкою сіркою (S λ) при 119° C. рідка сірка - рідина солом'яного кольору, що складається з\(S_8\) молекул та інших циклічних молекул, що містять діапазон від шести до двадцяти атомів.
- При 160 о С це стає темною в'язкою рідиною під назвою Рідка сірка (S μ). Молекули все ще складаються з восьми атомів сірки, але молекула відкривається і перетворюється з кола в довгу молекулу спірального ланцюга.
- При 180° C довжина ланцюга і в'язкість досягають свого максимуму. Ланцюги розриваються і в'язкість зменшується при температурах, що перевищують 180° C.
- Пари сірки утворюються, коли рідина закипає при 445° C. в парі, що утворюється,\(S_8\) молекули домінують, але коли пара продовжує нагріватися, молекули розпадаються на менші групи сірки.
- Щоб отримати пластичну сірку, Сіс заливають холодною водою. Пластична сірка гумоподібна і складається з довгих спірально-ланцюгових молекул. Якщо пластична сірка сидить довго, вона знову перетвориться на ромбічну сірку.
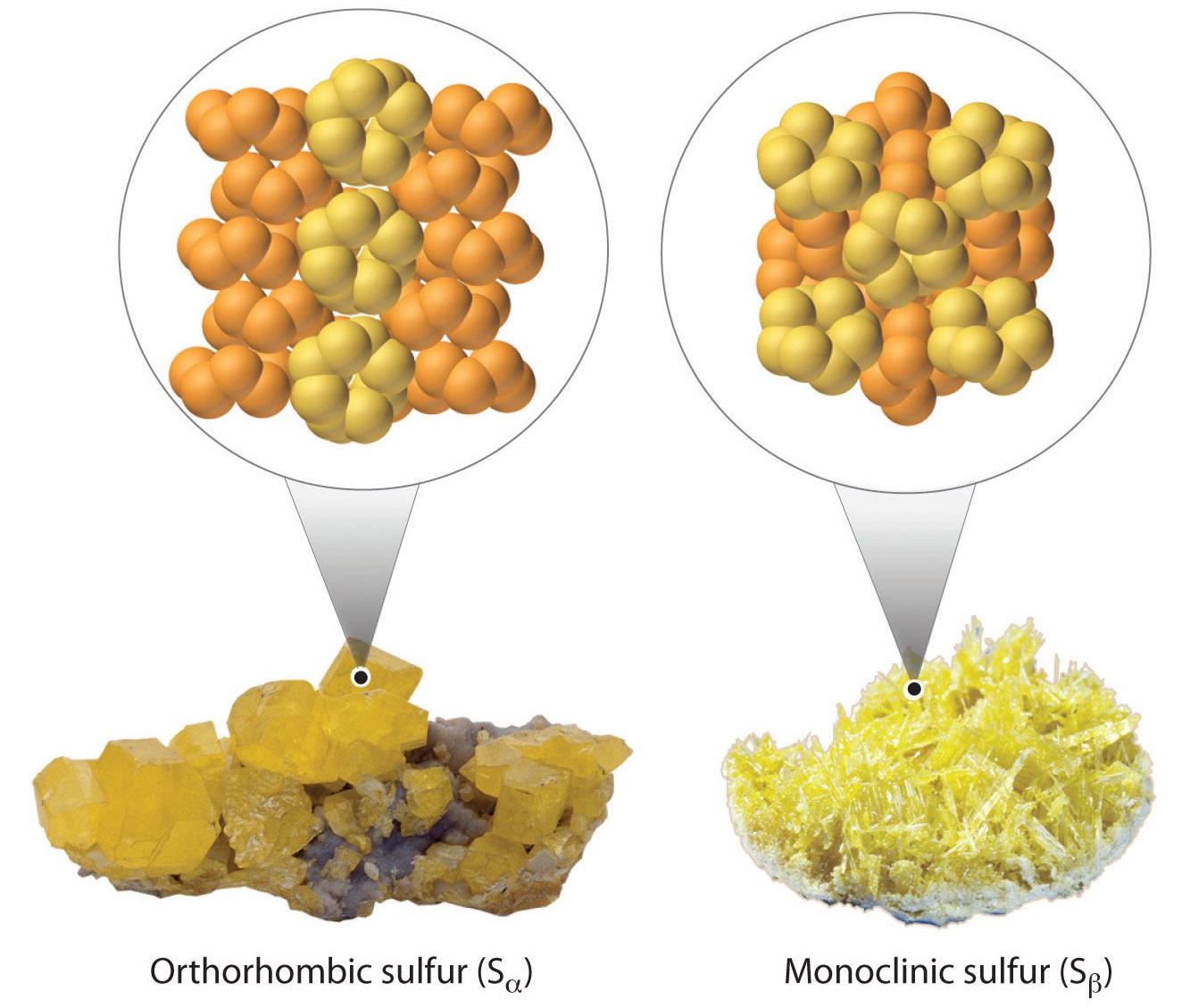
Хоча кисень має менше аллотропів, ніж сірка\(\ce{O}\), включаючи\(\ce{O_2}\),\(\ce{O_3}\),\(\ce{O_4}\),,\(\ce{O_8}\),, металеві\(\ce{O}\) (і чотири інші тверді фази), багато хто з них насправді мають відповідний варіант сірки. Однак сірка має більшу схильність до катенату (т зчеплення атомів одного і того ж елемента в більш довгі ланцюги). Ось значення ентальпій одинарного і подвійного зв'язку:
\[\begin{array}{c|r} \ce {O-O} & \ce{142\ kJ/mol} \\ \ce {S–S} & \ce{268\ kJ/mol} \\ \ce {O=O} & \ce{499\ kJ/mol} \\ \ce {S=S} & \ce{352\ kJ/mol} \\ \end{array}\]
Це означає, що\(\ce{O=O}\) сильніше\(\ce{S=S}\), в той час як\(\ce{O–O}\) слабкіше ніж\(\ce{S–S}\). Так, в сірці сприятливі поодинокі зв'язки і катенація легше, ніж в з'єднаннях кисню. Здається, що причина слабших\(\ce{S=S}\) подвійних зв'язків має своє коріння в розмірі атома: двом атомам важче прийти на досить невелику відстань, так що\(p\) орбіталі перекриваються мало, а\(\pi\) зв'язок слабкий. Це підтверджується поглядом вниз по таблиці Менделєєва:\(\ce{Se=Se}\) має ще слабшу ентальпію зв'язку\(\ce{272 kJ/mol}\).
Що відбувається, коли тверда сірка плавиться? \(\ce{S8}\)Молекули розпадаються. При раптовому охолодженні в пластиковій сірці утворюються молекули з довгим ланцюгом, які поводяться як гума. Пластична сірка з часом перетворюється в ромбічну сірку.
сполуки
Читаючи наступні реакції, з'ясувати і помітити зміну ступеня окислення\(\ce{S}\) в реагентах і продуктах. Загальні ступені окислення сірки складають -2, 0, +4 і +6. Сірка (сірка, камінь, який горить) вступає в реакцію з\(\ce{O2}\) наданням блакитного полум'я (рис.\(\PageIndex{1}\)):
\[\ce{S + O_2 \rightarrow SO_2}\]
\(\ce{SO2}\)виробляється всякий раз, коли сульфід металу окислюється. Він відновлюється і окислюється далі, щоб дати\(\mathrm{SO_3}\), для виробництва\(\mathrm{H_2SO_4}\). \(\mathrm{SO_2}\)реагує\(\mathrm{H_2S}\) з формою\(\mathrm{H_2O}\) і\(\ce{S}\).
\[\mathrm{2 SO_2 + O_2 \rightleftharpoons 2 SO_3}\]
\[\mathrm{SO_3 + H_2O \rightleftharpoons H_2SO_4} \;\;(\text{a valuable commodity})\]
\[\mathrm{SO_3 + H_2SO_4 \rightleftharpoons H_2S_2O_7} \;\;\; (\text{pyrosulfuric acid})\]
Сірка реагує з сульфітними іонами в розчині з утворенням тіосульфату,
\[\ce{S + SO_3^{2-} -> S_2O_3^{2-}}\]
але реакція зворотна в кислому розчині.
Оксиди
Існує багато різних стабільних оксидів сірки, але два, які зазвичай зустрічаються, - діоксид сірки та триоксид сірки. Діоксид сірки - це часто зустрічається оксид сірки. Це безбарвний, їдкий і негорючий газ. Він має щільність 2,8 кг/м 3 і температуру плавлення -72,5 o С. Оскільки органічні матеріали більш розчинні,\(SO_2\) ніж у воді, рідка форма є хорошим розчинником. \(SO_2\)в першу чергу використовується для виробництва\(SO_3\). Пряме згоряння сірки і випал сульфідів металів виходять\(SO_2\) через контактний процес:
\[\underbrace{S(s) + O_2(g) \rightarrow SO_2(g)}_{\text{Direct combustion}}\]
\[\underbrace{2 ZnS(s) + 3 O_2(g) \rightarrow 2 ZnO(s) + 2 SO_2(g)}_{\text{Roasting of metal sulfides}}\]
Тріоксид сірки - ще один із часто зустрічаються оксидів сірки. Являє собою безбарвну рідину з температурою плавлення 16,9 о С і щільністю кг/м 3. \(SO_3\)використовується для отримання сірчаної кислоти. \(SO_2\)використовується при синтезі\(SO_3\):
\[\underbrace{2 SO_2 (g) + O_2(g) \rightleftharpoons 2 SO_3(g)}_{\text{Exothermic, reversible reaction}}\]
Ця реакція потребує каталізатора,\(V_2O_5\) який повинен бути завершений за розумний проміжок часу з найбільш часто використовуваним каталізатором.
Сірководень H 2 S
- Сірководень,\(\ce{H2S}\) є дипротовою кислотою. Рівноваги, наведені нижче,\[\mathrm{H_2S \rightleftharpoons HS^- + H^+}\]\[\mathrm{HS^- \rightleftharpoons S^{2-} + H^+}\] були розглянуті у зв'язку з поліпротовими кислотами.
Інші сполуки, що містять сірки
Мабуть, найбільш значущим з'єднанням сірки, що використовується в сучасних індустріально розвинених суспільствах, є сірчана кислота (\(H_2SO_4\)). Діоксид сірки (\(SO_2\)) знаходить практичне застосування при відбілюванні та охолодженні, але це також неприємний газ, що виникає в результаті спалювання сірчистого вугілля. Потім газ діоксиду сірки реагує з водяною парою в повітрі, утворюючи слабку кислоту, сірчисту кислоту (\(H_2SO_3\)), яка сприяє проблемі кислотного дощу.
- Сірчана кислота, H 2 SO 4, виробляється шляхом взаємодії\(SO_3\) з водою. Однак це часто призводить до проблем із забрудненням. SO 3 (g) вступає в реакцію з 98% H 2 SO 4 в вежах, повних керамічного матеріалу, щоб отримати H 2 S 2 O 7 або олеум. Вода циркулює у вежі для підтримки правильної концентрації, а кислота розбавляється водою в кінці, щоб отримати правильну концентрацію. Чиста сірчана кислота не має кольору і запаху, і це масляниста, гігроскопічна рідина. Однак пари сірчаної кислоти виробляють важкий білий дим і задушливий запах.
- Розбавлена сірчана кислота, H 2 SO 4 (aq) вступає в реакцію з металами і діє як сильна кислота в загальних хімічних реакціях. Застосовується для отримання Н 2 (g) і звільнення CO 2 (g) і може нейтралізувати міцні основи.
- Концентрована сірчана кислота H 2 SO 4 (конц.) має сильну спорідненість до води. У деяких випадках видаляє атоми Н і О. Концентрована сірчана кислота також є хорошим окислювачем і вступає в реакцію з деякими металами.
\[C_{12}H_{22}O_{11}(s) \rightarrow 12 C(s) + 11 H_2O(l)\]
(Концентрована сірчана кислота використовується в прямій реакції для видалення атомів H і O.)
Застосування сірчаної кислоти
- як сильна кислота для виготовлення\(\ce{HCl}\) і\(\mathrm{HNO_3}\).
- як окислювач металів.
- як зневоднюючий засіб.
- для виробництва добрив та інших товарів.
- Сірчиста кислота (H 2 SO 3) утворюється при\(SO_2\) (г) реагуванні з водою. Його не можна виділити в чистому вигляді, однак він утворює солі у вигляді сульфітів. Сульфіти можуть виступати як відновниками, так і окислювачами.
O 2 (g) + 2 SO 3 2 - (aq)\ правою стрілкою 2 SO 4 2 - (aq) (відновник)
2 Н 2 S (г) + 2 H + (aq) + SO 3 2 - (aq)\ права стрілка 3 Н 2 О (л) + 3 S (s) (окислювач)
H 2 SO 3 - це дипротова кислота, яка діє як слабка кислота в обох етапах, а H 2 SO 4 також є дипротовою кислотою, але діє як сильна кислота на першому етапі і слабка кислота на другому етапі. Такі кислоти, як NaHSO 3 і NaHSO 4, називаються кислотними солями, оскільки вони є продуктом першого кроку цих дипротових кислот.
Кип'ятіння елементарної сірки в розчині сульфіту натрію виходить тіосульфат. Не тільки тіосульфати важливі для фотографічної обробки, але вони також є загальними аналітичними реагентами, що використовуються з йодом (як у наступних двох реакціях).
\[2 Cu^{2+}_{(aq)} + 5 I^-_{(aq)} \rightarrow 2 CuI_{(s)} + I^-_{3(aq)} \]
\[I^-_{3(aq)} + 2 S_2O^{2-}_{3(aq)} \rightarrow 3 I^-_{(aq)} + S_4O^{2-}_{6(aq)}\]
з надлишком трийодидного іона титрують Na 2 S 2 O 3 (aq).
Крім сірчаної кислоти, мабуть, найбільш звичною сполукою сірки в хімічній лабораторії є погано пахне сірководень газ\(H_2S\), який пахне тухлими яйцями.
- Галогеніди сірки - це сполуки, що утворюються між сіркою і галогенами. Поширені сполуки включають SF 2, S 2 F 2, SF 4 та SF 6. У той час як SF 4 є потужним фторуючим агентом, SF 6 - це безбарвний, без запаху, нереактивний газ. Сполуки, утворені сіркою та хлоридом, включають S 2 Cl 2, ScL 4 та ScL 2. ScL 2 - це червона погано пахне рідина, яка використовується для отримання гірчичного газу (\( S(CH_2CH_2Cl)_2\)).
\[SCl_2 + 2CH_2CH_2 \rightarrow S(CH_2CH_2Cl)_2 \]
Виробництво -Frasch Процес
Сірку можна добувати за допомогою процесу Фреша. Цей процес зробив сірку хімічним товаром високої чистоти (до 99,9 відсотків чистого) хімічним товаром у великих кількостях. Більшість сірковмісних мінералів - це сульфіди металів, а найвідомішим, мабуть\(\mathrm{FeS_2}\), є пірит (відомий як дурне золото через його золотистого кольору). Найпоширенішим сульфатсодержащим мінералом є гіпс\(\mathrm{CaSO_4 \cdot 2H_2O}\), також відомий як штукатурка Парижа.
Процес Фреша заснований на тому, що сірка має порівняно низьку температуру плавлення. Процес змушує (99,5% чистої) сірки виходити за допомогою гарячої води та повітря. У цьому процесі перегріта вода витісняється по крайній з трьох концентричних труб. Стиснене повітря нагнітається по центральній трубі, і суміш елементарної сірки, гарячої води і повітря надходить вгору по середній трубі. Сірку розплавляють перегрітою водою (при 170° C під високим тиском) і виштовхують на поверхню землі у вигляді суспензії.
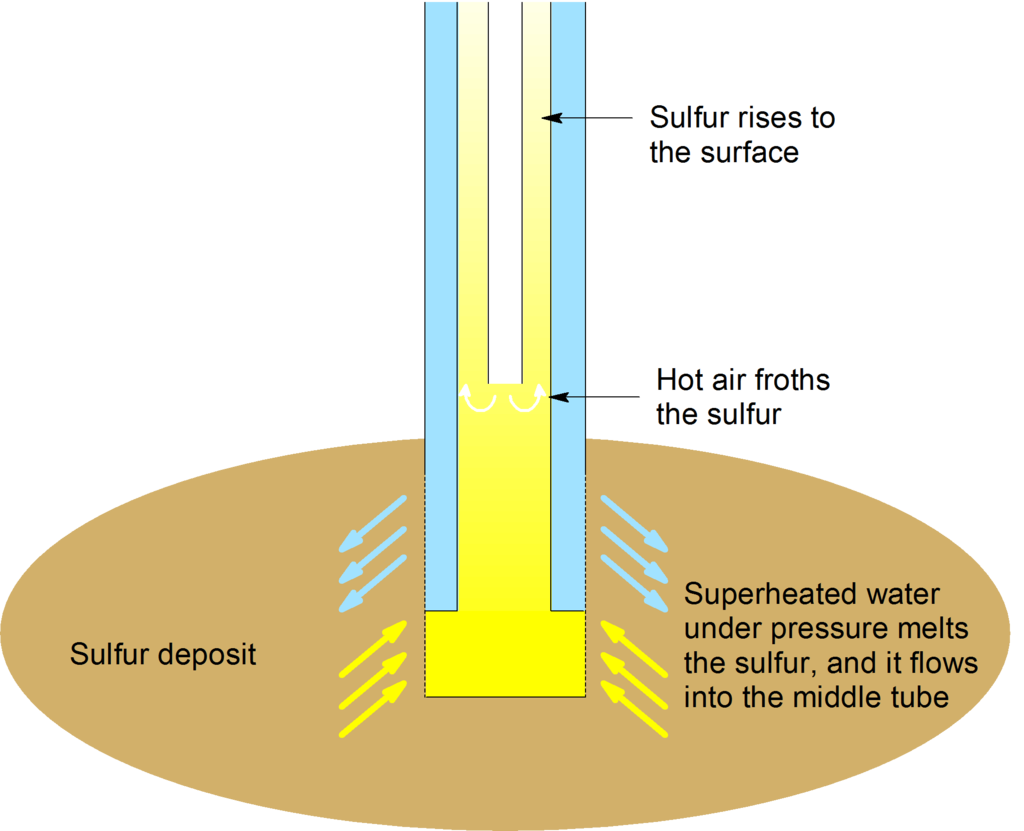
Сірка в основному використовується для виробництва сірчаної кислоти,\(\ce{H2SO4}\). Велика частина сірки, видобутої методом Фреша, використовується в промисловості для виготовлення сірчаної кислоти. Сірчана кислота, найбільш рясно виробляється хімічна речовина в США, виробляється контактним процесом. Велика частина (близько 70%) виробленої в світі сірчаної кислоти використовується в промисловості добрив. Сірчана кислота може виступати як сильною кислотою, зневоднюючим агентом, так і окислювачем. Його застосування використовують ці властивості. Сірка є необхідним елементом життєдіяльності в сірковмісних білках.
Додатки
Сірка має безліч практичних застосувань. Як фунгіцид сірка використовується для протидії парші яблуні в органічно вирощуваному виробництві яблук. Інші культури, які використовують сірчані фунгіциди, включають виноград, полуницю та багато овочів. В цілому сірка ефективна проти хвороб цвілі і чорної плямистості. Сірку можна використовувати і в якості органічного інсектициду. Сульфіти часто використовуються для відбілювання паперу та збереження сухофруктів.
Вулканізація гуми включає також використання сірки. Целофан і віскоза виробляються з сірковуглецем, продуктом сірки і метану. Сірчані сполуки також можна знайти в миючих засобах, лікуванні акне та агрохімікатах. Сульфат магнію (сіль епсома) має багато застосувань, починаючи від добавок для ванн до ексфоліантів. Сірка також все частіше використовується як добриво. Оскільки стандартна сірка гідрофобна, вона покривається поверхнево-активною речовиною бактеріями, перш ніж може статися окислення. Тому сірка є добривом з повільним вивільненням. Нарешті, сірка функціонує як світлогенеруюче середовище в сірчаних лампах.
Концентрована сірчана кислота колись була однією з найбільш вироблених хімічних речовин у Сполучених Штатах, більшість H 2 SO 4, яка зараз виробляється, використовується в добривах. Застосовується також в нафтопереробці, виробництві діоксиду титану, в аварійних джерелах живлення і автомобільних акумуляторах. Мінеральний гіпс дигідрат сульфату кальцію використовується при виготовленні штукатурки Парижа. Понад один мільйон тонн сульфату алюмінію виробляється щороку в Сполучених Штатах шляхом реагування H 2 SO 4 і Al 2 O 3. Це з'єднання має важливе значення при очищенні води. Мідний купорос використовується в гальванічних покриттях. Сульфіти використовуються в паперовій промисловості, оскільки вони виробляють речовину, яка покриває целюлозу словом і звільняє волокна деревини для обробки.
Викиди та навколишнє середовище
Частинки, SO 2 (g) і H 2 SO 4 туман є складовими промислового смогу. Оскільки електростанції спалюють вугілля або мазути з високим вмістом сірки, SO 2 (g) виділяється в повітря. При каталізації на поверхнях повітряних частинок SO 2 може окислюватися до SO 3. Реакція з NO 2 працює так само, як показано в наступній реакції:
\[ SO_{2(g)} + NO_{2(g)} \rightarrow SO_{3(g)} + NO_{(g)}\]
Потім утворюється туман H 2 SO 4 після того, як SO 3 реагує з водяною парою в повітрі. Якщо H 2 SO 4 реагує з повітряно-крапельним NH 3, (NH 4) 2 SO 4 виробляється. Коли SO 2 (g) і H 2 SO 4 досягають рівнів, що перевищують 0,10 проміле, вони потенційно шкідливі. Видаляючи сірку з палива та контролюючи викиди, кислотні дощі та промисловий смог можна тримати під контролем. Такі процеси, як спалювання киплячого шару, були представлені для видалення SO 2 з газів димових труб.
Зовнішні посилання
- Dhawale, S.W. «Тіосульфат: Цікавий оксоаніон сірки, який корисний як у медицині, так і в промисловості, але пов'язаний з корозії». Хім Дж. Едук. 1993, 70, 12.
- Лебовіц, Семюель Х. «Демонстраційна робоча модель процесу Фраша для видобутку сірки». Хім Дж. Едук. 1931, 8, 1630.
- Нагель, Міріам К. «Герман Фрасш, сірчаний король (ПРОФІЛІ)». Хім Дж. Едук. 1981, 58, 60.
- Рітміллер, Стівен. «Чарльз Х. Вінстон і Конфедеративна сірчана кислота». Хім Дж. Едук. 1995 72 575.
- Шарма, Б.Д. «Алотропи і поліморфи». Хім Дж. Едук. 1987, 64, 404.
- Сільверштейн, Тодд П.; Чжан, І. «Зневоднення цукру без сірчаної кислоти: більше немає задушливих випарів у класі!» Хім Дж. Едук. 1998 75 748.
- Тикоді, Р.Дж. «У хвалу тіосульфату». Хім Дж. Едук. 1990, 67, 146.
- Томас Джефферсон Національний акселератор Facility - Управління наукової освіти». Це елементарно-елементна сірка». Лабораторія Джефферсона.
- Електронна оболонка сірки
Посилання
- Petrucci, Ralph H. Загальна хімія, принципи та сучасні програми. Видавнича компанія Макміллан, дев'яте видання. Сторінка 930-937. Кархмер, Ю.Г.. Аналітична хімія сірки та її сполук. Нью-Йорк: Джон Вілі та сини, Inc., 1970.
Проблеми
- Намалюйте схему, яка підсумовує аллотропію сірки. Використовуйте символи, стрілки, і цифри.
- Безпосереднє спалювання сірки - єдиний спосіб отримання SO 2 (г). Правда чи брехня.
- Сульфіти не є окислювачами. Вони є хорошими відновниками. Правда чи брехня.
- Дайте реакцію на вироблення триоксиду сірки.
- Виберіть неправильне твердження.
- Сірка виробляє целофан і віскозу.
- Стандартна сірка гідрофобна.
- SO 2 може окислюватися до SO 3
- Сірка впливає на розвиток кислотних дощів і промислового смогу.
- Все вищесказане вірно.
- Яка реакція відповідає за руйнування вапнякових і мармурових статуй і будівель?
- \(\ce{CaCO3 \rightarrow CaO + CO2}\)
- \(\ce{SO2 + H2O \rightarrow H2SO3}\)
- \(\ce{BaO + CO2 \rightarrow BaCO3 \rightarrow BaSO3}\)при реакції з\(\ce{SO2}\)
- \(\ce{CaCO3 + H2O \rightarrow Ca(OH)2 + CO2}\)
- \(\ce{CaCO3 + SO2 \rightarrow CaSO3 + CO2 \rightarrow CaSO4}\)при окисленні
- Дайте формулу іона тіосульфату.
- Яка ступінь окислення\(\ce{S}\) в\(\ce{SF6}\),,\(\ce{H2SO4}\)\(\ce{NaHSO4}\),\(\ce{SO4^2-}\), і\(\ce{SO3}\)?
- Яка фаза сірки при 298 К? Введіть тип кристалів.
- Дайте назву процесу, за допомогою якого сірка витісняється з землі за допомогою гарячої води і повітря.
Рішення
- Схема може бути намальована будь-яким способом. Однак символи (S2), (S 4), (S 6), (S? ), і S 8 (g) повинні бути включені. Температури повинні бути написані поруч зі стрілками.
- Помилковий
- Помилковий
- \(2 SO_{2(g)} + O_{2(g)} \rightarrow 2 SO_{3(g)}\)
- A
- е
Розглянемо...
\(\ce{SO2}\)в\(\ce{H2SO3}\) це кислота в кислотних дощах, який атакує\(\ce{CaCO3}\), мармур. \(\ce{SO2}\)зменшує пігменти в органічній речовині - \(\ce{S2O3^2-}\)
Розглянемо...
Сульфат є\(\ce{SO4^2-}\);\(\ce{O}\) заміна ан\(\ce{S}\) дає тіосульфат\(\ce{S2O3^2-}\). Два\(\ce{S}\) в\(\ce{S2O3^2-}\) мають різні ступені окислення: один - +6, інший (-2), середній +2. - 6
Розглянемо...
Стан окислення для\(\ce{S}\)\(\ce{H2SO3}\) in,\(\ce{SO3^2-}\)\(\ce{SO2}\), і т.д. становить 4. Ступінь\(\ce{S}\) окислення однакова для всіх у списку. - ромбічна сірка
Розглянемо...
Термін ромбічний описує тип кристала. Моноклінна сірка метастабільна при 298 К. - Процес Фреша
Розглянемо...
Процес Фреша використовується для видобутку елементарної сірки.