8.11.2: Хімія кисню (Z = 8)
- Page ID
- 33454
Кисень - це елемент, який широко відомий широкій громадськості через велику роль, яку він відіграє у підтримці життя. Без кисню тварини не могли б дихати і, отже, загинули б. Кисень не тільки важливий для підтримки життя, але відіграє важливу роль у багатьох інших хімічних реакціях. Кисень є найпоширенішим елементом в земній корі і становить близько 20% повітря, яким ми дихаємо. Історично відкриття кисню як елемента, необхідного для горіння, стоїть в основі суперечки флогістона (див. Нижче).
Походження та історія
Кисень знаходиться в групі 16 елементів і розглядається як халькоген. Названий від грецьких генів oxys +, «кислотоутворювач», кисень був відкритий в 1772 році Шееле і самостійно Священиком у 1774 році. Кисень отримав свою назву французький вчений Антуан Лавуазьє.
Шееле виявив кисень, шляхом експерименту, який передбачав спалювання оксиду марганцю. Шееле прийшов, щоб виявити, що гарячий оксид марганцю виробляє газ, який він назвав «вогненним повітрям». Він також прийшов до того, щоб виявити, що коли цей газ зміг зіткнутися з деревним вугіллям, він виробляв красиві яскраві іскри. Всі інші елементи виробляють однаковий газ. Хоча Шееле відкрив кисень, він не опублікував свою роботу лише через три роки після того, як інший хімік, Джозеф Прістлі, виявив кисень. Джозеф Прістлі, англійський хімік, повторив експеримент Шееле в 1774 році, використовуючи дещо інший набір. Священик використовував 12-дюймове палаюче скло і спрямовував сонячне світло безпосередньо на сполуку, яку він випробовував, оксид ртуті. В результаті він зміг «відкрити краще повітря», що, як було показано, розширює життя миші до чотирьох разів довше і викликало полум'я, щоб горіти з більшою інтенсивністю. Незважаючи на ці експерименти, обидва хіміки не змогли точно визначити, що саме являє собою цей елемент. Лише в 1775 році Антуан Лавуазьє, французький хімік, зміг розпізнати цей невідомий газ як елемент.
Наша атмосфера в даний час містить близько 21% вільного кисню. Кисень виробляється різними способами. Процес фотохімічної дисоціації, при якому молекули води розщеплюються ультрафіолетовими променями, виробляє близько 1-2% нашого кисню. Іншим процесом, який виробляє кисень, є фотосинтез, який виконується рослинами та фотосинтетичними бактеріями. Фотосинтез відбувається через наступну загальну реакцію:
\[\ce{CO2 + H2O + h\nu \rightarrow} \text{organic compounds} \ce{+ O2}\]
Небезпека флогістона
Теорія флогістона - застаріле переконання, що вогнеподібний елемент під назвою флогістон міститься в горючих тілах і виділяється при горінні. Назва походить від давньогрецької φλγγγγσσσσσν phlistón (спалювання), від φλphlóx (полум'я). Вперше це було заявлено в 1667 році Йоганном Йоахімом Бехером, а потім більш формально зібраним Георгом Ернстом Шталем. Теорія намагалася пояснити такі процеси горіння, як згоряння та іржавіння, які зараз спільно відомі як окислення.
Властивості
- Номер елемента: 8
- Атомна маса 15,9994
- Колір: газоподібна форма - безбарвна, рідка - блідо-блакитна
- Температура плавлення: 54,36K
- Точка кипіння: 90,2 К
- Щільність: 0,001429
- 21% земної атмосфери
- Третій найпоширеніший елемент у Всесвіті
- Найпоширеніший елемент у земній корі на 45,4%
- 3 Стабільні ізотопи
- Енергія іонізації: 13.618 еВ
- Кисень легко відновлюється і є чудовим окислювачем, що робить його легко реагувати з іншими елементами
Магнітні властивості кисню
Кисень (O 2) парамагнітний. Молекула кисню має шість валентних електронів, тому молекула O 2 має 12 валентних електронів з електронною конфігурацією, показаною нижче: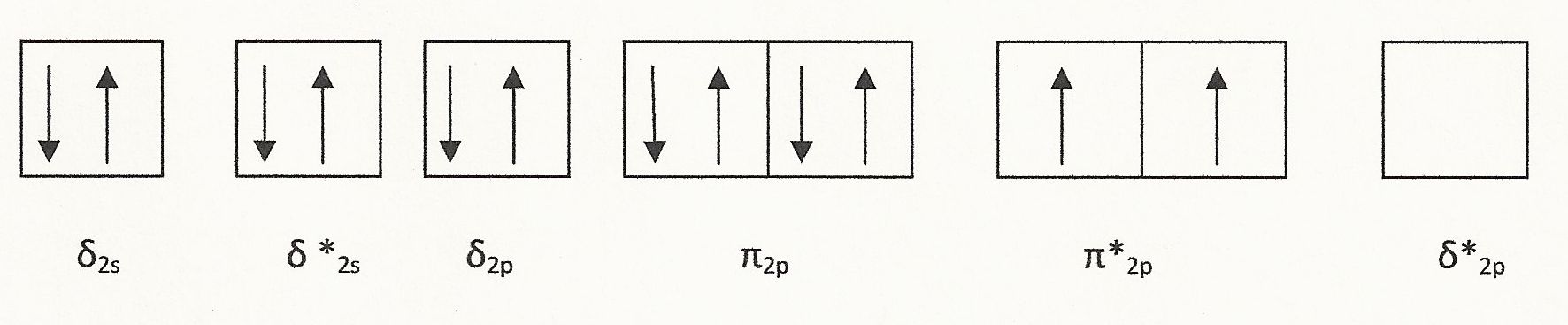
Як показано, є два непарні електрони, що спричиняє O 2 парамагнітним. Є також вісім валентних електронів на орбіталах зв'язку і чотири в антитілінгових орбіталах, що робить зв'язок порядку 2. На це припадає подвійний ковалентний зв'язок, який присутній в O 2.
Відео\(\PageIndex{1}\): Хімічна демонстрація парамагнетизму молекулярного кисню, як показано залученням рідкого кисню до магнітів.
Як показано на відео\(\PageIndex{1}\), оскільки молекулярний кисень (\(O_2\)має непарні електрони, він парамагнітний і притягується до магніту. На відміну від цього, молекулярний азот (\(N_2\)) не має непарних електронів і не притягується до магніту.
Загальна хімія кисню
Кисень, як правило, має ступінь окислення -2, але здатний мати ступені окислення -2, -1, -1/2, 0, +1 і +2. Стан окислення оксидів, пероксидів і супероксидів такі:- Оксиди: O -2,
- пероксиди: O 2 -2,
- супер оксид: O 2 -1.
Кисень не реагує ні з самим собою, ні азотом, ні водою в нормальних умовах. Кисень, однак, розчиняється у воді при 20 градусах Цельсія та 1 атмосфері. Кисень також нормально не вступає в реакцію з основами або кислотами. Метали 1 групи (лужні метали) дуже реагують з киснем і повинні зберігатися подалі від кисню, щоб запобігти їх окисленню. Метали в нижній частині групи більш реактивні, ніж ті, що знаходяться вгорі. Реакції деяких з цих металів більш детально розглянуті нижче.
Літій: Реагує з киснем, утворюючи білий оксид літію в реакції нижче.
\[\ce{4Li + O_2 \rightarrow 2Li_2O} \label{1}\]
Натрій: Реагує з киснем, утворюючи білу суміш оксиду натрію та пероксиду натрію. Реакції наведені нижче.
- кисень з оксидом натрію:\[\ce{4Na + O_2 \rightarrow 2Na_2O} \label{2}\]
- кисень з перекисом натрію:\[\ce{2Na + O_2 \rightarrow Na_2O_2} \label{3}\]
Калій: Реагує з киснем, утворюючи суміш перекису калію та супероксиду калію. Реакції наведені нижче.
- Перекис калію:\[\ce{2K + O_2 \rightarrow 2K_2O_2} \label{4}\]
- супероксид калію:\[\ce{K + O_2 \rightarrow KO_2} \label{5}\]
Рубідій і цезій: Обидва метали реагують на отримання супероксидів за допомогою того ж процесу, що і реакція супероксиду калію.
Оксиди цих металів утворюють гідроксиди металів при взаємодії з водою. Ці гідроксиди металів роблять розчин основним або лужним звідси і назва лужних металів.
Метали 2 групи (лужноземельні метали) реагують з киснем в процесі горіння з утворенням оксидів металів, але є кілька винятків.
Берилій дуже важко спалити, оскільки на його поверхні є шар оксиду берилію, який перешкоджає подальшій взаємодії з киснем. Стронцій і барій реагують з киснем з утворенням пероксидів. Реакція барію та кисню показана нижче, і реакція зі стронцієм була б однаковою.
\[\ce{Ba(s) + O2 (g) \rightarrow BaO2 (s) }\label{6}\]
Група 13 вступає в реакцію з киснем з метою утворення оксидів і гідроксидів, які мають форму\(X_2O_3\) і\(X(OH)_3\). Змінна X представляє різні групи 13 елементів. Коли ви йдете вниз по групі, оксиди та гідроксиди стають все більш основними.
Елементи 14 групи вступають в реакцію з киснем з утворенням оксидів. Оксиди, що утворюються у верхній частині групи, більш кислі, ніж ті, що знаходяться внизу групи. Кисень реагує з кремнієм і вуглецем, утворюючи діоксид кремнію і вуглекислий газ Вуглець також здатний реагувати з киснем з утворенням чадного газу, який є слабокислим. Германій, олово та свинець реагують з киснем, утворюючи монооксиди та діоксиди, які є амфотерними, а це означає, що вони реагують як з кислотами, так і з підставами.
Елементи групи 15 вступають в реакцію з киснем з утворенням оксидів. Найважливіші перераховані нижче.
- Азот: N 2 O, NO, N 2 O 3, N 2 O 4, N 2 O 5
- Фосфор: Р 4 О 6, Р 4 О 8, Р 2 О 5
- Миш'як: Як 2 O 3, As 2 O 5
- Сурма: Сб 2 О 3, Сб 2 О 5
- Вісмут: Бі 2 О 3, Бі 2 О 5
Елементи групи 16 вступають в реакцію з киснем з утворенням різних оксидів. Деякі з оксидів перераховані нижче.
- Сірка: SO, SO 2, SO 3, S 2 O 7
- Селен: SeO 2, SeO 3
- Телур: ТеО, ТеО 2, ТеО 3
- Польща: ОО, ОО 2, ОО 3
Елементи 17 групи (галогени) фтор, хлор, бром і йод вступають в реакцію з киснем з утворенням оксидів. Фтор утворює з киснем два оксиди, які є F 2 O і F 2 O 2. Обидва оксиди фтору називаються фторидами кисню, оскільки фтор є більш електронегативним елементом. Одна з реакцій фтору показана нижче.
\[\ce{O2 (g) + F2 (g) \rightarrow F2O2 (g)} \label{7}\]
Група 18 Деякі припускають, що благородні гази не реагуватимуть з киснем. Однак ксенон дійсно реагує з киснем, утворюючи\(\ce{XeO_3}\) і\(\ce{XeO_4}\). Енергія іонізації ксенону досить низька, щоб електронегативний атом кисню «вкрав» електрони. На жаль,\(\ce{XeO_3}\) дуже нестабільний, і, як відомо, він спонтанно детонував в чистому, сухому середовищі.
Перехідні метали реагують з киснем, утворюючи оксиди металів. Однак золото, срібло, платина не вступають в реакцію з киснем. Кілька реакцій за участю перехідних металів показані нижче.
\[2Sn_{(s)} + O_{2(g)} \rightarrow 2SnO_{(s)} \label{8} \]
\[4Fe_{(s)} + 3O_{2(g)} \rightarrow 2Fe_2O_{3(s)} \label{9A}\]
\[4Al_{(s)} + 3O_{2(g)} \rightarrow 2Al_2O_{3(s)} \label{9B}\]
реакція оксидів
Ми будемо обговорювати оксиди металів виду\(X_2O\). Змінна\(X\) являє собою будь-який метал, який здатний зв'язуватися з киснем, утворюючи оксид.
- Реакція з водою: Оксиди реагують з водою з метою утворення гідроксиду металу.
\[X_2O + H_2O \rightarrow 2XOH\]
- Реакція з розведеними кислотами: Оксиди реагують з розведеними кислотами, утворюючи сіль і воду.
\[X_2O + 2HCl \rightarrow 2XCl + H_2O\]
реакції пероксидів
Пероксиди, про які ми будемо обговорювати, мають форму\(X_2O_2\). Змінна\(X\) являє собою будь-який метал, який може утворювати перекис з киснем.
Реакція з водою: Якщо температура реакції підтримується постійною, незважаючи на те, що реакція екзотермічна, то реакція протікає наступним чином.
\[X_2O_2+ 2H_2O \rightarrow 2XOH + H_2O_2\]
Якщо реакція не буде проведена при постійній температурі, то реакція перекису і води призведе до того, що виробляється перекис водню розкладеться на воду і кисень.
Реакція з розведеною кислотою: Ця реакція є більш екзотермічною, ніж з водою. Тепло, що виробляється, змушує перекис водню розкладатися на воду і кисень. Реакція показана нижче.
\[X_2O_2 + 2HCl \rightarrow 2XCl + H_2O_2\]
реакція супероксидів
Супероксиди, про які ми будемо говорити, мають форму\(XO_2\). з\(X\) представленням будь-якого металу, який утворює супероксид при взаємодії з киснем.
Реакція з водою: Супероксид і вода реагують в дуже екзотермічній реакції, яка показана нижче. Тепло, яке утворюється при утворенні перекису водню, призведе до розкладання перекису водню на воду та кисень.
\[2XO_2 + 2H_2O \rightarrow 2XOH + H_2O_2 + O_2\]
Реакція з розведеними кислотами: Супероксид і розведена кислота реагують в дуже екзотермічній реакції, яка показана нижче. Тепло, що виробляється, призведе до розкладання перекису водню на воду та кисень.
\[2XO_2 + 2HCl \rightarrow 2XCl + H_2O_2 + O_2\]
Алотропи кисню
Існує два алотропи кисню; диоксиген (O 2) і триоксиген (O 3), який називається озоном. Реакція перетворення диоксигену в озон дуже ендотермічна, що призводить до того, що вона виникає рідко і лише в низькій атмосфері. Реакція показана нижче:
\[3O_{2 (g)} \rightarrow 2O_{3 (g)} \;\;\; ΔH^o= +285 \;kJ\]
Озон нестійкий і швидко розкладається назад до кисню, але є чудовим окислювачем.
Різні реакції
Реакція з алканами: Найбільш поширені реакції, що включають алкани, відбуваються з киснем. Алкани здатні горіти, і саме процес окислення вуглеводнів робить їх важливими як паливо. Прикладом алкановой реакції є реакція октану з киснем, як показано нижче.
С 8 Н 18 (л) + 25/2 О 2 (г) → 8СО 2 (г) + 9Н 2 О (л) ΔH о = -5,48 Х 10 3 кДж
Реакція з аміаком: Кисень здатний реагувати з аміаком, утворюючи азот (N 2) та воду (H 2 O) через реакцію, показану нижче.
\[4NH_3 + 3O_2 \rightarrow 2N_2 + 6H_2O\]
Реакція з оксидом азоту: Кисень здатний реагувати з оксидом азоту, щоб виробляти діоксид азоту через реакцію, показану нижче.
\[NO + O_2 \rightarrow NO_2\]
Проблеми
- Чи реагує кисень з нобелівськими газами?
- З якими перехідними металами кисень не вступає в реакцію?
- Що виробляється, коли оксид реагує з водою?
- Чи реагує кисень з лужними металами? Чому лужні метали названі таким чином?
- Якщо кисень реагує з лужними металами, чи утворюються оксиди, пероксиди або супероксиди?
Рішення
- Ні, благородні гази не реагують з киснем.
- Кисень здебільшого не реагує з золотом і платиною.
- Коли оксид вступає в реакцію з водою, утворюється гідроксид металу.
- Кисень дуже реагує з лужними металами. Лужні метали отримують назву луг, оскільки оксиди цих металів реагують з водою, утворюючи гідроксид металу, який є основним або лужним.
- Літій виробляє оксид, натрій виробляє перекис, а калій, цезій і рубідій виробляють супероксиди.
Посилання
- Браатена, Пер Крістіан. «Визначення вмісту кисню в повітрі». Дж. Хем. Едук. 2000 77 1410.
- Najdoski, Metodija; Petrusevski, Vladimir M. "Новий експеримент для швидкого і простого визначення вмісту кисню в повітрі" J.Chem. Едук. 2000 77 1447.
- Петруччі, Ральф Х. Загальна хімія. 9-е изд. Верхня річка Сідла: Зал Прентіс, 2007. Друк
- Макнот, Ян Дж. «Модифікована водень/киснева балон демонстрації.» Дж. Хем. Едук. 1998 75 52.
Автори та атрибуція
- Філіп Болл (UCD), Кетрін Вільямс (UCD)