8.9.2: Хімія азоту (Z = 7)
- Page ID
- 33594
Азот присутній майже у всіх білках і відіграє важливу роль як у біохімічному застосуванні, так і в промисловому застосуванні. Азот утворює міцні зв'язки через свою здатність утворювати потрійний зв'язок зі своєю самою та іншими елементами. Таким чином, в сполуках азоту багато енергії. До 100 років тому про азот було мало що відомо. Зараз азот зазвичай використовується як для збереження їжі, так і в якості добрива.
Вступ
Встановлено, що азот має 3 або 5 валентних електронів і лежить у верхній частині групи 15 у таблиці Менделєєва. Він може мати 3 або 5 валентних електронів, оскільки він може зв'язуватися у зовнішніх орбіталах 2p та 2s. Молекулярний азот (\(N_2\)) is not reactive at standard temperature and pressure and is a colorless and odorless gas.
Азот - неметалевий елемент, який найбільш рясно зустрічається в атмосфері, азотний газ (N 2) становить 78,1% об'єму земного повітря. Він з'являється лише в 0,002% земної кори за масою. Сполуки азоту містяться в харчових продуктах, вибухових речовині, отрутах, добривах. Азот становить ДНК у вигляді азотистих підстав, а також у нейромедіаторах. Це один з найбільших промислових газів, і виробляється комерційно як газ, так і рідина.
| Ім'я та символ | Азот, N |
| Категорія | неметалеві |
| Атомна вага | 14.0067 |
| Груповий | 15 |
| Конфігурація електрона | 1с 2 2с 2 2п 3 |
| валентні електрони | 2, 5 |
| Фаза | Газ |
Історія
Азот, який становить близько 78% нашої атмосфери, являє собою безбарвний, без запаху, смаку і хімічно нереактивний газ при кімнатній температурі. Він названий від грецьких генів nitron + для формування соди. Протягом багатьох років протягом 1500-1600-х років вчені натякали, що в атмосфері, крім вуглекислого газу і кисню, є ще один газ. Лише в 1700-х роках вчені могли довести, що насправді є ще один газ, який зайняв масу в атмосфері Землі.
Відкрито в 1772 році Даніелем Резерфордом (і незалежно іншими, такими як Прістлі та Кавендіш), який зміг видалити кисень та вуглекислий газ із трубки, наповненої повітрям. Він показав, що є залишковий газ, який не підтримує горіння, як кисень або вуглекислий газ. Хоча його експеримент був тим, який довів, що азот існує, інші експерименти також відбувалися в Лондоні, де вони називали речовину «спаленим» або «дефлогістифікованим повітрям».
Азот є четвертим за поширеністю елементом у людини, і він більш багатий у відомому Всесвіті, ніж вуглець або кремній. Більшість комерційно вироблених азотних газів відновлюється зі зрідженого повітря. З цієї кількості більшість використовується для виробництва аміаку (\(NH_3\)) за допомогою процесу Haber. Багато що також перетворюється на азотну кислоту (\(HNO_3\)).
Ізотопи
Азот має два природних ізотопи, азот-14 і азот-15, які можна розділити за допомогою хімічних обмінів або теплової дифузії. Азот також має ізотопи з 12, 13, 16, 17 масами, але вони радіоактивні.
- Азот 14 є найпоширенішою формою азоту і становить понад 99% всього азоту, знайденого на Землі. Це стійке з'єднання і нерадіоактивне. Азот-14 має найбільш практичне застосування і зустрічається в сільськогосподарських практиках, консервації харчових продуктів, біохімікатах та біомедичних дослідженнях. Азот-14 міститься в достатку в атмосфері і серед багатьох живих організмів. Він має 5 валентних електронів і не є хорошим електричним провідником.
- Азот-15 - інша стабільна форма азоту. Його часто використовують в медичних дослідженнях і консервації. Елемент є нерадіоактивним і тому може також іноді використовуватися в сільськогосподарській практиці. Азот-15 також використовується в дослідженнях мозку, зокрема ядерно-магнітно-резонансної спектроскопії (ЯМР), оскільки на відміну від азоту-14 (ядерний спін 1), він має ядерний спін 1/2, що має переваги, коли мова йде про спостереження за дослідженнями МРТ та спостереженнями ЯМР. Нарешті, азот-15 може використовуватися як етикетка або в деяких білках в біології. Вчені в основному використовують цю сполуку в дослідницьких цілях і ще не бачили його повного потенціалу для використання в дослідженнях мозку.
сполуки
Дві найпоширеніші сполуки азоту - нітрат калію (KNO 3) та нітрат натрію (NaNo 3). Ці дві сполуки утворюються шляхом розкладання органічної речовини, яка має калій або натрій, і часто зустрічаються в добривах та побічних продуктах промислових відходів. Більшість сполук азоту мають позитивну вільну енергію Гіббса (тобто реакції не є спонтанними).
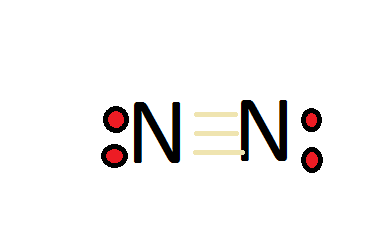
Молекула азоту (\(N_2\)) є «надзвичайно стабільною» сполукою, особливо тому, що азот утворює потрійний зв'язок із собою. Цей потрійний зв'язок важко розірвати. Щоб азот дотримувався правила октета, він повинен мати потрійний зв'язок. Азот має загалом 5 валентних електронів, тому подвоюючи це, ми матимемо в цілому 10 валентних електронів з двома атомами азоту. Октет вимагає, щоб атом мав 8 загальних електронів, щоб мати повну валентну оболонку, тому він повинен мати потрійний зв'язок. З'єднання також дуже інертне, так як має потрійний зв'язок. Потрійні зв'язки дуже важко розірвати, тому вони зберігають свою повну валентну оболонку замість того, щоб реагувати з іншими сполуками або атомами. Подумайте про це так, кожен потрійний зв'язок схожий на гумку, з трьома гумками, атоми азоту дуже притягуються один до одного.
Нітриди
Нітриди - це сполуки азоту з менш електронегативним атомом; іншими словами це з'єднання з атомами, які мають менш повну валентну оболонку. Ці сполуки утворюються з літієм і металами групи 2. Нітриди зазвичай мають ступінь окислення -3.
\[3Mg + N_2 \rightarrow Mg_3N_2 \label{1}\]
При змішуванні з водою азот утворює аміак, і цей іон нітриду діє як дуже сильна основа.
\[N + 3H_2O_{(l)} \rightarrow NH_3 + 3OH^-_{(aq)} \label{2}\]
Коли азот утворюється з іншими сполуками, він переважно утворює ковалентні зв'язки. Зазвичай вони робляться з іншими металами і виглядають так: MN, M 3 N і M 4 N. Ці сполуки, як правило, тверді, інертні і мають високі температури плавлення, оскільки здатність азоту утворювати потрійні ковалентні зв'язки.
Іони амонію
Азот проходить фіксацію реакцією з газом воднем над каталізатором. Цей процес використовується для отримання аміаку. Як згадувалося раніше, цей процес дозволяє нам використовувати азот як добриво, оскільки він руйнує міцний потрійний зв'язок, що утримується N 2. Знаменитий процес синтезу аміаку Haber-Bosch виглядає так:
\[N_2 + 3H_2 \rightarrow 2NH_3 \label{3}\]
Аміак є основою і також використовується в типових кислотно-лужних реакціях.
\[2NH_{3(aq)} + H_2SO_4 \rightarrow (NH_4)_2SO_{4(aq)} \label{4}\]
Іони нітриду є дуже сильними основами, особливо у водних розчині.
Оксиди азоту
Нітриди використовують безліч різних чисел окислення від +1 до +5 до оксидних сполук. Майже всі оксиди, які утворюються, є газами, і існують при 25 градусах Цельсія. Оксиди азоту кислі і легко приєднують протони.
\[N_2O_5 + H_2O \rightarrow 2HNO_{3 (aq)} \label{5}\]
Оксиди відіграють велику роль в живих організмах. Вони можуть бути корисними, але небезпечними.
- Оксид азоту (N 2 O) - це анестетик, який використовується у стоматолога як сміючий газ.
- Діоксид азоту (NO 2) шкідливий. Він зв'язується з молекулами гемоглобіну, не дозволяючи молекулі виділяти кисень по всьому організму. Він звільняється від автомобілів і дуже шкідливий.
- Нітрат (NO 3 -) - багатоатомний іон.
- Більш нестабільні оксиди азоту дозволяють здійснювати космічні подорожі.
Гідриди
Гідриди азоту включають аміак (NH 3) і гідразин (N 2 H 4).
- У водному розчині аміак утворює іон амонію, який ми описали вище і він має особливі амфіпротичні властивості.
- Гідразин зазвичай використовується як ракетне паливо
Застосування азоту
- Азот забезпечує ковдру для нашої атмосфери для виробництва хімічних речовин та електронних відсіків.
- Азот використовується як добриво в сільському господарстві для сприяння зростанню.
- Газ під тиском для нафти.
- Холодоагент (наприклад, заморожування їжі швидко)
- Вибухові речовини.
- Обробка металів/захисний засіб за допомогою впливу азоту замість кисню
Посилання
- Петруччі, Ральф Х, Вільям Харвуд та Ф. Оселедець. Загальна хімія: принципи та сучасні застосування. 8-й ред. Нью-Джерсі: Пірсон Освіта Інк, 2001.
- Садава, Девід та ін. ЖИТТЯ: Наука біології. Восьме видання. Асоційований співробітник Сінауера.
- Томас, Яків. Азот та його застосування в сучасному майбутньому. Преса державного університету Сан-Дієго: 2007.
Проблеми
- Заповніть і збалансуйте наступні рівняння
N 2 + ___Н 2 → ___НЧ _
Н 2 Н 2 О 2 →?
2НГ 3 + СО 2 →?
__Мг+ Н 2 → Мг _ Н _
N 2 Н 5 + Н 2 О →?
- Які різні ізотопи азоту?
- Перерахуйте стани окислення різних оксидів азоту: N 2 O, NO, N 2 O 3, N 2 O 4, N 2 O 5
- Перелічіть різні елементи, з якими азот буде реагувати, щоб зробити його основним або кислим...
- Використання азоту
Відповіді
- Заповніть і збалансуйте наступні рівняння
N 2 + 3H 2 → 2NH 3 (процес Хабера)
Н 2 Н 2 О 2 → ХНО
2Н 3 + СО 2 → (Н 2) 2 СО + Н 2 О
2Мг+ 3Н 2 → Мг 3 Н 2
Н 2 Н 5 + Н 2 О → Н 2 + Н + Н + Н 2 О
- Які різні ізотопи азоту?
До стійких форм відносять азот-14 і азот-15
- Перерахуйте ступені окислення різних оксидів азоту: +1, +2, +3, +4, +5 відповідно
- Перелічіть різні елементи, з якими азот буде реагувати, щоб зробити його основним або кислим: Іон нітриду є сильною основою при взаємодії з водою, Аміак, як правило, слабка кислота
- Використання азоту включає анестетик, холодоагент, металевий протектор
Дописувачі
- Адам Ванделл (UC Девіс)