8.5.1: Отримання та загальні властивості лужноземельних елементів
- Page ID
- 33582
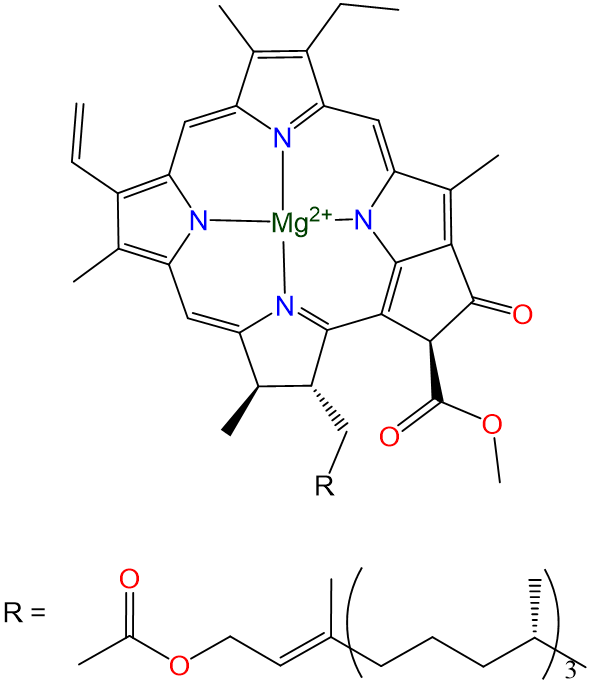
Як і лужні метали, лужноземельні метали є хорошими відновниками, які знаходяться на Землі лише в їх +2 ступенів окислення. Особливо поширені магній і кальцій. Магнійвмісні хлорофіли є фотосинтетичними пігментами зелених рослин і фотосинтетичних водоростей (Схема\(\sf{\PageIndex{1}}\)).
Схема\(\sf{\PageIndex{1}}\). Будова хлорофілу а, один з принципових зелених пігментів рослин.
Морська вода становить близько 0,05 М в Mg 2+ і 0,01 M в Ca 2+, а берилій і кальцій є компонентами багатьох важливих мінералів. Приклади лужноземельних металловмісних мінералів, які були відомі та використані з давніх-давен, включають берил, Be 3 Al 2 Si 6 O 18; гіпс, CaSO 4 · 2H 2 O; вапняк, CaCo 3; і вапно, СаО, останні з яких були більше останнім часом замінені в будівництві на основі силікату кальцію піщано-вапняну цеглу і портландцементний,
Незважаючи на широке поширення та важливість кальцію та магнію в навколишньому середовищі, метали були виділені лише наприкінці 18 та початку 19 століття після розвитку електролізу. Ізоляція Хамфрі Деві Mg і Ca є ілюстративною.
\[\sf{2~MO~~\overset{electrolysis}{\longrightarrow}~~2~M(s)~~+~~O_2~~~~~~Davy, (M~=~Mg,~Ca,~1808)} \nonumber \]
Сьогодні Ca, Mg та інші лужноземельні метали отримують або електролізом їх хлоридів, або хімічним відновленням вуглецю або алюмінію.
\[\sf{2~MCl_2~~\overset{electrolysis}{\longrightarrow}~~2~M(s)~~+~~Cl_2~~~~~~(M~=~Be,~Mg,~Ca,~Sr)} \nonumber \]
\[\sf{MgO~~+~~C~~\overset{electrolysis}{\longrightarrow}~~Mg(s)~~+~~CO} \nonumber \]
\[\sf{3~MO~~+~~2~Al~~\overset{electrolysis}{\longrightarrow}~~M(s)~~+~~Al_2O_3~~~~~~(M~=~Ca,~Sr,~Ra)} \nonumber \]
\[\sf{4~BaO~~+~~2~Al~~\overset{electrolysis}{\longrightarrow}~~M(s)~~+~~BaAl_2O_4} \nonumber \]
Після утворення метали реагують на атмосферний кисень. Тим не менш, Be і Mg можуть зберігатися і використовуватися на повітрі, оскільки початкове окислення дає тонкий пасивуючий шар оксиду, який герметизує об'ємний метал від подальшого окислення. Інші лужноземельні метали потрібно зберігати в інертній атмосфері, щоб запобігти їх деградації до оксиду.
Фізичні властивості
Як і лужні метали, лужноземельні метали - це сірі або сріблясті тверді речовини, які кристалізуються в кубічній решітці, HCP для Be і Mg, FCC/CCP для Ca і Sr та BCC для Ba та Ra. Всі мають типові металеві властивості високої тепло- і теплопровідності. Окрім найлегшого члена групи, вони порівняно низькоплавкі та м'які через їх великі атомні радіуси, низькоефективні ядерні заряди та лише два валентні електрони, які сприяють металевому зв'язку. Таким чином, вони плавляться і киплять при більш високих температурах, ніж лужні метали, але більш низьких температурах, ніж більшість перехідних металів, про що свідчать температури плавлення і кипіння, наведені в табл\(\sf{\PageIndex{1}}\). Як і у лужних металів, температури плавлення та кипіння зменшуються по групі зі збільшенням атомного розміру.
Таблиця\(\sf{\PageIndex{1}}\). Точки плавлення і кипіння лужноземельних металів і окремих еталонних речовин. 3
| Речовина | Точка плавлення (\(^{\circ}\)C) | Точка кипіння (\(^{\circ}\)C) |
| Лужноземельний метал | ||
| Берилій, Be | 1278 | 2468 |
| Магній, Mg | 649 | 1090 |
| Кальцій, Ca | 839 | 1484 |
| Стронцій, Sr | 769 | 1384 |
| Барій, Бар | 727 | 1845 |
| Радій, Ra | 700 | 1140 |
| Нелужноземельний метал | ||
| Літій, Li | 181 | 1347 |
| Натрій, Na | 98 | 883 |
| Цезій, Cs | 28 | 678 |
| Титан, Ti | 1660 | 3287 |
| Залізо, Fe | 1538 | 2861 |
| Мідь, Cu | 1083 | 2567 |
| Вода | 0 | 100 |
| бензолу | 6 | 80 |
Атомні властивості лужноземельних металів відображають
- відносно висока енергія і великий розмір їх n s орбіталей
- більш ефективний ядерний заряд, який відчувають електрони на їх n s валентних орбіталів порівняно з відповідними лужними металами
Як видно з атомних радіусів та енергій іонізації, наведених у таблиці\(\sf{\PageIndex{2}}\), загалом радіуси та енергії іонізації лужноземельних металів слідують очікуваним періодичним тенденціям. Радіуси збільшуються вниз по групі і через ряд слідують тенденції.
\[\sf{alkali~metal~>~alkaine~earth~metal~>~transition~metals} \nonumber \]
Через їх менших розмірів і більшої атомної маси лужноземельні метали значно більш щільні, ніж відповідні лужні метали (табл\(\sf{\PageIndex{2}}\).
Відповідно, енергії іонізації лужноземельних металів зменшуються вниз на групу, тоді як через ряд їх енергії іонізації слідують тенденції.
\[\sf{alkali~metal~<~alkaine~earth~metal~<~transition~metals} \nonumber \]
Внаслідок цього лужноземельні метали є хорошими відновниками і вважають за краще утворювати іон +2, хоча вони не так реагують, як лужні метали. Крім того, Be володіє аномально малим радіусом, високою енергією іонізації та великою електронегативністю в порівнянні з важчими лужноземельними металами. Отже, він поводиться хімічно схожим з бором і алюмінієм, про що і піде мова в наступному розділі.
Таблиця\(\sf{\PageIndex{2}}\). Вибрані атомні властивості лужних металів та вибрані еталонні сполуки. 3,4
| Речовина |
Атомний радіус (Ангстреми) |
Перша енергія іонізації (кДж/моль) |
Полінг Електронегативність |
Щільність твердого тіла (г/мл) |
| Лужноземельний метал | ||||
| Берилій, Be | 1.05 | 899 | 1.57 | 1,85 |
| Магній, Mg | 1,50 | 738 | 1.31 | 1.74 |
| Кальцій, Ca | 1.80 | 590 | 1.00 | 1.55 |
| Стронцій, Sr | 2.00 | 550 | 0,95 | 2.54 |
| Барій, Бар | 2.15 | 503 | 0,89 | 3.59 |
| Радій, Ra | 2.15 | 509 | 0,89 | 5.0 |
| Нелужноземельний метал | ||||
| Літій, Li (той же ряд, що і Be) | 1,45 | 513 | 0,98 | 0,53 |
| Натрій, Na (той же ряд, що і Mg) | 1.80 | 496 | 0,93 | 0,97 |
| Калій, К (той же ряд, що і Ca) | 2.20 | 419 | 0.82 | 0,86 |
| Рубідій, Rb (той же рядок, що і Sr) | 2.35 | 403 | 0.82 | 1.53 |
| Цезій, Cs (той же ряд, що і Ba) | 2.60 | 376 | 0.79 | 1.87 |
| Френціум. Fr (той же рядок, що і Ra) | не визначено | 400 | 0.7 | не визначено |
| Титан, Ti | 1.40 | 658 | 1.54 | 4.54 |
| Залізо, Fe | 1.40 | 759 | 1.83 | 7.87 |
| Мідь, Cu | 1.35 | 745 | 1,90 | 8.96 |
| Бор, Б | 0,85 | 801 | 2.04 | 2.34 |
| Алюміній, Al | 1,25 | 577 | 1.61 | 2.70 |
| Азот, N | 0,65 | 1402 | 3.04 | 1.03 (при 21 К) |
Як буде пояснено в наступному розділі, малі енергії іонізації лужних металів є одним з факторів, що сприяють їх реактивності.
Посилання та примітки
1. Всі дані про фізичні та атомні властивості елементів, крім атомних радіусів та температури кипіння та плавлення Ba, Be та Fe, обчислюються за даними Emsley, J. Elements 2-е изд. Преса Оксфордського університету, 1991. Оскільки точки фазового переходу для Be, Ba та Fe були або перераховані як відповідні умовам високого тиску, або не узгоджені зі значеннями, повідомленими в іншому місці, вони були взяті з даних, перелічених на https://www.rsc.org/periodic-table.
2. Атомні радіуси - це емпіричні радіуси, визначені Джоном Слейтером, як повідомляється в Slater, J.C. Chem. Фіз. 1964, 41, 3199-3204. Значення цих радіусів можна зручно отримати за адресою http://www.knowledgedoor.com/2/elements_handbook/slater_atomic-ionic_radius.html
Автори та атрибуція
Стівен Контакс, Вестмонтський коледж