3.1: Електронно-точкові діаграми Льюїса
- Page ID
- 33281
У 1916 році Гілберт Льюїс Ньютон представив простий спосіб показати зв'язок між атомами в молекулі, хоча електронно-точкові діаграми Льюїса. Створення діаграм Льюїса досить просте і вимагає всього декількох кроків і деякого обліку валентних електронів на кожному атомі. Валентні електрони представлені у вигляді точок. Коли два електрони парні (одинокі пари), вони представлені двома сусідніми точками, розташованими на атомі, а коли два парних електрона поділяються між атомами (зв'язками), вони відображаються у вигляді ліній. Наприклад, нижче наведені електронні точкові структури атомів та електронні точкові структури молекул Льюїса.
Ці діаграми корисні, оскільки вони дозволяють нам показати, як атоми пов'язані, і в поєднанні з теорією відштовхування електронів Valence Shell (VSEPR) ми можемо використовувати структури Льюїса для прогнозування форми молекули.
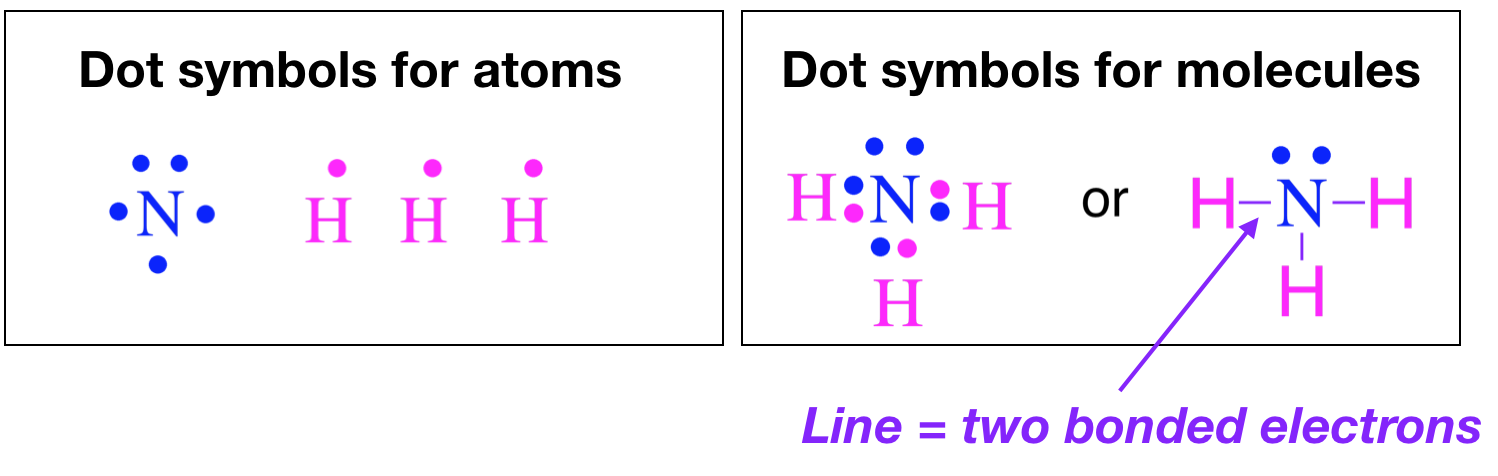
Креслення електронно-точкових структур Льюїса керується значною мірою октетним правилом: атоми утворюють зв'язки для досягнення восьми електронів у їх валентній оболонці. Для багатьох елементів повна валентна оболонка має електронну конфігурацію\(s^2p^6\), або вісім електронів. Поширеним винятком з цього правила є елементи першого ряду, Н і Він. Ці два елементи мають\(n=1\) як свою валентну оболонку, і тому вони мають лише два електрони в повній валентній оболонці (\(1s^2\)електронна конфігурація). Хоча Н і Він є винятком з «правила октета», вони все ж утворюють зв'язки для досягнення повної валентної оболонки. Можливо, краще думати про це як про правило «повної валентності» склеювання. Ми побачимо ще багато порушень правила «октету», коли ми просуваємось через цей курс. У випадку з металами і металоїдами порушення правил особливо поширене. (CC-BY-NC-SA; Кетрін Хаас)
- Менше восьми електронів (гіповалентність): H і He - приклади елементів, які не можуть мати більше двох електронів у своїй повній валентній оболонці. Крім того, відомі випадки, коли дійсна структура Льюїса містить атоми з гіповалентністю: частково заповнені валентні оболонки. Прикладом цього є карбокатіон, позитивно заряджений вуглець з лише шістьма електронами в валентній оболонці. Карбокатіони є важливими проміжними речовинами в органічній хімії, і вони є високореактивними (нестабільними) кислотами Льюїса (електрофілами). Іншим прикладом гіповалентності є структура Льюїса для ВН 3, яка показує бор з трьома зв'язками, і тільки шість електронів в його валентній оболонці. Гідрид бору - сильна кислота Льюїса. (Бічна примітка: фактична хімічна форма BH 3 не є добре передбаченою структурою Льюїса, і ми побачимо більше про це в розділі 3.1.4.)
- Більше восьми електронів (гіпервалентність): Це випадок, коли елемент має більше восьми електронів у своїй валентній оболонці. Це загальне для більших атомів (\(n\geq3\)), і це обговорюється далі в розділі 3.1.2.
Підводний камінь оповіщення! Існують різні правила підрахунку електронів в залежності від мети підрахунку. Такі правила підрахунку для «октетів». Правила підрахунку для розрахунку формального заряду атома є!! різні!! і описані в розділі 3.1.1. Коли атом є частиною молекули, всі електрони, пов'язані з атомом, підраховуються як сприяють валентності атома. Сюди входять електрони, які є самотніми парами на атомах, і всі електрони, які поділяються в зв'язках. Якщо чотири електрони поділяються між двома атомами, це подвійний зв'язок. Якщо шість електронів поділяються між атомами, це потрійний зв'язок.
Електрони у валентності (октет) = загальна кількість незв'язаних електронів на атомі + загальні зв'язані електрони (2 електрони на зв'язок)
Навіть якщо ви старий професіонал в малюванні структур Льюїса, це гарна ідея, щоб полірувати. Будь ласка, виконайте практичні вправи нижче. Ви повинні дістати фактичний аркуш паперу (я знаю... просто зробіть це. Це добре для вас.) і письмовий інструмент і спробуйте завершити кожну проблему, перш ніж перевіряти відповідь.
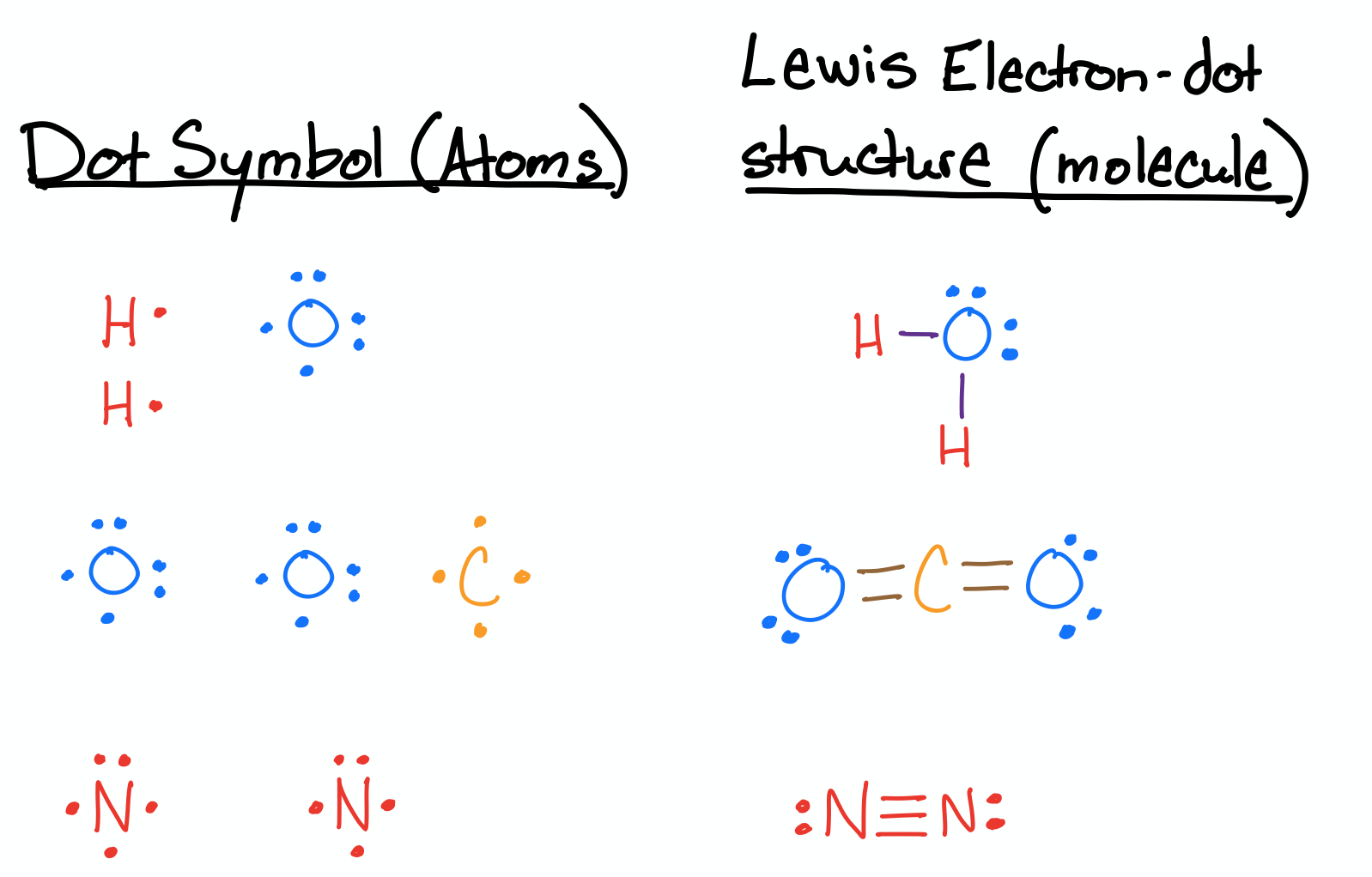
Намалюйте структури Льюїса для H 2 O, CO 2 та N 2.
- Відповідь
-
Намалюйте структури Льюїса для H 2, BH 3 та BF 3.
- Відповідь
-
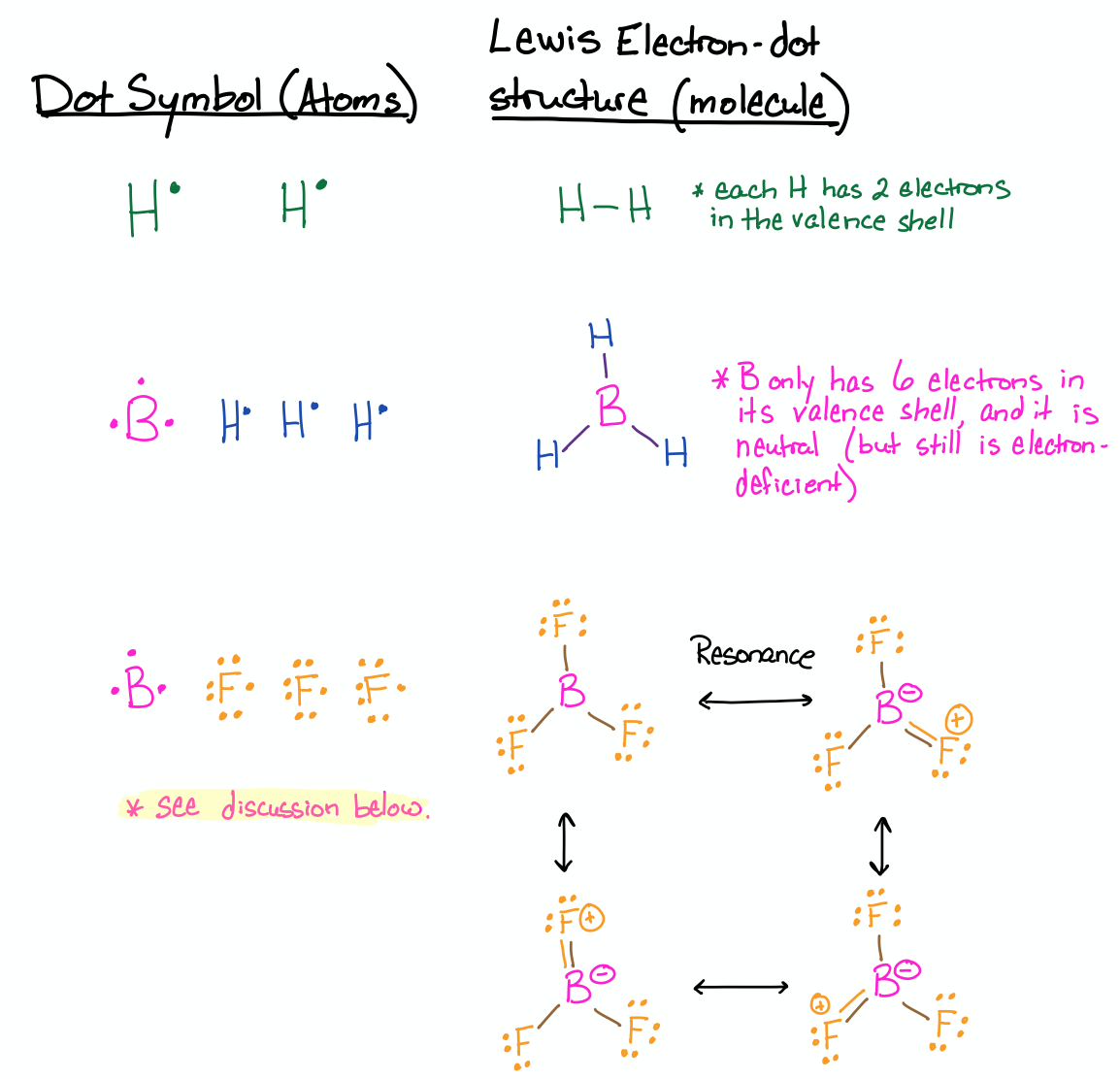
Ці три приклади включають атоми, які мають менше восьми електронів у валентній оболонці. У випадку з Н він задовольняється тільки двома електронами в своїй валентності, про що йшлося раніше в цьому розділі. Справа БН 3 також обговорювалася вище. У структурі Льюїса BH 3 бор може мати лише шість електронів у своєму октеті і він нейтральний. Бор має дефіцит електронів, хоча він має нейтральний заряд.
Випадок BF 3 заслуговує на обговорення: Якщо ви не знайомі з резонансом та формальним зарядом, спочатку див Розділи 3.1.1 (Резонанс) та 3.1.3 (Формальний заряд), а потім поверніться до цього. Можливо, ви намалювали структуру BF 3, подібну до тієї, яка намальована для BH 3, де бор має три зв'язки і лише шість електронів у своїй валентній оболонці. Якщо ви це зробили, то ви маєте рацію; але якщо ви тільки дали цю структуру, то ваша відповідь не повна. Є ще три правильних способи намалювати конструкцію. Оскільки F має самотні пари електронів, інші дійсні структури Льюїса мали б подвійний зв'язок з одним із фторів (три загальних). Всі ці структури називаються резонансними структурами, і на основі чотирьох з них можна передбачити, що BF 3 матиме B-F зв'язки, які мають певний характер подвійного зв'язку. Якщо насправді, це стосується BF 3; він має довжини зв'язків, які коротші за одиночні зв'язки, але довші за подвійні зв'язки. Детальніше про це читайте на сторінці Вікіпедії тут (натисніть).
Зовнішні посилання
- uk.wikipedia.org/вікі/Льюїс
- http://www.ausetute.com.au/lewisstr.html
- вартість. георгія південний.edu/хім... cule/lewis.htm
