6.11: Більше молекулярної орбітальної теорії та міжмолекулярних сил
- Page ID
- 27741
Більше теорії МО
Поки ми обговорювали\(\mathrm{MO}\) діаграми з однорідними димерами: обидва атоми однакові. Але можуть бути і гетерогенні димери за участю двох різних атомів, і ці димери можуть бути заряджені! Коли ми будуємо\(\mathrm{MO}\) діаграму для гетерогенного димера, то це той же принцип, що і для однорідного димера: малюємо електронні орбітальні діаграми для кожного атома, заповнюємо електронні стани, а потім fil в сигма і пі, що утворилися стани зв'язку і антизв'язування. Єдина відмінність у випадку гетерогенного димера полягає в тому, що ми повинні враховувати відносну енергію кожного набору атомних орбіталей. Це часто дає асиметричні\(\mathrm{MO}\) діаграми. Як правило, чим більше електронегативний атом менше в енергії.
Приклад: Намалюйте\(\mathrm{MO}\) схему\(\mathrm{CN}^-\). Визначте порядок облігацій.
- Відповідь
-
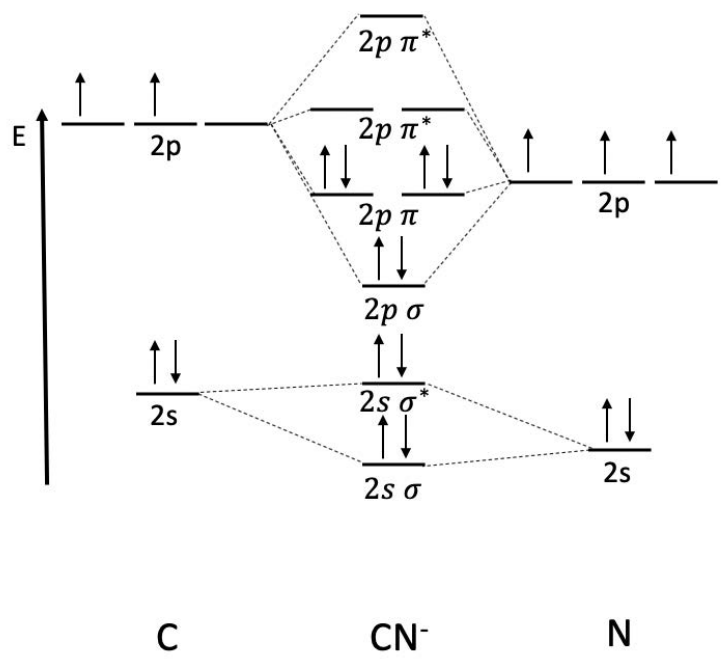
Азот нижче вздовж енергетичної осі, оскільки він більш електронегативний, ніж вуглець, даючи асиметричну\(\mathrm{MO}\) діаграму. У зв'язкових орбіталах є 8 електронів і 2 електрони в антитілінгових орбіталах, тому порядок зв'язку
\(\text { bond order }=\dfrac{1}{2}(8-2)=3\)
Димер із замовленням облігацій 3 є потрійним зв'язаним! Ви можете розпізнати цю молекулу як ціанід.
Міжмолекулярні сили (IMF)
Лондонські сили дисперсії (ЛДФ) існують у всіх молекулах. Оскільки електрони, розподілені по молекулі, коливаються в часі, вони генерують невеликі електричні поля. Потім електрони в інших молекулах або атомах, які знаходяться в безпосередній близькості, переставляються у відповідь на генеруються електричні поля. Молекули з більшою кількістю електронів відчувають сильніші ЛДФ.
Дипольно-дипольні взаємодії - це IMF, що характеризуються електростатичною силою між полярними молекулами. Чим полярніше молекула, тим сильніше взаємодія.
Водневі зв'язки (\(\mathrm{H}\)-зв'язки) - це особливий тип дипольно-дипольної взаємодії, що відбуваються в молекулах з атомом водню,\((\mathrm{H})\) пов'язаним безпосередньо з атомом фтору, кисню або азоту (\(\mathrm{F}\),\(\mathrm{O}\), або\(\mathrm{N})\).
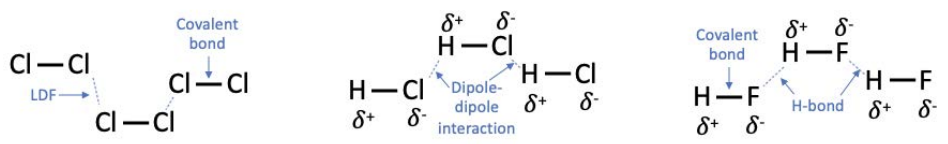
Як правило, ЛДФ слабкіші, ніж дипольно-дипольні взаємодії, а\(\mathrm{H}\) -зв'язки найсильніші з усіх. Однак немає можливості застосувати універсальну класифікацію сили МВФ, оскільки вони залежать від конкретної молекулярної геометрії, стеричної об'ємності (наскільки велика молекула), розташування атомів, полярності та інших факторів. Якщо речовина містить молекули з більш сильними IMF, їй потрібно більше енергії, щоб розщепити молекули, що, як правило, означає, що матеріали з більш сильними IMF мають більш високі температури плавлення та більш високі температури кипіння.
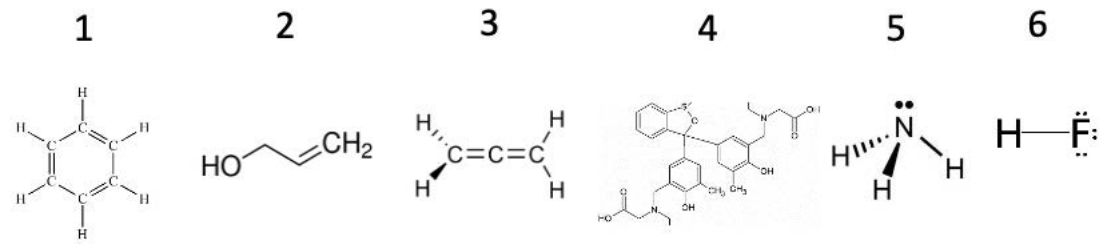
Приклад: Чи буде це\(\mathrm{H}\) -bond? Обведіть молекули, що утворюють водневі зв'язки в розчині.
- Відповідь
-
1. Ця молекула має кільце вуглецю, і кожен вуглець також пов'язаний з одним воднем. Немає\(\mathrm{H}-\mathrm{F}\), або\(\mathrm{H}-\mathrm{N}\) зв'язків\(\mathrm{H}-\mathrm{O}\), тому ця молекула не утворює\(\mathrm{H}\) -зв'язків.
2. Тут молекула показана в позначенні, типовому для органічної хімії: кожна вершина уздовж лінії, що з'єднує\(\mathrm{HO}\) і\(\mathrm{CH}_2\) містить атом вуглецю + атоми водню для завершення октету, а лінії, що з'єднують вершини, представляють зв'язки. Написано іншим способом, ця молекула є\(\mathrm{HO}-\mathrm{CH}_2-\mathrm{CH}=\mathrm{CH}_2\). Жодна з\(\mathrm{C}-\mathrm{H}\) зв'язків не бере участі у водневому зв'язку, але\(\mathrm{HO}\) групи утворюватимуть\(\mathrm{H}\) -зв'язки з іншими\(\mathrm{HO}\) групами!
3. Подібно до першої, ця молекула містить лише зв'язки між\(\mathrm{C}\) і\(\mathrm{H}\) атомами. Вона не буде утворювати\(\mathrm{H}\) облігацій.
4. З цією молекулою відбувається багато чого. Кільця тут мають таку ж структуру, як і кільце в 1: ви можете уявити, як заповнювати a\(\mathrm{C}\) на кожній вершині, а потім заповнювати,\(\mathrm{H}\) щоб заповнити октети. Ця молекула містить\(\mathrm{N}\), але всі\(\mathrm{N}\) атоми пов'язані лише з\(\mathrm{C}\): ці\(\mathrm{N}-\mathrm{C}\) групи не утворюватимуть\(\mathrm{H}\) зв'язків. Однак є деякі\(\mathrm{OH}\) групи: вони будуть утворювати\(\mathrm{H}\) -зв'язки з\(\mathrm{OH}\) групами на сусідніх молекулах!
5. Ви можете розпізнати цю молекулу як аміак. Тут\(\mathrm{N}\) атом безпосередньо пов'язаний з воднем. Ці\(\mathrm{N}-\mathrm{H}\) кінцеві групи будуть утворювати\(\mathrm{H}\) -облігації.
6. Нарешті, ця молекула плавикової кислоти просто\(\mathrm{H}-\mathrm{F}\). Тому він буде утворювати\(\mathrm{H}\) -облігації.