18.1: Періодичність
- Page ID
- 22558
- Класифікувати елементи
- Робіть прогнози про періодичність властивостей представницьких елементів
Ми починаємо цей розділ з вивчення поведінки репрезентативних металів стосовно їх позицій у періодичній таблиці. Першочерговим напрямком цього розділу буде застосування періодичності до репрезентативних металів.
Можна розділити елементи на групи за їх електронними конфігураціями. Представницькими елементами є елементи, де заповнюються s і p орбіталі. Перехідні елементи - це елементи, де заповнюються орбіталі d (групи 3-11 по таблиці Менделєєва), а внутрішні перехідні метали - елементи, де заповнюються орбіталі f. Орбіталі d заповнюються елементами групи 11; отже, елементи групи 12 кваліфікуються як репрезентативні елементи, оскільки останній електрон входить в орбітальну орбіту. Метали серед представницьких елементів є репрезентативні метали. Металевий характер є результатом здатності елемента втрачати зовнішні валентні електрони і призводить до високої теплової та електропровідності, серед інших фізичних та хімічних властивостей. Існує 20 нерадіоактивних репрезентативних металів у групах 1, 2, 3, 12, 13, 14 і 15 таблиці Менделєєва (елементи, затінені жовтим кольором на рис.\(\PageIndex{1}\)). Радіоактивні елементи коперніцій, флеровій, полоній та ліверморій також є металами, але виходять за рамки цієї глави.
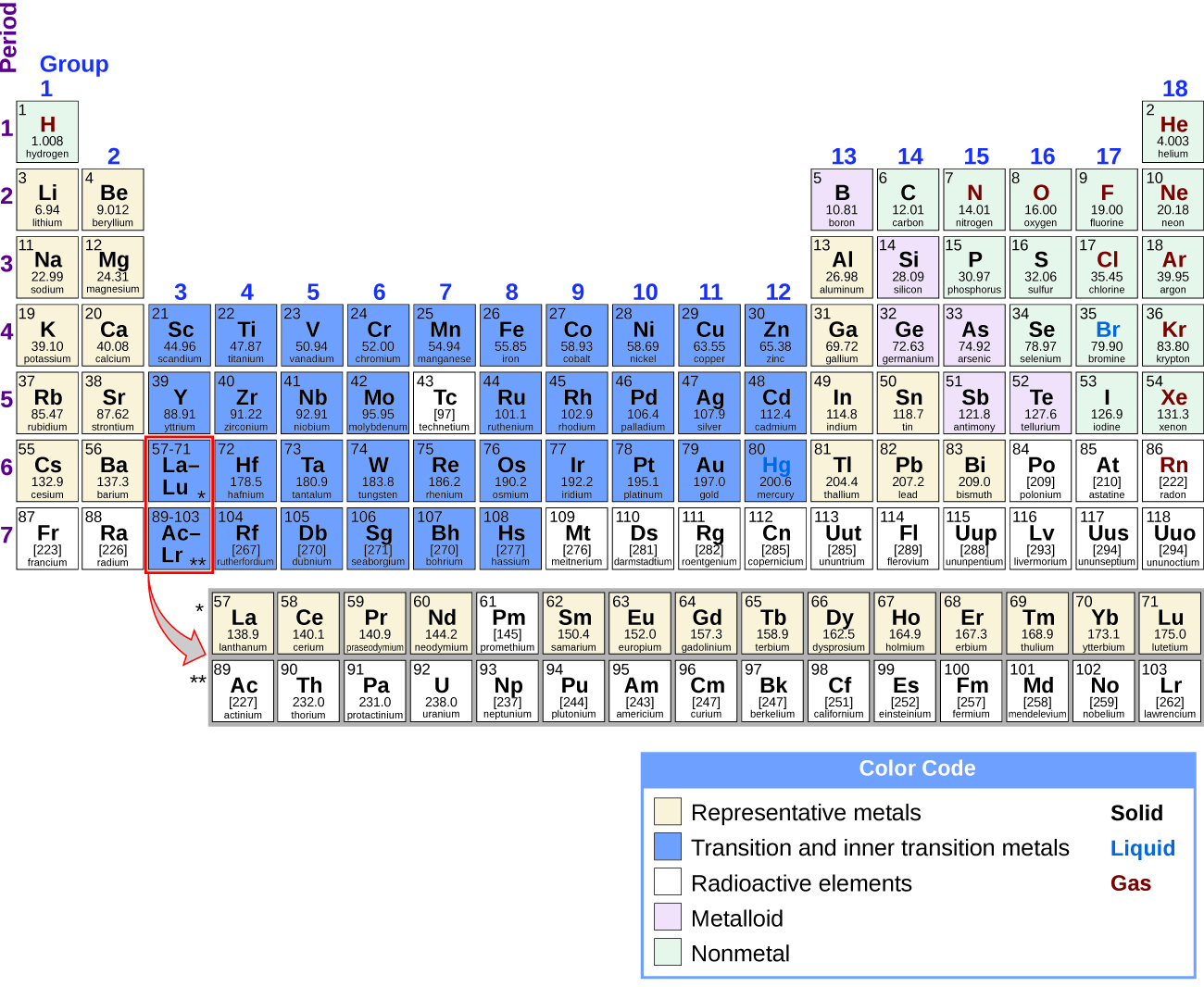
Крім представницьких металів, деякі з представницьких елементів є металоїдами. Металоїд - це елемент, який має властивості, які знаходяться між властивостями металів і неметалів; ці елементи, як правило, напівпровідники. Решта представницькі елементи - неметали. На відміну від металів, які зазвичай утворюють катіони та іонні сполуки (що містять іонні зв'язки), неметали мають тенденцію до утворення аніонів або молекулярних сполук. Загалом, поєднання металу і неметалу виробляє сіль. Сіль - це іонне з'єднання, що складається з катіонів і аніонів.
Сіль - це іонне з'єднання, що складається з катіонів і аніонів.
Більшість представницьких металів не зустрічаються природним шляхом в некомбінованому стані, оскільки вони легко реагують з водою і киснем в повітрі. Однак можна виділити елементарний берилій, магній, цинк, кадмій, ртуть, алюміній, олово та свинець із природних мінералів та використовувати їх, оскільки вони дуже повільно реагують з повітрям. Частина причини, чому ці елементи реагують повільно, полягає в тому, що ці елементи реагують з повітрям, утворюючи захисне покриття. Освіта цього захисного покриття - пасивація. Покриття являє собою нереактивну плівку оксиду або якогось іншого з'єднання. Елементарний магній, алюміній, цинк та олово важливі при виготовленні багатьох звичних предметів, включаючи дріт, посуд, фольгу та багато побутових та особистих предметів. Хоча берилій, кадмій, ртуть та свинець легко доступні, існують обмеження в їх застосуванні через їх токсичність.
Група 1: Лужні метали
Лужні метали літій, натрій, калій, рубідій, цезій і францій складають групу 1 таблиці Менделєєва. Хоча водень знаходиться в групі 1 (а також у групі 17), він є неметалом і заслуговує окремого розгляду пізніше в цьому розділі. Назва лужний метал відноситься до того, що ці метали та їх оксиди вступають в реакцію з водою з утворенням дуже основних (лужних) розчинів.
Властивості лужних металів схожі один на одного, як очікується для елементів одного сімейства. Лужні метали мають найбільші атомні радіуси і найнижчу першу енергію іонізації за свої періоди. Ця комбінація дозволяє дуже легко видалити єдиний електрон у зовнішній (валентній) оболонці кожного. Легка втрата цього валентного електрона означає, що ці метали легко утворюють стабільні катіони із зарядом 1+. Їх реактивність зростає зі збільшенням атомного номера за рахунок легкості втрати одинокого валентного електрона (зменшення енергії іонізації). Оскільки окислення відбувається так легко, зворотне, відновлення, важко, що пояснює, чому важко ізолювати елементи. Тверді лужні метали дуже м'які; літій, показаний на малюнку\(\PageIndex{2}\), має найменшу щільність будь-якого металу (0,5 г/см 3).

Всі лужні метали енергійно реагують з водою з утворенням водневого газу та основного розчину гідроксиду металу. Це означає, що вони легше окислюються, ніж водню. Як приклад, реакція літію з водою така:
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
Лужні метали безпосередньо реагують з усіма неметалами (крім благородних газів), утворюючи бінарні іонні сполуки, що містять 1+ іони металів. Ці метали настільки реактивні, що необхідно уникати контакту як з вологою, так і з киснем повітря. Тому їх зберігають в герметичних ємностях під мінеральним маслом, як показано на малюнку\(\PageIndex{3}\), для запобігання контакту з повітрям і вологою. Чисті метали ніколи не існують вільних (некомбінованих) в природі через їх високу реакційну здатність. Крім того, така висока реакційна здатність змушує готувати метали електролізом сполук лужних металів.

На відміну від багатьох інших металів, реакційна здатність і м'якість лужних металів роблять ці метали непридатними для структурних застосувань. Однак є застосування, де реакційна здатність лужних металів є перевагою. Наприклад, виробництво таких металів, як титан і цирконій, частково покладається на здатність натрію відновлювати сполуки цих металів. Виробництво багатьох органічних сполук, включаючи певні барвники, ліки та парфуми, використовує зменшення літієм або натрієм.
Натрій і його сполуки надають полум'я яскраво-жовтий колір, як видно на малюнку\(\PageIndex{4}\). Проходження електричного розряду через пари натрію також виробляє цей колір. В обох випадках це приклад спектра випромінювання, розглянутого в розділі про електронну структуру. Вуличні ліхтарі колись використовують вогні з парами натрію, оскільки пари натрію проникають в туман краще, ніж більшість інших світла. Це тому, що туман не розсіює жовте світло так сильно, як розсіює біле світло. Інші лужні метали та їх солі також надають колір полум'я. Літій створює яскравий, малиновий колір, тоді як інші створюють блідий, фіолетовий колір.
Відео\(\PageIndex{1}\): Це відео демонструє реакції лужних металів з водою.
Група 2: Лужноземельні метали
Лужноземельні метали (берилій, магній, кальцій, стронцій, барій, радій) складають групу 2 таблиці Менделєєва. Назва лужний метал походить від того, що оксиди більш важких членів групи вступають в реакцію з водою з утворенням лужних розчинів. Ядерний заряд збільшується при переході з групи 1 в групу 2. Через це збільшення заряду атоми лужноземельних металів менше і мають вищі перші енергії іонізації, ніж лужні метали протягом того ж періоду. Більш висока енергія іонізації робить лужноземельні метали менш реактивними, ніж лужні метали; однак вони все ще є дуже реактивними елементами. Їх реактивність зростає, як і очікувалося, зі збільшенням розмірів і зменшенням енергії іонізації. У хімічних реакціях ці метали легко втрачають обидва валентні електрони, утворюючи сполуки, в яких вони проявляють ступінь окислення 2+. Через їх високу реакційну здатність зазвичай виробляють лужноземельні метали, як лужні метали, електролізом. Незважаючи на те, що енергії іонізації низькі, два метали з найвищими енергіями іонізації (берилій і магній) утворюють сполуки, які демонструють деякі ковалентні символи. Як і лужні метали, важчі лужноземельні метали надають колір полум'я. Як і у випадку з лужними металами, це частина спектра випромінювання цих елементів. Кальцій і стронцій виробляють відтінки червоного, тоді як барій виробляє зелений колір.
Магній - сріблясто-білий метал, який ковкий і пластичний при високих температурах. Пасивація знижує реакційну здатність металу магнію. При впливі повітря на поверхні металу утворюється щільно прилиплий шар оксикарбонату магнію і гальмує подальшу реакцію. (Карбонат надходить від реакції вуглекислого газу в атмосфері.) Магній є найлегшим з широко використовуваних конструкційних металів, саме тому більшість виробництва магнію припадає на легкі сплави.
Магній (рис.\(\PageIndex{5}\)), кальцій, стронцій, барій вступають в реакцію з водою і повітрям. При кімнатній температурі барій проявляє найбільш енергійну реакцію. Продукти реакції з водою - водень і гідроксид металу. Утворення водневого газу свідчить про те, що важчі лужноземельні метали є кращими відновниками (легше окислюються), ніж водень. Як і очікувалося, ці метали реагують як з кислотами, так і з неметалами з утворенням іонних сполук. На відміну від більшості солей лужних металів, багато загальних солей лужноземельних металів нерозчинні у воді через високі енергії решітки цих сполук, що містять іон двовалентного металу.

Потужна відновлювальна сила гарячого магнію корисна при отриманні деяких металів з їх оксидів. Дійсно, спорідненість магнію до кисню настільки велика, що спалювання магнію реагує з вуглекислим газом, виробляючи елементарний вуглець:
\[\ce{2Mg}(s)+\ce{CO2}(g)⟶\ce{2MgO}(s)+\ce{C}(s) \nonumber \]
З цієї причини вогнегасник СО 2 не буде гасити магнієвий вогонь. Крім того, блискуче біле світло, що випромінюється спалюванням магнію, робить його корисним у спалахах та феєрверках.
Група 12 Метали
Елементи в групі 12 є перехідними елементами; однак останній доданий електрон - це не d електрон, а електронний. Оскільки останній доданий електрон є електроном, ці елементи кваліфікуються як репрезентативні метали або пост-перехідні метали. Елементи групи 12 поводяться більше як лужноземельні метали, ніж перехідні метали. Група 12 містить чотири елементи: цинк, кадмій, ртуть і коперніцій. Кожен з цих елементів має в своїй зовнішній оболонці два електрона (ns 2). Коли атоми цих металів утворюють катіони із зарядом 2+, де втрачаються два зовнішні електрони, вони мають псевдоблагородні газові електронні конфігурації. Ртуть іноді є винятком, оскільки вона також демонструє ступінь окислення 1+ у сполуках, що містять двоатомний\(\ce{Hg2^2+}\) іон. У своїх елементарних формах і в сполуках кадмій і ртуть є токсичними.
Цинк є найбільш реактивним в групі 12, а ртуть - найменш реактивною. (Це зворотна тенденція реактивності металів груп 1 і 2, в якій реакційна здатність зростає вниз групи. Збільшення реактивності зі збільшенням атомного номера відбувається лише для металів у групах 1 і 2.) Зниження реактивності обумовлено утворенням іонів з псевдоблагородною газовою конфігурацією та іншими факторами, які виходять за рамки цієї дискусії. Хімічна поведінка цинку та кадмію досить схожі один на одного, але відрізняються від поведінки ртуті.
Цинк і кадмій мають менші потенціали відновлення, ніж водень, і, як і лужні метали та лужноземельні метали, вони будуть виробляти газ водню, коли вони реагують з кислотами. Реакція цинку з соляною кислотою, показана на малюнку\(\PageIndex{6}\), становить:

Цинк - сріблястий метал, який швидко тьмяніє до синьо-сірого вигляду. Така зміна кольору обумовлена прилиплим покриттям основного карбонату Zn 2 (OH) 2 CO 3, яке пасивує метал для пригнічення подальшої корозії. Сухоклітинні і лужні батареї містять цинковий анод. Латунь (Cu і Zn) і деякі бронзи (Cu, Sn, а іноді і Zn) є важливими сплавами цинку. Близько половини виробництва цинку служить для захисту заліза та інших металів від корозії. Цей захист може мати форму жертовного анода (також відомого як гальванічний анод, який є засобом забезпечення катодного захисту різних металів) або у вигляді тонкого покриття на захищеному металі. Оцинкована сталь - це сталь із захисним покриттям з цинку.
жертовні аноди
Жертовний анод, або гальванічний анод, є засобом забезпечення катодного захисту різних металів. Катодний захист відноситься до запобігання корозії шляхом перетворення корозійного металу в катод. Як катод метал протистоїть корозії, яка є процесом окислення. Корозія відбувається на жертовному аноді, а не на катоді.
Будівництво такої системи починається з приєднання більш активного металу (більше негативного відновного потенціалу) до металу, який потребує захисту. Кріплення може бути прямим або за допомогою дроту. Для завершення схеми необхідний соляний міст. Цей соляний міст часто є морською або грунтовою водою. Після завершення ланцюга відбувається окислення (корозія) на аноді, а не катоді.
Зазвичай використовуваними жертовними анодами є магній, алюміній та цинк. Магній має найбільш негативний потенціал відновлення з трьох і найкраще служить, коли сольовий міст менш ефективний через низьку концентрацію електроліту, наприклад, у прісноводній воді. Цинк і алюміній працюють краще в морській воді, ніж магній. Алюміній легше цинку і має більш високу ємність; однак оксидне покриття може пасивувати алюміній. В особливих випадках знадобляться і інші матеріали. Наприклад, залізо захистить мідь.
Ртуть сильно відрізняється від цинку і кадмію. Ртуть - єдиний метал, який є рідким при 25° C. багато металів розчиняються в ртуті, утворюючи розчини, звані амальгами (див. Особливість на Амальгамах), які є сплавами ртуті з одним або декількома іншими металами. Ртуть, показана на малюнку\(\PageIndex{7}\), є нереактивним елементом, який більш важко окислюється, ніж водень. Таким чином, він не витісняє водень з кислот; однак він буде реагувати з сильними окислювальними кислотами, такими як азотна кислота:
\[\ce{Hg}(l)+\ce{HCl}(aq)⟶\textrm{no reaction} \nonumber \]
\[\ce{3Hg}(l)+\ce{8HNO3}(aq)⟶\ce{3Hg(NO3)2}(aq)+\ce{4H2O}(l)+\ce{2NO}(g) \nonumber \]
Прозорий NO спочатку утворюється швидко піддається подальшому окисленню до червонувато-коричневого NO 2.

Більшість сполук ртуті розкладаються при нагріванні. Більшість сполук ртуті містять ртуть зі ступенем окислення 2+. При великому надлишку ртуті можливе утворення сполук, що містять\(\ce{Hg2^2+}\) іон. Всі сполуки ртуті токсичні, і необхідно проявляти велику обережність в їх синтезі.
Амальгама - це сплав ртуті з одним або декількома іншими металами. Це схоже на те, щоб вважати сталь сплавом заліза з іншими металами. Більшість металів утворюють амальгаму з ртуттю, за основними винятками є залізо, платина, вольфрам та тантал. Через проблеми токсичності ртуті спостерігається значне зменшення використання амальгам. Історично склалося, що амальгами були важливі в електролітичних комірках і при видобутку золота. Амальгами лужних металів все ще знаходять застосування, оскільки вони є сильними відновниками і легше обробляти, ніж чисті лужні метали. У старателей виникла проблема, коли вони знайшли дрібнодисперсне золото. Вони дізналися, що додавання ртуті в свої каструлі збирає золото в ртуть, щоб утворити амальгаму для полегшення збору. На жаль, втрати невеликої кількості ртуті протягом багатьох років залишили багато потоків у Каліфорнії забрудненими ртуттю. Стоматологи використовують амальгами, що містять срібло та інші метали для заповнення порожнин. Є кілька причин використовувати амальгаму, включаючи низьку вартість, простоту маніпуляції та довговічність порівняно з альтернативними матеріалами. Зубні амальгами складають приблизно 50% ртуті за вагою, що в останні роки стало занепокоєнням через токсичність ртуті.
Ознайомившись з найкращими наявними даними, Управління з контролю за продуктами та ліками (FDA) вважає пломби на основі амальгами безпечними для дорослих та дітей старше шести років. Навіть при декількох пломбах рівень ртуті у пацієнтів залишається набагато нижче найнижчих рівнів, пов'язаних із шкодою. Клінічні дослідження не виявили зв'язку між стоматологічними амальгами та проблемами зі здоров'ям. Проблеми зі здоров'ям можуть бути неоднаковими у випадках дітей до шести років або вагітних жінок. Висновки FDA відповідають думкам Агентства з охорони навколишнього середовища (EPA) та Центрів контролю захворювань (CDC). Єдине, що відзначається здоров'я, - це те, що деякі люди мають алергію на амальгаму або один з її компонентів.
Група 13
13 група містить металоїдний бор і метали алюміній, галій, індій і талій. Найлегший елемент, бор, є напівпровідниковим, а його бінарні сполуки, як правило, ковалентні, а не іонні. Решта елементів групи - метали, але їх оксиди і гідроксиди змінюють характер. Оксиди та гідроксиди алюмінію та галію проявляють як кислотну, так і основну поведінку. Речовина, така як ці дві, яка буде реагувати як з кислотами, так і з підставами, є амфотерною. Ця характеристика ілюструє поєднання неметалевої та металевої поведінки цих двох елементів. Оксиди і гідроксиди індію і талію проявляють лише основну поведінку, відповідно до чітко металевим характером цих двох елементів. Температура плавлення галію надзвичайно низька (близько 30° C) і буде танути у вашій руці.
Алюміній є амфотерним, оскільки реагує як з кислотами, так і з підставами. Типовою реакцією з кислотою є:
\[\ce{2Al}(s)+\ce{6HCl}(aq)⟶\ce{2AlCl3}(aq)+\ce{3H2}(g) \nonumber \]
Продукти реакції алюмінію з основою залежать від умов реакції, при цьому одна з можливостей:
\[\ce{2Al}(s)+\ce{2NaOH}(aq)+\ce{6H2O}(l)⟶\ce{2Na[Al(OH)4]}(aq)+\ce{3H2}(g) \nonumber \]
Як з кислотами, так і з основами реакція з алюмінієм генерує газ водню.
Елементи групи 13 мають електронну конфігурацію валентної оболонки ns 2 np 1. Алюміній зазвичай використовує всі свої валентні електрони, коли він реагує, даючи сполуки, в яких він має ступінь окислення 3+. Хоча багато з цих сполук є ковалентними, інші, такі як AlF 3 і Al 2 (SO 4) 3, є іонними. Водні розчини солей алюмінію містять катіон\(\ce{[Al(H2O)6]^3+}\), скорочено Al 3 + (aq). Галій, індій та талій також утворюють іонні сполуки, що містять іони M 3+. Ці три елементи демонструють не тільки очікуваний ступінь окислення 3+ від трьох валентних електронів, але і ступінь окислення (в даному випадку 1+), що на два нижче очікуваного значення. Це явище, ефект інертної пари, відноситься до утворення стабільного іона зі ступенем окислення на два нижче, ніж очікувалося для групи. Пара електронів - орбітальна валентність s для цих елементів. Взагалі, ефект інертної пари важливий для нижніх p -блокових елементів. У водному розчині іон Tl + (aq) більш стійкий, ніж Tl 3 + (aq). Загалом, ці метали будуть реагувати з повітрям і водою з утворенням 3+ іонів; однак таллій реагує на отримання похідних талію (I). Метали групи 13 реагують безпосередньо з неметалами, такими як сірка, фосфор та галогени, утворюючи бінарні сполуки.
Метали групи 13 (Al, Ga, In і Tl) є реактивними. Однак пасивація відбувається як жорстка, тверда, тонка плівка оксиду металу утворюється при впливі повітря. Порушення цієї плівки може протистояти пасивації, дозволяючи металу вступити в реакцію. Один із способів зірвати плівку - піддавати пасивований метал ртуті. Частина металу розчиняється в ртуті, утворюючи амальгаму, яка проливає захисний оксидний шар, щоб піддати метал подальшій реакції. Освіта амальгами дозволяє металу вступати в реакцію з повітрям і водою.
Відео\(\PageIndex{2}\): Хоча легко окислюється, пасивація алюмінію робить його дуже корисним як міцний, легкий будівельний матеріал. Через утворення амальгами ртуть піддається корозії до конструкційних матеріалів з алюмінію. Це відео демонструє, як цілісність алюмінієвого бруса може бути зруйнована додаванням невеликої кількості елементарної ртуті.
Найважливіше використання алюмінію - у будівельній та транспортній галузях, а також у виробництві алюмінієвих банок та алюмінієвої фольги. Ці види використання залежать від легкості, в'язкості та міцності металу, а також його стійкості до корозії. Оскільки алюміній є відмінним провідником тепла і протистоїть корозії, він стане в нагоді при виготовленні кухонного посуду.
Алюміній є дуже хорошим відновником і може замінити інші відновники при виділенні деяких металів з їх оксидів. Хоча і дорожче, ніж відновлення вуглецем, алюміній важливий для ізоляції Mo, W і Cr від їх оксидів.
Група 14
Металевими членами групи 14 є олово, свинець і флеровій. Вуглець - типовий неметал. Решта елементи групи, кремній і германій, є прикладами напівметалів або металоїдів. Олово і свинець утворюють стабільні двовалентні катіони, Sn 2 + і Pb 2 +, зі ступенями окислення два нижче ступеня окислення групи 4+. Стабільність цього ступеня окислення є наслідком впливу інертної пари. Олово і свинець також утворюють ковалентні сполуки з формальним 4+-окисленням. Наприклад, SnCl 4 і PbCl 4 - низькокиплячі ковалентні рідини.

Олово легко реагує з неметалами та кислотами, утворюючи сполуки олова (II) (вказуючи на те, що воно легше окислюється, ніж водень) і з неметалами з утворенням сполук олова (II) або олова (IV\(\PageIndex{8}\)) (рис.), залежно від стехіометрії та умов реакції. Свинець менш реактивний. Він лише трохи легше окислюється, ніж водень, а для окислення зазвичай потрібна гаряча концентрована кислота.
Багато з цих елементів існують у вигляді алотропів. Аллотропи - це дві і більше форми одного і того ж елемента в одному фізичному стані з різними хімічними і фізичними властивостями. Існує два поширених аллотропа олова. Ці аллотропи - сіре (крихке) олово та біле олово. Як і у випадку з іншими аллотропами, різниця між цими формами олова полягає в розташуванні атомів. Біле олово стабільне вище 13,2° C і ковке, як і інші метали. При низьких температурах сіре олово є більш стійкою формою. Сіре олово крихке і має тенденцію руйнуватися до порошку. Отже, вироби з олова будуть розпадатися в холодну погоду, особливо якщо холод тривалий. Зміна повільно прогресує від місця походження, а сіре олово, яке вперше утворюється, каталізує подальші зміни. У певному сенсі цей ефект схожий з поширенням інфекції в організмі рослини або тварини, змушуючи людей називати цей процес хворобою олова або жерстяним шкідником.
Основне використання олова полягає в покритті сталі для формування олов'яного листового заліза, який становить олово в жерстяних банках. Важливими сплавами олова є бронза (Cu і Sn) і припій (Sn і Pb). Свинець важливий у свинцевих акумуляторних батареях в автомобілі.
Група 15
Вісмут, найважчий член групи 15, є менш реактивним металом, ніж інші репрезентативні метали. Він легко віддає три з п'яти валентних електронів активним неметалам, утворюючи трипозитивний іон, Bi 3 +. Утворює сполуки з груповим ступенем окислення 5+ тільки при обробці сильними окислювачами. Стабільність стану 3+-окислення - ще один приклад ефекту інертної пари.
Резюме
У цьому розділі основна увага приділяється періодичності представницьких елементів. Це елементи, де електрони надходять на s і p орбіталі. Представницькі елементи зустрічаються в групах 1, 2 і 12-18. Ці елементи є репрезентативними металами, металоїдами та неметалами. Лужні метали (група 1) дуже реактивні, легко утворюють іони із зарядом 1+, утворюючи іонні сполуки, які зазвичай розчинні у воді, і енергійно реагують з водою з утворенням водневого газу та основного розчину гідроксиду металу. Найвіддаленіші електрони лужноземельних металів (група 2) важче видалити, ніж зовнішній електрон лужних металів, що призводить до того, що метали групи 2 менш реактивні, ніж ті, що знаходяться в групі 1. Ці елементи легко утворюють сполуки, в яких метали проявляють ступінь окислення 2+. Цинк, кадмій та ртуть (група 12) зазвичай демонструють ступінь окислення групи 2+ (хоча ртуть також демонструє ступінь окислення 1+ у сполуках, які містять\(\ce{Hg2^2+}\)). Алюміній, галій, індій і талій (група 13) легше окислюються, ніж водень. Алюміній, галій та індій відбуваються зі ступенем окислення 3+ (однак талій також зазвичай зустрічається як іон Tl +). Олово та свинець утворюють стабільні двовалентні катіони та ковалентні сполуки, в яких метали виявляють ступінь окислення 4+-.
Глосарій
- лужноземельний метал
- будь-який з металів (берилій, магній, кальцій, стронцій, барій і радій), що займають 2 групу таблиці Менделєєва; це реактивні, двовалентні метали, які утворюють основні оксиди
- алотропи
- дві або більше форм одного елемента, в одному фізичному стані, з різною хімічною структурою
- вісмут
- найважчий член групи 15; менш реактивний метал, ніж інші репрезентативні метали
- метал (представник)
- атоми металевих елементів груп 1, 2, 12, 13, 14, 15 і 16, які утворюють іонні сполуки, втрачаючи електрони з їх зовнішніх s або p орбіталів
- металоїд
- елемент, який має властивості, які знаходяться між властивостями металів і неметалів; ці елементи, як правило, напівпровідники
- пасивація
- метали із захисною нереактивною плівкою оксиду або іншої сполуки, що створює бар'єр для хімічних реакцій; фізичне або хімічне видалення пасивуючої плівки дозволяє металам продемонструвати свою очікувану хімічну реакційну здатність
- представник елемент
- елемент, де s і p орбіталі заповнюються
- представник метал
- метал серед представницьких елементів
