8.4: Теорія молекулярної орбіти
- Page ID
- 22439
- Окреслення базового квантово-механічного підходу до отримання молекулярних орбіталів з атомних орбіталів
- Охарактеризуйте ознаки склеювання та антизв'язуючих молекулярних орбіталів
- Обчислення зв'язків на основі молекулярних електронних конфігурацій
- Запишіть молекулярні електронні конфігурації для двоатомних молекул першого та другого ряду
- Пов'язати ці електронні конфігурації зі стійкістю молекул та магнітними властивостями
Майже для кожної існуючої ковалентної молекули ми можемо намалювати структуру Льюїса, передбачити геометрію електронної пари, передбачити молекулярну геометрію та наблизитися до прогнозування кутів зв'язку. Однак одна з найважливіших молекул, яку ми знаємо, молекула кисню O 2, представляє проблему щодо її структури Льюїса. Ми б написали таку структуру Льюїса для O 2:
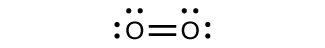
Ця електронна структура дотримується всіх правил, що регулюють теорію Льюїса. Існує подвійний зв'язок O = O, і кожен атом кисню має вісім електронів навколо нього. Однак ця картина розходиться з магнітною поведінкою кисню. Сам по собі О 2 не магнітний, але притягується до магнітних полів. Таким чином, коли ми заливаємо рідкий кисень повз сильного магніту, він збирається між полюсами магніту і кидає виклик гравітації. Таке тяжіння до магнітного поля називається парамагнетизмом, і виникає воно в молекулах, які мають непарні електрони. І все ж структура Льюїса О 2 вказує на те, що всі електрони парні. Як ми враховуємо цю невідповідність?
Магнітна сприйнятливість вимірює силу, яку відчуває речовина в магнітному полі. Коли ми порівнюємо вагу зразка з вагою, виміряною в магнітному полі (рис.\(\PageIndex{1}\)), парамагнітні зразки, які притягуються до магніту, будуть здаватися важчими через силу, що чиниться магнітним полем. Число непарних електронів ми можемо обчислити виходячи зі збільшення ваги.
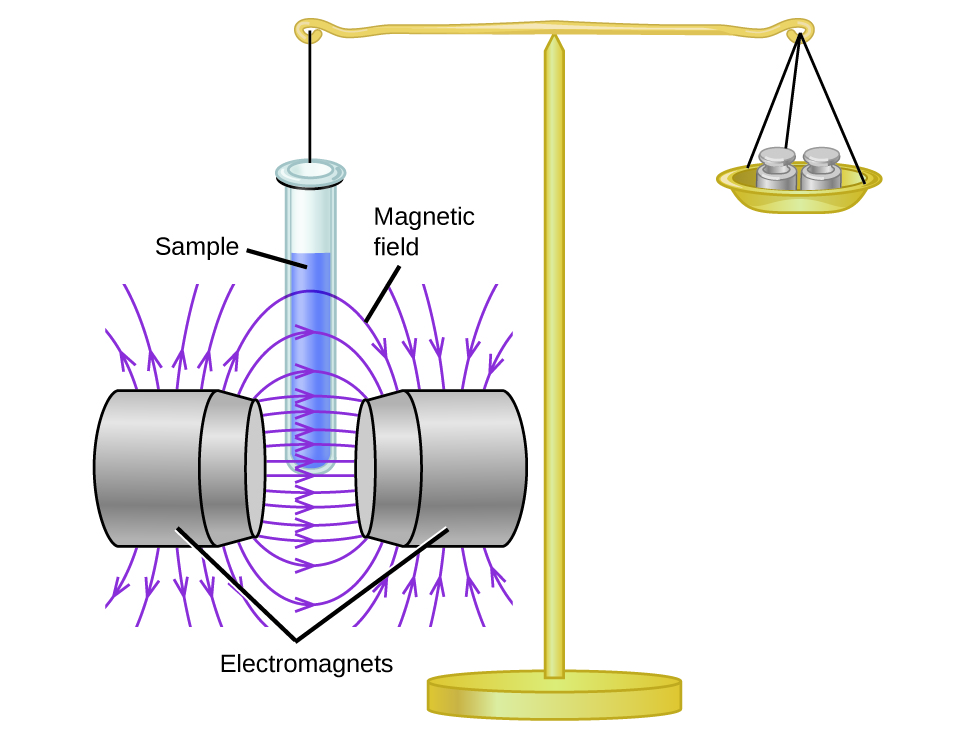
Експерименти показують, що кожна молекула O 2 має два непарних електрона. Модель структури Льюїса не передбачає наявність цих двох непарних електронів. На відміну від кисню, видима вага більшості молекул трохи зменшується при наявності неоднорідного магнітного поля. Матеріали, в яких всі електрони спарені, діамагнітні і слабо відштовхують магнітне поле. Парамагнітні та діамагнітні матеріали не діють як постійні магніти. Тільки при наявності прикладеного магнітного поля вони демонструють тяжіння або відштовхування.
Молекулярна орбітальна теорія (теорія МО) дає пояснення хімічного зв'язку, що пояснює парамагнетизм молекули кисню. Він також пояснює зв'язок у ряді інших молекул, таких як порушення правила октету та більше молекул з більш складним зв'язком (за межами цього тексту), які важко описати структурами Льюїса. Крім того, він надає модель для опису енергій електронів у молекулі та ймовірного розташування цих електронів. На відміну від теорії валентних зв'язків, яка використовує гібридні орбіталі, призначені одному конкретному атому, теорія МО використовує комбінацію атомних орбіталів для отримання молекулярних орбіталів, які делокалізовані по всій молекулі, а не локалізуються на її складових атомах. Теорія МО також допомагає нам зрозуміти, чому одні речовини є електричними провідниками, інші - напівпровідниками, а треті - ізоляторами. Таблиця\(\PageIndex{1}\) узагальнює основні моменти двох взаємодоповнюючих теорій зв'язку. Обидві теорії надають різні, корисні способи опису молекулярної структури.
| Теорія валентних зв'язків | Теорія молекулярної орбіти |
|---|---|
| розглядає зв'язки як локалізовані між однією парою атомів | розглядає електрони, делокалізовані по всій молекулі |
| створює зв'язки з перекриття атомних орбіталів (s, p, d...) та гібридних орбіталів (sp, sp 2, sp 3...) | об'єднує атомні орбіталі з утворенням молекулярних орбіталів (σ, σ, π, π*) |
| утворює σ або π зв'язки | створює зв'язуючі та антизв'язуючі взаємодії, на основі яких заповнюються орбіталі |
| прогнозує молекулярну форму на основі кількості областей електронної густини | прогнозує розташування електронів в молекулах |
| потрібні кілька структур для опису резонансу |
Молекулярна орбітальна теорія описує розподіл електронів в молекулах приблизно так само, як розподіл електронів в атомах описується за допомогою атомних орбіталей. Використовуючи квантову механіку, поведінка електрона в молекулі все ще описується хвильовою функцією,, аналогічною поведінці в атомі. Так само, як електрони навколо ізольованих атомів, електрони навколо атомів в молекулах обмежені дискретними (квантованими) енергіями. Область простору, в якій, ймовірно, знаходиться валентний електрон у молекулі, називається молекулярною орбіталлю (ψ 2). Як і атомна орбіталь, молекулярна орбіталь заповнена, коли вона містить два електрони з протилежним спіном.
Ми розглянемо молекулярні орбіталі в молекулах, що складаються з двох однакових атомів (H 2 або Cl 2, наприклад). Такі молекули називаються гоядерними двоатомними молекулами. У цих двоатомних молекулах зустрічається кілька типів молекулярних орбіталей.
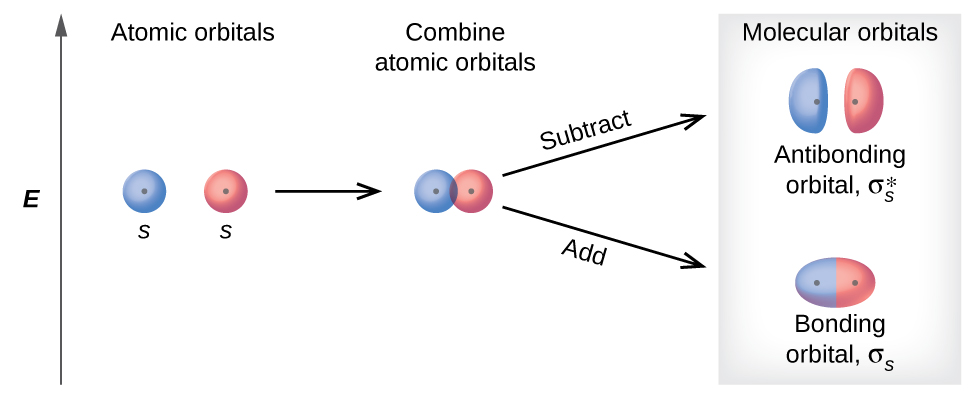
Математичний процес об'єднання атомних орбіталів для генерації молекулярних орбіталів називається лінійною комбінацією атомних орбіталів (LCAO). Хвильова функція описує хвилеподібні властивості електрона. Молекулярні орбіталі - це комбінації атомно-орбітальних хвильових функцій. Поєднання хвиль може призвести до конструктивного втручання, при якому піки шикуються з піками, або руйнівним перешкодам, при яких піки шикуються жолобами (рис.\(\PageIndex{2}\)). На орбіталах хвилі є тривимірними, і вони поєднуються з інфазовими хвилями, що виробляють області з більшою ймовірністю електронної щільності та позафазових хвиль, що утворюють вузли, або області без електронної щільності.

Існує два типи молекулярних орбіталів, які можуть утворюватися від перекриття двох атомних орбіталів на сусідніх атомах. Два типи проілюстровані на малюнку\(\PageIndex{3}\). Поєднання в фазі виробляє нижчу енергію σ s молекулярної орбіталі (читається як «сигма-с»), в якій більша частина електронної щільності знаходиться безпосередньо між ядрами. Позафазове додавання (яке також можна розглядати як віднімання хвильових функцій) виробляє більш високу енергію\(σ^∗_s\) m молекулярної орбіталі (читається як «сигма-с-зірка») молекулярна орбіталь, в якій між ядрами є вузол. Зірочка означає, що орбіта є антізв'язуючою орбітою. Електрони в орбіталі σ s притягуються обома ядрами одночасно і є більш стабільними (меншої енергії), ніж вони були б в ізольованих атомах. Додавання електронів до цих орбіталів створює силу, яка утримує два ядра разом, тому ми називаємо ці орбіталі, що зв'язують орбіталі. Електрони на\(σ^∗_s\) орбіталі розташовані далеко від області між двома ядрами. Приваблива сила між ядрами і цими електронами витягує два ядра один від одного. Отже, ці орбіталі називаються антібондинговими орбіталями. Електрони заповнюють орбіту зв'язку нижчої енергії перед орбіталлю антизв'язування вищої енергії, так само, як вони заповнюють атомні орбіталі нижчої енергії, перш ніж вони заповнюють атомні орбіталі вищої енергії.
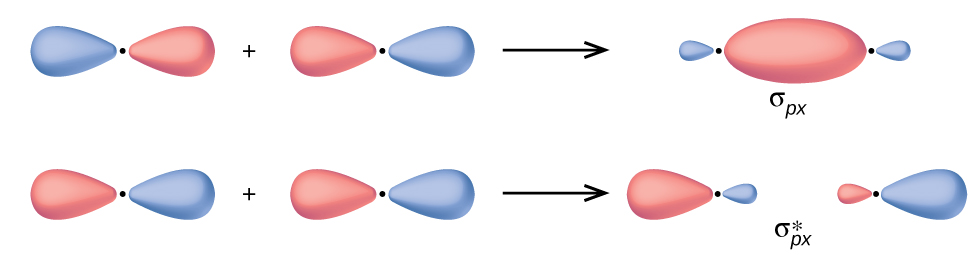
У p орбіталів хвильова функція породжує дві частки з протилежними фазами, аналогічно тому, як двовимірна хвиля має обидві частини вище і нижче середнього. Ми вказуємо фази, затінюючи орбітальні частки різними кольорами. Коли орбітальні частки однієї фази перекриваються, конструктивна хвильова інтерференція збільшує електронну щільність. Коли області протилежної фази перекриваються, руйнівна хвильова інтерференція зменшує електронну щільність і створює вузли. Коли p орбіталі перекриваються кінець в кінець, вони створюють σ і σ* орбіталі (рис.\(\PageIndex{4}\)). Якщо два атоми розташовані вздовж осі x в декартовій системі координат, дві орбіталі p x перекриваються кінець в кінець і утворюють σ px (зв'язок) і\(σ^∗_{px}\) (антізв'язування) (читається як «сигма-p-x» та «зірка сигма-p-x» відповідно). Так само, як і при s -орбітальному перекритті, зірочка вказує на орбіту з вузлом між ядрами, який є більш високою енергією, антизв'язуючою орбітою.
The side-by-side overlap of two p orbitals gives rise to a pi (\(π\)) bonding molecular orbital and a \(π^*\) antibonding molecular orbital, as shown in Figure \(\PageIndex{5}\). In valence bond theory, we describe π bonds as containing a nodal plane containing the internuclear axis and perpendicular to the lobes of the p orbitals, with electron density on either side of the node. In molecular orbital theory, we describe the π orbital by this same shape, and a π bond exists when this orbital contains electrons. Electrons in this orbital interact with both nuclei and help hold the two atoms together, making it a bonding orbital. For the out-of-phase combination, there are two nodal planes created, one along the internuclear axis and a perpendicular one between the nuclei.
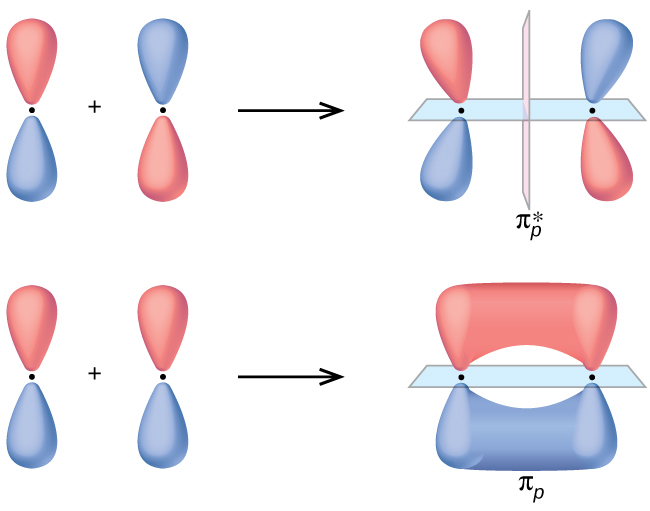
In the molecular orbitals of diatomic molecules, each atom also has two sets of p orbitals oriented side by side (py and pz), so these four atomic orbitals combine pairwise to create two π orbitals and two \(π^*\) orbitals. The \(π_{py}\) and \(π^∗_{py}\) orbitals are oriented at right angles to the \(π_{pz}\) and \(π^∗_{pz}\) orbitals. Except for their orientation, the πpy and πpz orbitals are identical and have the same energy; they are degenerate orbitals. The \(π^∗_{py}\) and \(π^∗_{pz}\) antibonding orbitals are also degenerate and identical except for their orientation. A total of six molecular orbitals results from the combination of the six atomic p orbitals in two atoms: \(σ_{px}\) and \(σ^∗_{px}\), \(π_{py}\) and \(π^∗_{py}\), \(π_{pz}\) and \(π^∗_{pz}\).
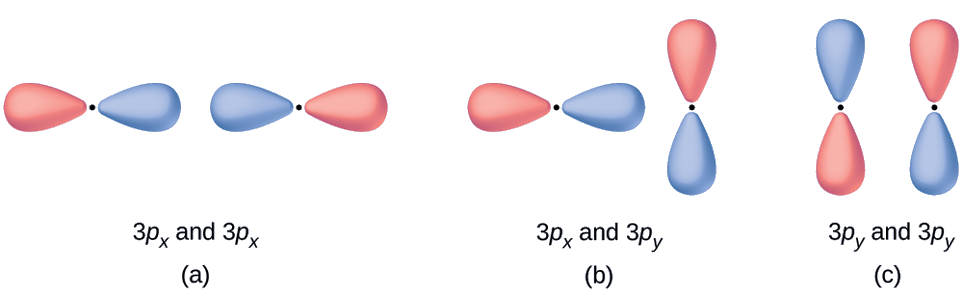
Predict what type (if any) of molecular orbital would result from adding the wave functions so each pair of orbitals shown overlap. The orbitals are all similar in energy.
Рішення
- Це інфазна комбінація, в результаті чого в σ 3 р орбіталі
- Це не призведе до нової орбіти, оскільки внутрішньофазовий компонент (знизу) та позафазовий компонент (зверху) скасовуються. Комбінувати можуть тільки орбіталі при правильному вирівнюванні.
- Це позафазова комбінація, в результаті якої утворюється\(π^∗_{3p}\) орбітальна.
Позначте молекулярну орбіталь,\(σ\) показану як або\(π\), склеювання або антизв'язування, і вкажіть, де відбувається вузол.

- Відповідь
-
Орбітальна розташована уздовж міжядерної осі, тому вона є\(σ\) орбітальною. Існує вузол, що перетинає міжядерну вісь, тому він є антізв'язуючою орбіталлю.
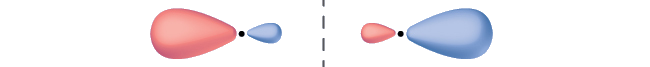
Дві орбіталі показані лежачими впритул. Кожен має одну збільшену і одну маленьку сторону. Дрібні сторони звернені одна до одної і розділені вертикальною пунктирною лінією.
Хоча описи склеювання, описані в цьому розділі, включають багато теоретичних концепцій, вони також мають багато практичних, реальних застосувань. Наприклад, дизайн ліків є важливою сферою, яка використовує наше розуміння хімічного зв'язку для розробки фармацевтичних препаратів. Ця міждисциплінарна область дослідження використовує біологію (розуміння захворювань та того, як вони діють) для визначення конкретних цілей, таких як місце зв'язування, яке бере участь у шляху захворювання. Моделюючи структури місця зв'язування і потенційних препаратів, обчислювальні хіміки можуть передбачити, які структури можуть поєднуватися між собою і наскільки ефективно вони будуть зв'язуватися (рис.\(\PageIndex{6}\)). Тисячі потенційних кандидатів можна звузити до кількох найбільш перспективних кандидатів. Ці молекули-кандидати потім ретельно тестуються, щоб визначити побічні ефекти, наскільки ефективно вони можуть транспортуватися через організм та інші фактори. Десятки важливих нових фармацевтичних препаратів були виявлені за допомогою обчислювальної хімії, і ведуться нові дослідницькі проекти.
Діаграми молекулярної орбітальної енергії
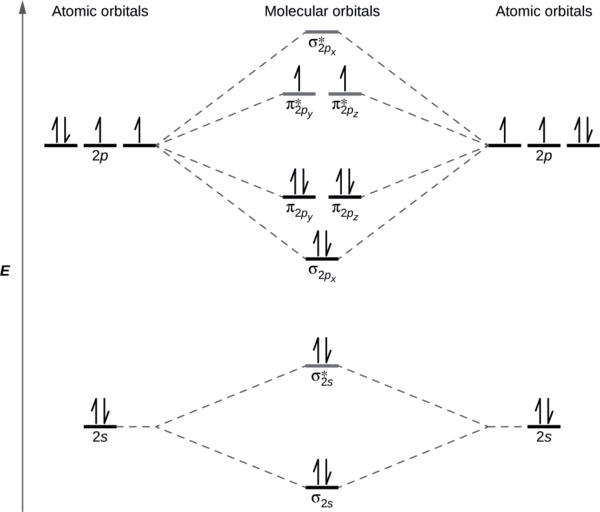
Рівні відносної енергії атомних і молекулярних орбіталей зазвичай показані на молекулярній орбітальній діаграмі (рис.\(\PageIndex{7}\)). Для двоатомної молекули атомні орбіталі одного атома показані зліва, а орбіталі іншого атома - праворуч. Кожна горизонтальна лінія являє собою одну орбіталь, яка може утримувати два електрони. Молекулярні орбіталі, утворені комбінацією атомних орбіталей, показані в центрі. Пунктирні лінії показують, які з атомних орбіталей об'єднуються, утворюючи молекулярні орбіталі. Для кожної пари атомних орбіталів, які об'єднують, один результат нижчої енергії (зв'язування) молекулярної орбіти та однієї орбітальної вищої енергії (антизв'язування). Таким чином, ми можемо бачити, що об'єднання шести атомних орбіталів 2 p призводить до трьох зв'язкових орбіталів (один σ і два π) і три антізв'язуючі орбіталі (один σ і два π*).
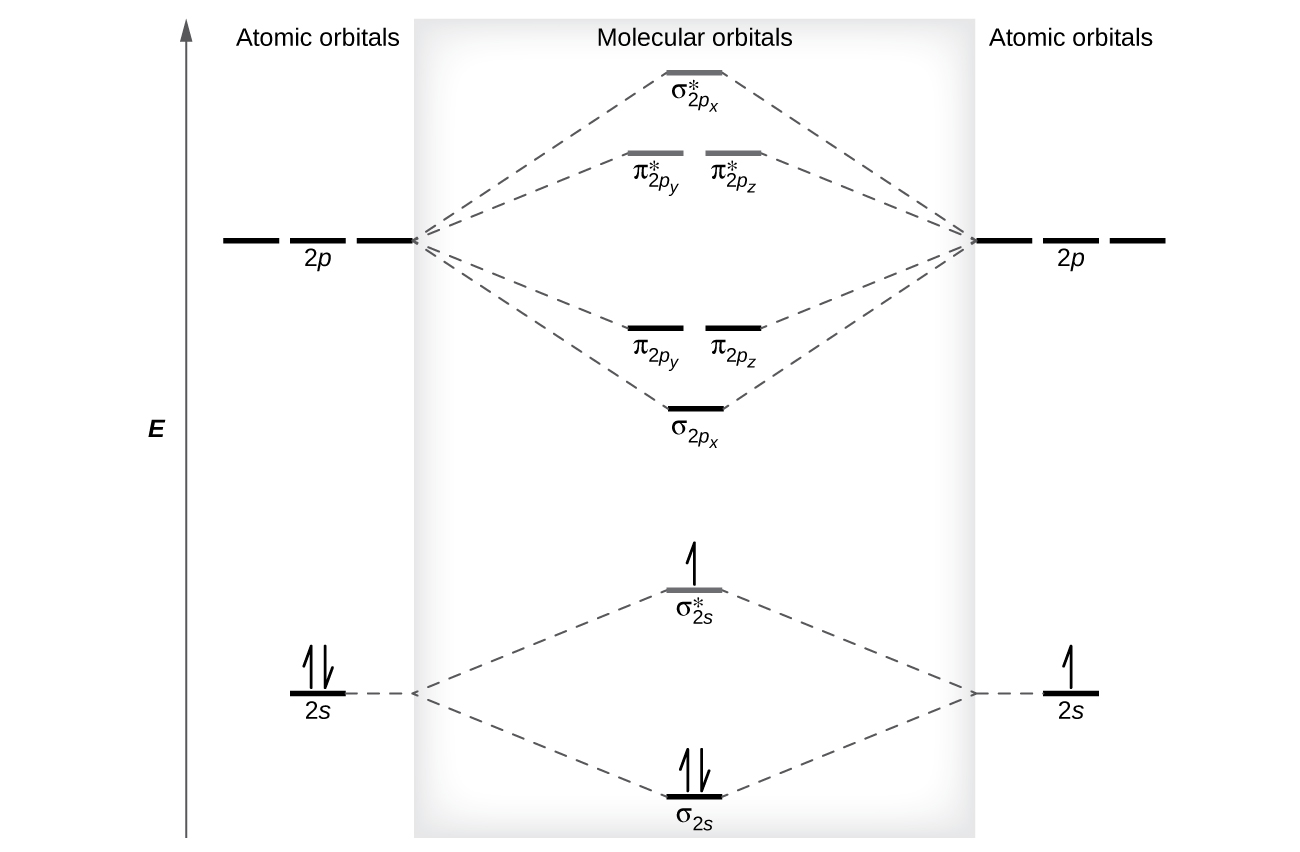
Ми прогнозуємо розподіл електронів на цих молекулярних орбіталах шляхом заповнення орбіталів так само, як ми заповнюємо атомні орбіталі, за принципом Ауфбау. Орбіталі нижчої енергії заповнюють першими, електрони розкидаються між виродженими орбіталями перед сполученням, і кожна орбіталь може утримувати максимум два електрони з протилежними спинами (рис.\(\PageIndex{7}\)). Так само, як ми пишемо електронні конфігурації для атомів, ми можемо записати молекулярну електронну конфігурацію, перерахувавши орбіталі з надскриптами, що вказують кількість наявних електронів. Для наочності розміщуємо дужки навколо молекулярних орбіталей з однаковою енергією. При цьому кожна орбіталь знаходиться з різною енергією, тому дужки відокремлюють кожну орбіталь. Таким чином, ми очікуємо, що двоатомна молекула або іон, що містить сім електронів (наприклад\(\ce{Be2+}\)), матиме молекулярну електронну конфігурацію\((σ_{1s})^2(σ^∗_{1s})^2(σ_{2s})^2(σ^∗_{2s})^1\). Загальноприйнято опускати електрони ядра з молекулярних орбітальних діаграм і конфігурацій і включати лише валентні електрони.
Замовлення облігацій
Заповнена молекулярна орбітальна діаграма показує кількість електронів як в склеювальних, так і в антизв'язуючих молекулярних орбіталах. Чистий внесок електронів у міцність зв'язку молекули ідентифікується шляхом визначення порядку зв'язку, який виникає в результаті заповнення молекулярних орбіталів електронами.
Використовуючи структури Льюїса для опису розподілу електронів у молекулах, ми визначаємо порядок зв'язків як кількість пар зв'язку електронів між двома атомами. Таким чином, одна зв'язок має порядок зв'язку 1, подвійний зв'язок має порядок зв'язку 2, а потрійний зв'язок має порядок зв'язку 3. Ми визначаємо порядок зв'язків по-різному, коли використовуємо молекулярно-орбітальний опис розподілу електронів, але отриманий порядок зв'язку зазвичай однаковий. Методика МО є більш точною і може обробляти випадки, коли метод структури Льюїса виходить з ладу, але обидва методи описують одне і те ж явище.
У молекулярній орбітальній моделі електрон сприяє зв'язуючій взаємодії, якщо він займає орбітальну зв'язок, і він сприяє антизв'язуючій взаємодії, якщо він займає антизв'язуючу орбіту. Порядок зв'язку обчислюється шляхом віднімання дестабілізуючих (антизв'язуючих) електронів з стабілізуючих (зв'язуючих) електронів. Оскільки зв'язок складається з двох електронів, ми ділимо на два, щоб отримати порядок зв'язку. Ми можемо визначити порядок зв'язків за допомогою наступного рівняння:
\[\textrm{bond order}=\dfrac{(\textrm{number of bonding electrons})−(\textrm{number of antibonding electrons})}{2} \nonumber \]
Порядок ковалентного зв'язку є керівництвом до його міцності; зв'язок між двома заданими атомами стає міцнішою зі збільшенням порядку зв'язку. Якщо розподіл електронів на молекулярних орбіталах між двома атомами такий, що отримана зв'язок мала б нульовий порядок зв'язку, стійкий зв'язок не утворюється. Далі ми розглянемо деякі конкретні приклади діаграм МО та замовлень облігацій.
Склеювання в двоатомних молекулах
Молекула диводню (Н 2) утворюється з двох атомів водню. Коли атомні орбіталі двох атомів об'єднуються, електрони займають молекулярну орбіталь найнижчої енергії, орбіталь зв'язку σ 1 с. Молекула диводню, H 2, легко утворюється, оскільки енергія молекули H 2 нижча, ніж у двох атомів Н. Орбіталь σ 1 s, яка містить обидва електрони, нижча за енергією, ніж будь-яка з двох атомних орбіталей 1 s.
Молекулярна орбіталь може утримувати два електрони, тому обидва електрони в молекулі H 2 знаходяться в орбіталі зв'язку σ 1 s; електронна конфігурація є\((σ_{1s})^2\). Цю конфігурацію ми представляємо молекулярно-орбітальної енергетичною діаграмою (рис.\(\PageIndex{8}\)), в якій одна стрілка вгору вказує на один електрон в орбіталі, а дві (вгору і вниз) стрілки вказують на два електрона протилежного спина.
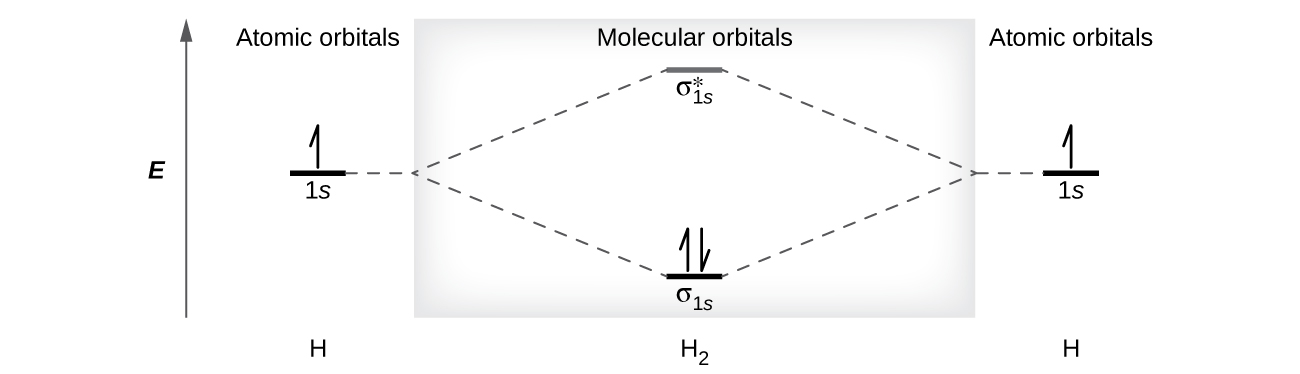
Молекула диводню містить два сполучних електронів і не антізв'язуючих електронів, тому ми маємо
\[\ce{bond\: order\: in\: H2}=\dfrac{(2−0)}{2}=1 \nonumber \]
Оскільки порядок облігацій для зв'язку H - H дорівнює 1, зв'язок є єдиним зв'язком.
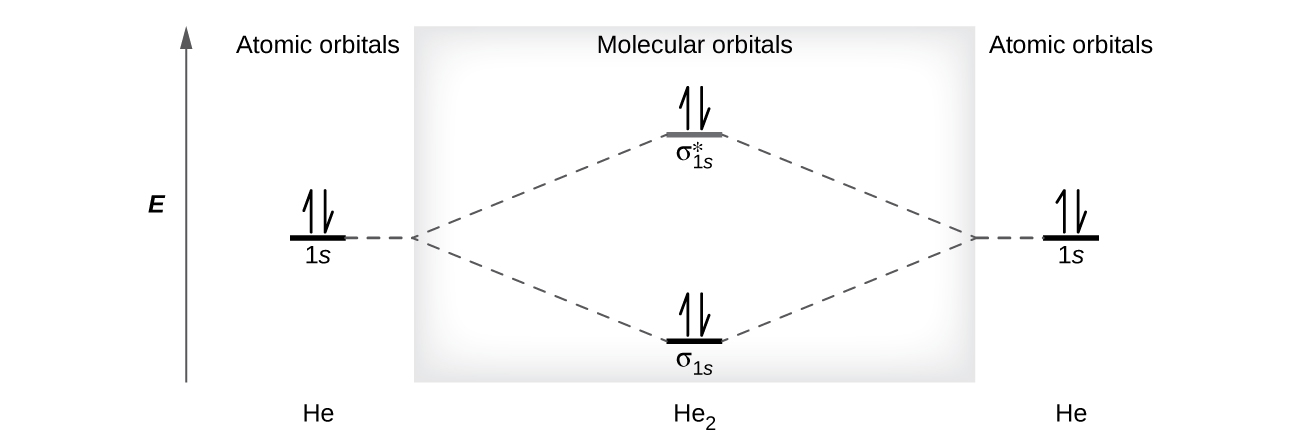
Атом гелію має два електрони, обидва з яких знаходяться в його орбіталі 1 с. Два атоми гелію не об'єднуються, утворюючи молекулу дигелію, He 2, з чотирма електронами, оскільки стабілізуючий ефект двох електронів в орбіталі зв'язку з нижчою енергією буде компенсований дестабілізуючим ефектом двох електронів у молекулярній орбіталі антизв'язку вищої енергії. Ми б написали гіпотетичну електронну конфігурацію Він 2,\((σ_{1s})^2(σ^∗_{1s})^2\) як на малюнку\(\PageIndex{9}\). Чиста зміна енергії дорівнювала б нулю, тому немає рушійної сили для атомів гелію для формування двоатомної молекули. Насправді гелій існує як дискретні атоми, а не як двоатомні молекули. Порядок зв'язку в гіпотетичній молекулі дигелію був би нульовим.
\[\ce{bond\: order\: in\: He2}=\dfrac{(2−2)}{2}=0 \nonumber \]
Порядок зв'язку нуль вказує на те, що між двома атомами не утворюється зв'язок.
Двоатомні молекули другого періоду
Вісім можливих гомоядерних двоатомних молекул можуть бути утворені атомами другого періоду періодичної таблиці: Li 2, Be 2, B 2, C 2, N 2, O 2, F 2 та Ne 2. Однак ми можемо передбачити, що молекула Be 2 і молекула Ne 2 не будуть стабільними. Ми можемо переконатися в цьому при розгляді молекулярних електронних конфігурацій (табл.\(\PageIndex{1}\)).
| Молекула | Конфігурація електрона | Замовлення облігацій |
|---|---|---|
| Лі 2 | \((σ_{2s})^2\) | 1 |
| Be 2 (нестабільний) | \((σ_{2s})^2(σ^∗_{2s})^2\) | 0 |
| Б 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^2\) | 1 |
| С 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4\) | 2 |
| N 2 | \((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4(σ_{2px})^2\) | 3 |
| О 2 | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},π^∗_{2pz})^2\) | 2 |
| Ф 2 | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},\:π^∗_{2pz})^4\) | 1 |
| Ne 2 (нестабільний) | \((σ_{2s})^2(σ^∗_{2s})^2(σ_{2px})^2(π_{2py},\:π_{2pz})^4(π^∗_{2py},π^∗_{2pz})^4(σ^∗_{2px})^2\) | 0 |
Ми прогнозуємо валентні молекулярні орбітальні електронні конфігурації так само, як прогнозуємо електронні конфігурації атомів. Валентні електрони присвоюються валентним молекулярним орбіталям з найменшими можливими енергіями. Відповідно до правила Гунда, коли є дві або більше вироджених молекулярних орбіталів, електрони заповнюють кожну орбіталь цього типу поодинці, перш ніж відбудеться будь-яке сполучення електронів.
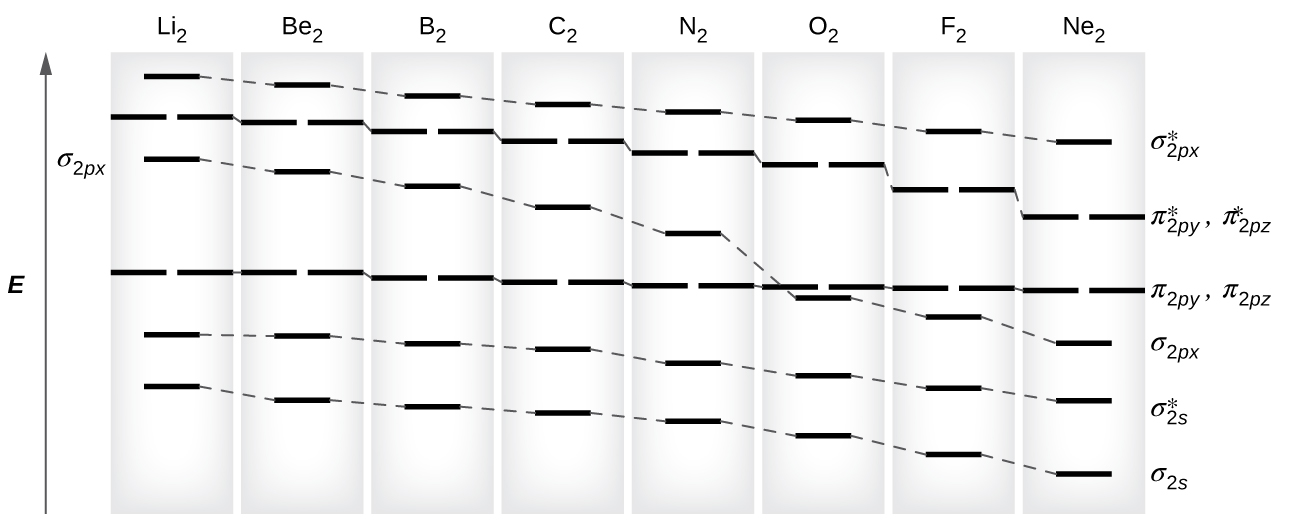
Як ми бачили в теорії валентних зв'язків, σ зв'язки, як правило, більш стабільні, ніж π зв'язки, утворені з вироджених атомних орбіталей. Аналогічно, в теорії молекулярної орбіти σ орбіталі зазвичай більш стабільні, ніж π орбіталі. Однак це не завжди так. MoS для валентних орбіталей другого періоду показані на рис\(\PageIndex{10}\). Дивлячись на молекулярні орбіталі Ne 2, ми бачимо, що порядок узгоджується з загальною діаграмою, показаною в попередньому розділі. Однак для атомів з трьома або меншою кількістю електронів на орбіталах p (Li - N) ми спостерігаємо іншу закономірність, в якій σ p орбіталь вище за енергією, ніж множина π р. Отримати молекулярно-орбітальну діаграму для гомоядерного двоатомного іона шляхом додавання або віднімання електронів з діаграми для нейтральної молекули.
Цей перемикач в орбітальному впорядкуванні відбувається через явище, яке називається змішуванням s-p. Змішування s-p не створює нових орбіталів; воно лише впливає на енергії існуючих молекулярних орбіталів. Хвильова функція σ s математично поєднується з хвильовою функцією σ p, в результаті чого орбіталь σ s стає більш стабільною, а σ p орбітальна стає менш стабільною (рис.\(\PageIndex{11}\)). Аналогічно антізв'язуючі орбіталі також піддаються s-p змішуванню, при цьому σ s * стають більш стабільними, а σ p * стають менш стабільними.
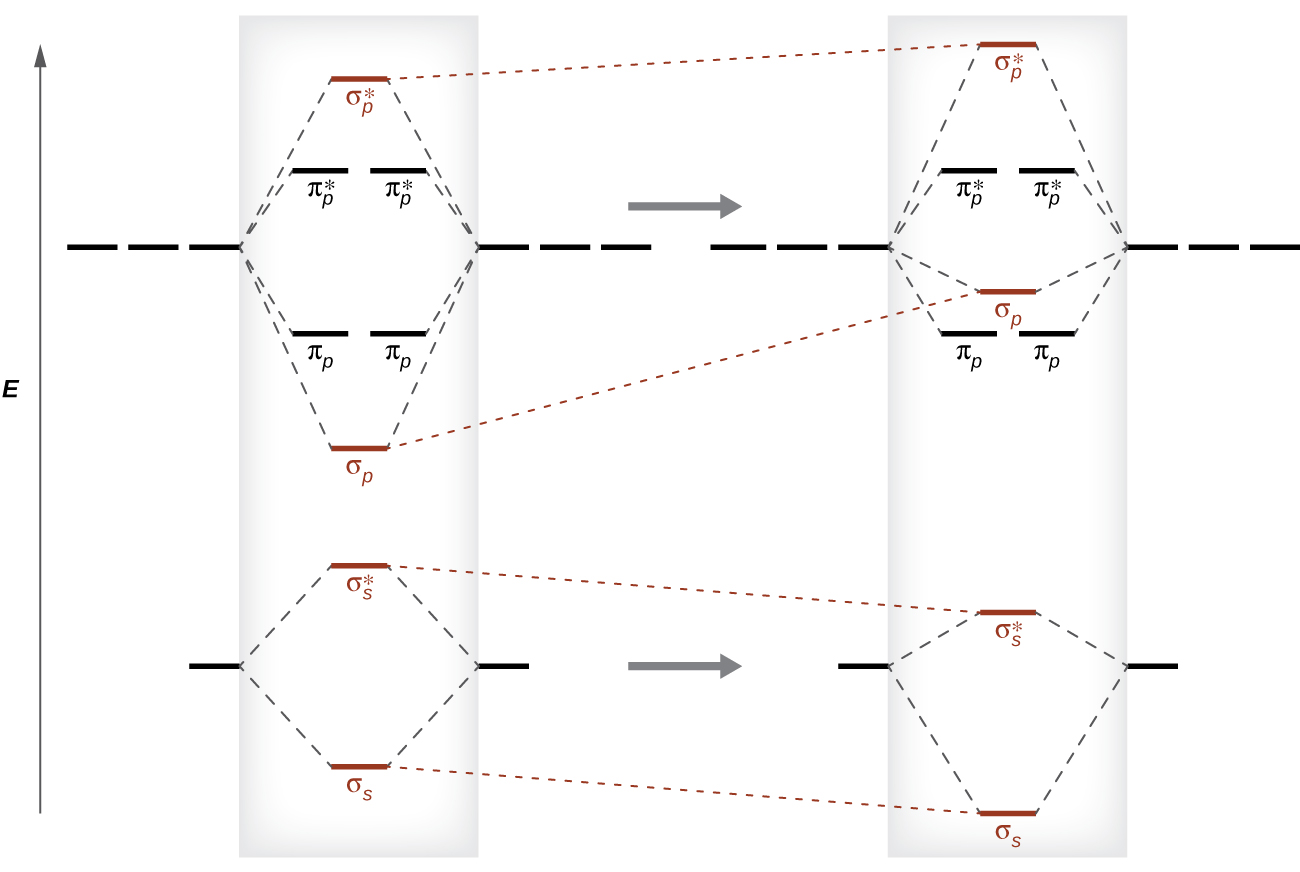
s-p змішування відбувається, коли s і p орбіталі мають подібні енергії. Різниця енергій між 2 s і 2 p орбіталями в O, F і Ne більша, ніж у Li, Be, B, C і N. Через це O 2, F 2 і Ne виявляють незначне змішування s-p (недостатньо для зміни енергетичного впорядкування), і їх MO діаграми слідують звичайний візерунок, як показано на малюнку\(\PageIndex{7}\). Всі інші двоатомні молекули періоду 2 мають s-p змішування, що призводить до закономірності, де σ р орбіталь піднята над множиною π р.
Використовуючи діаграми МО, показані на малюнку\(\PageIndex{11}\), ми можемо додати електрони та визначити молекулярну електронну конфігурацію та порядок зв'язку для кожної з двоатомних молекул. Як показано в таблиці\(\PageIndex{1}\), молекули Be 2 і Ne 2 мали б порядок зв'язку 0, і цих молекул не існує.
Поєднання двох атомів літію з утворенням молекули літію, Li 2, аналогічно утворенню Н 2, але атомні орбіталі, що беруть участь, є орбіталями валентності 2 s. Кожен з двох атомів літію має один валентний електрон. Отже, у нас є два валентні електрони, доступні для молекулярної орбіталі зв'язку σ 2 s. Оскільки обидва валентні електрони будуть знаходитися в орбіталі зв'язку, ми передбачили б, що молекула Li 2 буде стабільною. Молекула насправді присутня в помітній концентрації в парах літію при температурах, близьких до температури кипіння елемента. Всі інші молекули в таблиці\(\PageIndex{1}\) з порядком зв'язку більше нуля також відомі.
Молекула O 2 має достатньо електронів, щоб наполовину заповнити\((π^∗_{2py},\:π^∗_{2pz})\) рівень. Ми очікуємо, що два електрони, які займають ці дві вироджені орбіталі, будуть непарними, і ця молекулярна електронна конфігурація для O 2 відповідає тому, що молекула кисню має два непарних електронів (рис.\(\PageIndex{10}\)). Наявність двох непарних електронів виявилося важко пояснити за допомогою структур Льюїса, але молекулярна орбітальна теорія пояснює це досить добре. Насправді непарні електрони молекули кисню забезпечують міцну підтримку молекулярної орбітальної теорії.
Коли дві однакові атомні орбіталі на різних атомах об'єднуються, утворюються дві молекулярні орбіталі (наприклад, на\(H_2\) малюнку\(\PageIndex{8}\)). Орбіталь зв'язку нижча за енергією, ніж початкові атомні орбіталі, оскільки атомні орбіталі знаходяться в фазі в молекулярній орбіталі. Антизв'язуюча орбіталь вища за енергією, ніж оригінальні атомні орбіталі, оскільки атомні орбіталі поза фазою.
У твердому, подібні речі трапляються, але в набагато більших масштабах. Пам'ятайте, що навіть в невеликій вибірці є величезна кількість атомів (зазвичай > 10 23 атомів), а значить величезна кількість атомних орбіталей, які можуть бути об'єднані в молекулярні орбіталі. Коли N валентних атомних орбіталів, всі ті ж енергії і кожен з яких містить один (1) електрон, об'єднані, N/2 (заповнені) орбіталі зв'язку і N /2 (порожній) антизв'язуючий орбіталі призведе до результату. Кожна орбітальна зв'язок покаже зниження енергії, оскільки атомні орбіталі в основному є фазовими, але кожна з орбіталів зв'язку буде трохи відрізнятися і мати дещо іншу енергію. Антизв'язуючі орбіталі показуватимуть збільшення енергії, оскільки атомні орбіталі в основному поза фазою, але кожна з антизв'язуючих орбіталів також буде трохи відрізнятися і мати дещо іншу енергію. Дозволені рівні енергії для всіх орбіталів зв'язку настільки близькі один до одного, що вони утворюють смугу, звану валентною смугою. Так само всі антизв'язуючі орбіталі знаходяться дуже близько один до одного і утворюють смугу, звану смугою провідності. На малюнку\(\PageIndex{12}\)) показані смуги для трьох важливих класів матеріалів: ізоляторів, напівпровідників і провідників.
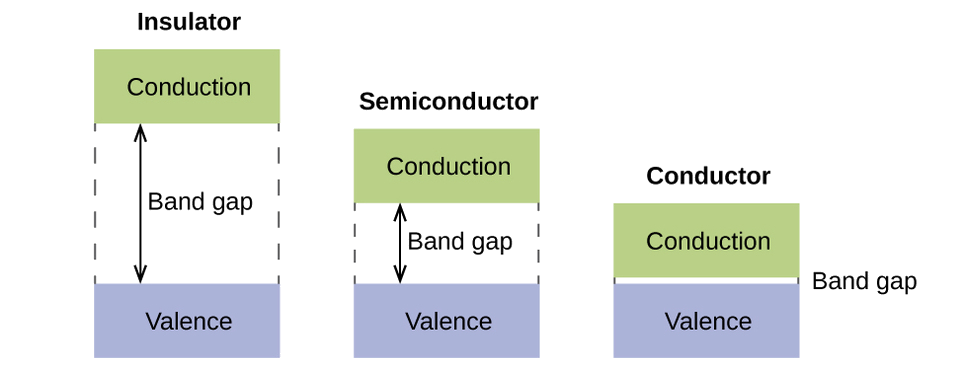
Для того, щоб провести електрику, електрони повинні рухатися з заповненої валентної зони в порожню зону провідності, де вони можуть переміщатися по всьому твердому тілу. Розмір забороненої зони, або різниця енергій між верхньою частиною валентної зони та нижньою частиною зони провідності, визначає, наскільки легко переміщати електрони між смугами. Лише невелика кількість енергії потрібно в провіднику, оскільки заборона зони дуже мала. Цю невелику різницю в енергії «легко» подолати, тому вони є хорошими провідниками електрики. У ізоляторі заборона заборони настільки «велика», що дуже мало електронів рухається в зону провідності; в результаті ізолятори є поганими провідниками електрики. Напівпровідники проводять електрику, коли забезпечується «помірна» кількість енергії для переміщення електронів з валентної зони і в зону провідності. Напівпровідники, такі як кремній, зустрічаються в багатьох електроніках.
Напівпровідники використовуються в таких пристроях, як комп'ютери, смартфони та сонячні батареї. Сонячні елементи виробляють електрику, коли світло забезпечує енергію для переміщення електронів з валентної зони. Електроенергія, яка виробляється, може бути використана для живлення світла або інструменту, або її можна зберігати для подальшого використання, заряджаючи акумулятор. Станом на грудень 2014 року до 46% енергії сонячного світла можна було перетворити в електроенергію за допомогою сонячних батарей.
Намалюйте молекулярну орбітальну діаграму для молекули кисню, O 2. З цієї діаграми обчислити порядок зв'язку для О 2. Як ця діаграма враховує парамагнетизм O 2?
Рішення
Ми малюємо молекулярну орбітальну енергетичну діаграму, подібну до тієї, що зображена на малюнку\(\PageIndex{7}\). Кожен атом кисню вносить шість електронів, тому діаграма з'являється так, як показано на малюнку\(\PageIndex{7}\).
Розраховуємо замовлення облігацій як
\[\ce{O2}=\dfrac{(8−4)}{2}=2 \nonumber \]
Парамагнетизм кисню пояснюється наявністю двох непарних електронів в (π 2 py, π 2 pz) * молекулярних орбіталів.
Основною складовою повітря є N 2. З молекулярної орбітальної діаграми N 2 прогнозуйте порядок його зв'язку та чи є він діамагнітним або парамагнітним.
- Відповідь
-
N 2 має порядок зв'язку 3 і є діамагнітним.
Дайте молекулярну орбітальну конфігурацію для валентних електронів в\(\ce{C2^2-}\). Чи буде цей іон стабільним?
Рішення
Дивлячись на відповідну діаграму МО, ми бачимо, що π орбіталі нижче за енергією, ніж орбіталі σ p. Валентна електронна конфігурація для С 2 дорівнює
\((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4\).
Додавання ще двох електронів для генерації\(\ce{C2^2-}\) аніону дасть валентну електронну конфігурацію
\((σ_{2s})^2(σ^∗_{2s})^2(π_{2py},\:π_{2pz})^4(σ_{2px})^2\)
Оскільки це має на шість більше зв'язкових електронів, ніж антизв'язування, порядок зв'язку буде 3, а іон повинен бути стабільним.
Скільки непарних електронів було б присутнім на\(\ce{Be2^2-}\) іоні? Це було б парамагнітним чи діамагнітним?
- Відповідь
-
два, парамагнітні
Ключові поняття та резюме
Молекулярна орбітальна теорія (МО) описує поведінку електронів в молекулі з точки зору комбінацій атомних хвильових функцій. Отримані молекулярні орбіталі можуть поширюватися на всі атоми в молекулі. Сполучні молекулярні орбіталі утворюються за допомогою інфазових комбінацій атомно-хвильових функцій, а електрони на цих орбіталах стабілізують молекулу. Антизв'язуючі молекулярні орбіталі виникають внаслідок позафазових комбінацій атомних хвильових функцій, а електрони на цих орбіталах роблять молекулу менш стабільною. Молекулярні орбіталі, розташовані уздовж міжядерної осі, називаються σ MoS. Вони можуть бути сформовані з s орбіталів або з p орбіталів, орієнтованих наскрізним способом. Молекулярні орбіталі, утворені з p орбіталів, орієнтованих пліч-о-пліч, мають електронну щільність з протилежних сторін міжядерної осі і називаються π орбіталями.
Електронну структуру двоатомних молекул можна описати шляхом застосування молекулярно-орбітальної теорії до валентних електронів атомів. Електрони заповнюють молекулярні орбіталі, дотримуючись тих самих правил, що застосовуються до заповнення атомних орбіталів; Правило Хунда і принцип Ауфбау говорять нам, що орбіталі нижчої енергії заповниться першими, електрони розпливуться до того, як вони спаруються, і кожна орбіталь може утримувати максимум два електрони з протилежними спинами. Матеріали з непарними електронами парамагнітні і притягуються до магнітного поля, тоді як ті, у яких є всепарні електрони, діамагнітні і відштовхуються магнітним полем. Правильне прогнозування магнітних властивостей молекул є перевагою молекулярної орбітальної теорії над структурами Льюїса та теорією валентних зв'язків.
