8.2: Гібридні атомні орбіталі
- Page ID
- 22427
- Поясніть поняття атомно-орбітальної гібридизації
- Визначте гібридні орбіталі, пов'язані з різними молекулярними геометріями
Мислення з точки зору перекриття атомних орбіталів - це один із способів пояснити, як утворюються хімічні зв'язки в двоатомних молекулах. Однак, щоб зрозуміти, як молекули з більш ніж двома атомами утворюють стабільні зв'язки, нам потрібна більш детальна модель. Як приклад розглянемо молекулу води, в якій у нас один атом кисню зв'язується з двома атомами водню. Кисень має електронну конфігурацію 1 s 2 2 s 2 2 p 4, з двома непарними електронами (по одному в кожній з двох 2 p орбіталей). Теорія валентних зв'язків передбачала б, що дві O—H зв'язки утворюються від перекриття цих двох орбіталів 2 p з орбіталями 1 s атомів водню. Якби це було так, кут зв'язку був би 90°, як показано на малюнку\(\PageIndex{1}\), оскільки орбіталі p перпендикулярні один одному. Експериментальні дані показують, що кут зв'язку становить 104,5°, а не 90°. Прогнозування моделі теорії валентних зв'язків не відповідає реальним спостереженням молекули води; потрібна інша модель.
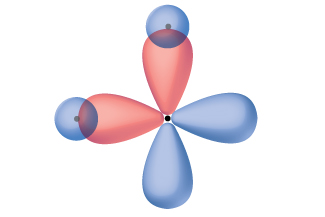
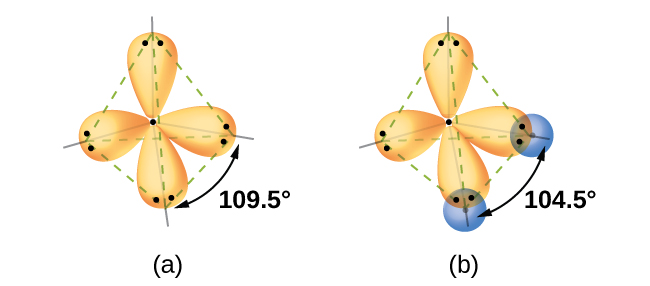
Квантово-механічні розрахунки дозволяють припустити, чому спостережувані кути зв'язку в H 2 O відрізняються від передбачених перекриттям 1 с орбіталі атомів водню з орбіталями 2 р атома кисню. Математичний вираз, відомий як хвильова функція, ψ, містить інформацію про кожну орбіту та хвилеподібні властивості електронів в ізольованому атомі. Коли атоми пов'язані між собою в молекулі, хвильові функції об'єднуються, утворюючи нові математичні описи, які мають різну форму. Цей процес об'єднання хвильових функцій для атомних орбіталів називається гібридизацією і математично досягається лінійною комбінацією атомних орбіталів LCAO (методика, з якою ми знову зіткнемося пізніше). Нові орбіталі, які призводять до цього, називаються гібридними орбіталями. Валентні орбіталі в ізольованому атомі кисню - це орбіталь 2 s і три орбіталі 2 р. Валентні орбіталі в атомі кисню в молекулі води відрізняються; вони складаються з чотирьох еквівалентних гібридних орбіталей, які вказують приблизно до кутів тетраедра (рис.\(\PageIndex{2}\)). Отже, перекриття орбіталів O і H повинно призвести до чотиригранного кута зв'язку (109,5°). Спостережуваний кут 104,5° є експериментальним доказом, для якого квантово-механічні розрахунки дають корисне пояснення: теорія валентних зв'язків повинна включати компонент гібридизації, щоб дати точні прогнози.
Наступні ідеї важливі для розуміння гібридизації:
- Гібридні орбіталі не існують в ізольованих атомах. Вони утворюються тільки в ковалентно зв'язаних атомах.
- Гібридні орбіталі мають форми та орієнтації, які сильно відрізняються від форм атомних орбіталей в ізольованих атомах.
- Набір гібридних орбіталів генерується шляхом об'єднання атомних орбіталей. Кількість гібридних орбіталів у наборі дорівнює кількості атомних орбіталей, які були об'єднані для отримання множини.
- Всі орбіталі в наборі гібридних орбіталей еквівалентні за формою та енергією.
- Тип гібридних орбіталів, що утворюються в зв'язаному атомі, залежить від геометрії його електронної пари, як це передбачено теорією VSEPR.
- Гібридні орбіталі перекриваються з утворенням σ зв'язків. Негібридизовані орбіталі перекриваються з утворенням π зв'язків.
У наступних розділах ми обговоримо поширені типи гібридних орбіталей.
sp гібридизація
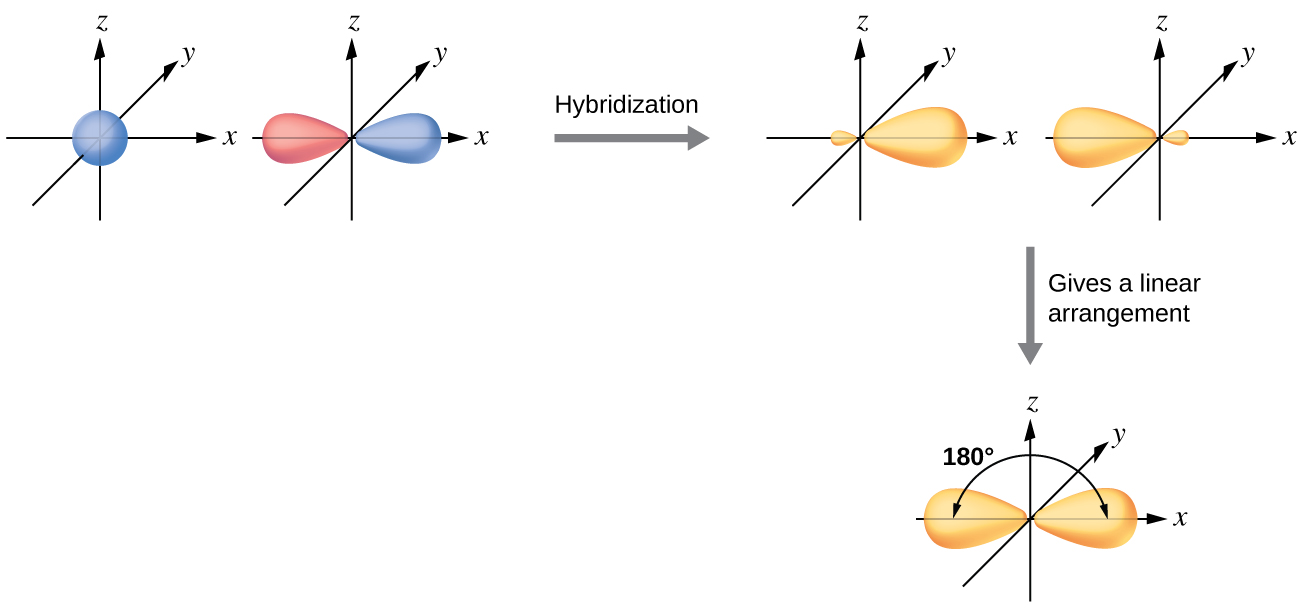
Атом берилію в газоподібній молекулі BeCl 2 є прикладом центрального атома без одиноких пар електронів в лінійному розташуванні трьох атомів. У молекулі BeCl 2 є дві області валентної електронної щільності, які відповідають двом ковалентним зв'язкам Be—Cl. Для розміщення цих двох електронних доменів дві з чотирьох валентних орбіталів атома Be змішуватимуться, щоб отримати дві гібридні орбіталі. Цей процес гібридизації включає змішування валентної s орбіталі з однією з валентних p орбіталів з отриманням двох еквівалентних sp гібридних орбіталів, які орієнтовані в лінійній геометрії (рис.\(\PageIndex{3}\)). На цьому малюнку сукупність sp орбіталів виглядає схожою за формою з вихідною p орбітальної, але є важлива відмінність. Кількість атомних орбіталів, об'єднаних завжди дорівнює кількості сформованих гібридних орбіталей. p орбітальна - це одна орбітальна, яка може утримувати до двох електронів. Набір sp - це дві еквівалентні орбіталі, які вказують на 180° один від одного. Два електрони, які спочатку були в орбіталі s, тепер розподілені на дві орбіталі sp, які наполовину заповнені. У газоподібних BeCl 2 ці напівзаповнені гібридні орбіталі перекриватимуться орбіталями з атомів хлору, утворюючи дві однакові зв'язки σ.
Проілюструємо електронні відмінності в ізольованому атомі Be і в зв'язаному атомі Be на орбітальній діаграмі енергетичного рівня на рис\(\PageIndex{4}\). Ці діаграми представляють кожну орбіталь горизонтальною лінією (із зазначенням її енергії) і кожен електрон стрілкою. Енергія збільшується до верхньої частини діаграми. Ми використовуємо одну стрілку вгору, щоб позначити один електрон в орбіталі і дві стрілки (вгору і вниз) для позначення двох електронів протилежного спина.
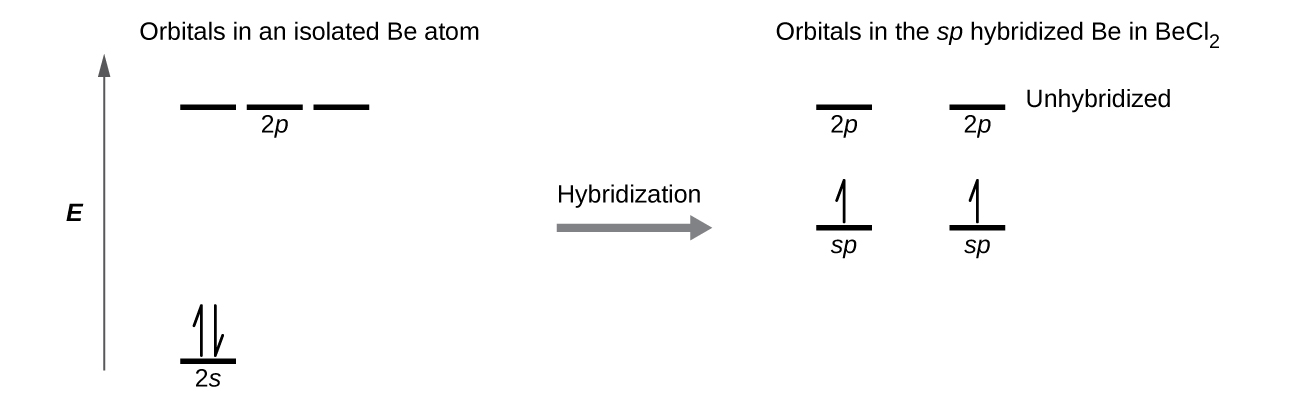
Коли атомні орбіталі гібридизуються, валентні електрони займають новостворені орбіталі. Атом Be мав два валентних електронів, тому кожна з орбіталів sp отримує один з цих електронів. Кожен з цих електронів з'єднується з непарним електроном на атомі хлору, коли гібридна орбіта та орбітальна хлор перекриваються під час формування зв'язків Be—Cl. Будь-який центральний атом, оточений лише двома областями валентної електронної щільності в молекулі, буде демонструвати sp гібридизацію. Інші приклади включають атом ртуті в лінійній молекулі HgCl 2, атом цинку в Zn (CH 3) 2, який містить лінійне розташування C—Zn—C, і атоми вуглецю в HCCH і CO 2.
sp 2 Гібридизація
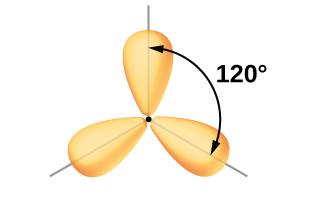
Валентні орбіталі центрального атома, оточені трьома областями електронної густини, складаються з безлічі трьох гібридних орбіталей sp 2 і однієї негібридизованої p орбіталі. Це розташування є результатом sp 2 гібридизації, змішування однієї s орбітальної та двох p орбіталів для отримання трьох однакових гібридних орбіталів, орієнтованих у тригональній планарній геометрії (рис.\(\PageIndex{5}\)).
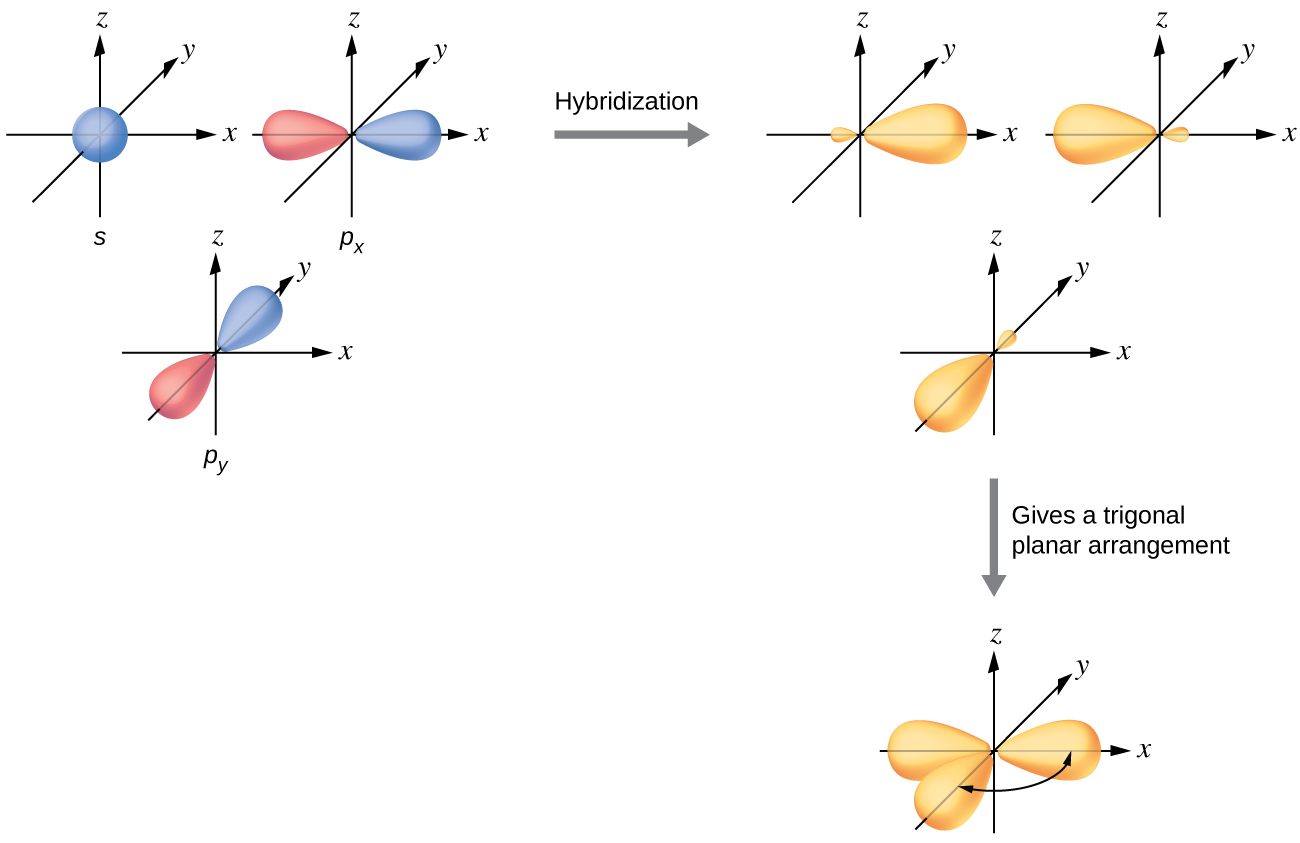
Хоча квантова механіка дає «пухкі» орбітальні частки, як зображено на малюнку\(\PageIndex{5}\), іноді для наочності ці орбіталі малюються тонше і без незначних часточок, як на малюнку\(\PageIndex{6}\), щоб уникнути затемнення інших особливостей даної ілюстрації. Ми будемо використовувати ці «тонші» уявлення, коли справжній погляд занадто переповнений, щоб легко візуалізувати.
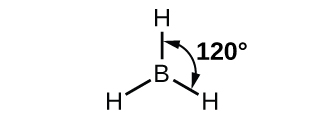
Спостережувана структура молекули бору, BH 3, передбачає гібридизацію sp 2 для бору в цій сполуці. Молекула тригональна планарна, а атом бору бере участь в трьох зв'язках з атомами водню (рис.\(\PageIndex{7}\)).
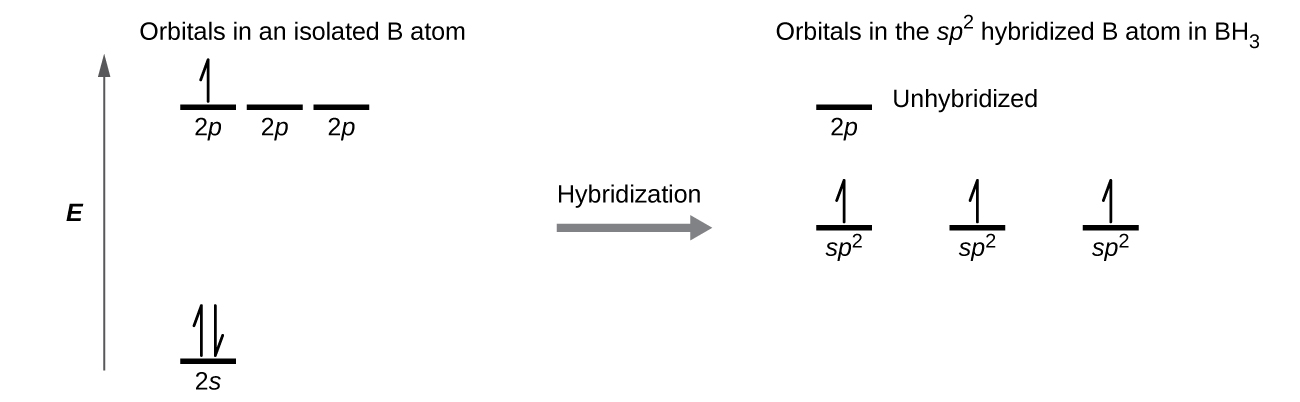
Ми можемо проілюструвати порівняння орбіталів та розподілу електронів в ізольованому атомі бору та в зв'язаному атомі в BH 3, як показано на діаграмі рівня орбітальної енергії на малюнку\(\PageIndex{8}\). Ми перерозподіляємо три валентні електрони атома бору на трьох гібридних орбіталах sp 2, а кожна пара електронів бору з електроном водню при утворенні зв'язків B—H.
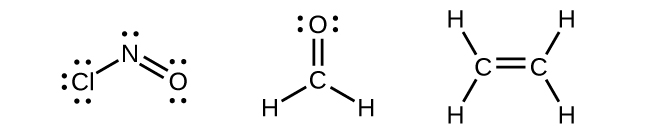
Будь-який центральний атом, оточений трьома областями електронної щільності, буде демонструвати гібридизацію sp 2. Сюди входять молекули з одинокою парою на центральному атомі, такі як ClNO (рис.\(\PageIndex{9}\)), або молекули з двома одинарними зв'язками і подвійною зв'язком, з'єднаної з центральним атомом, як у формальдегіду, CH 2 O, і етена, H 2 CCH 2.
sp 3 Гібридизація
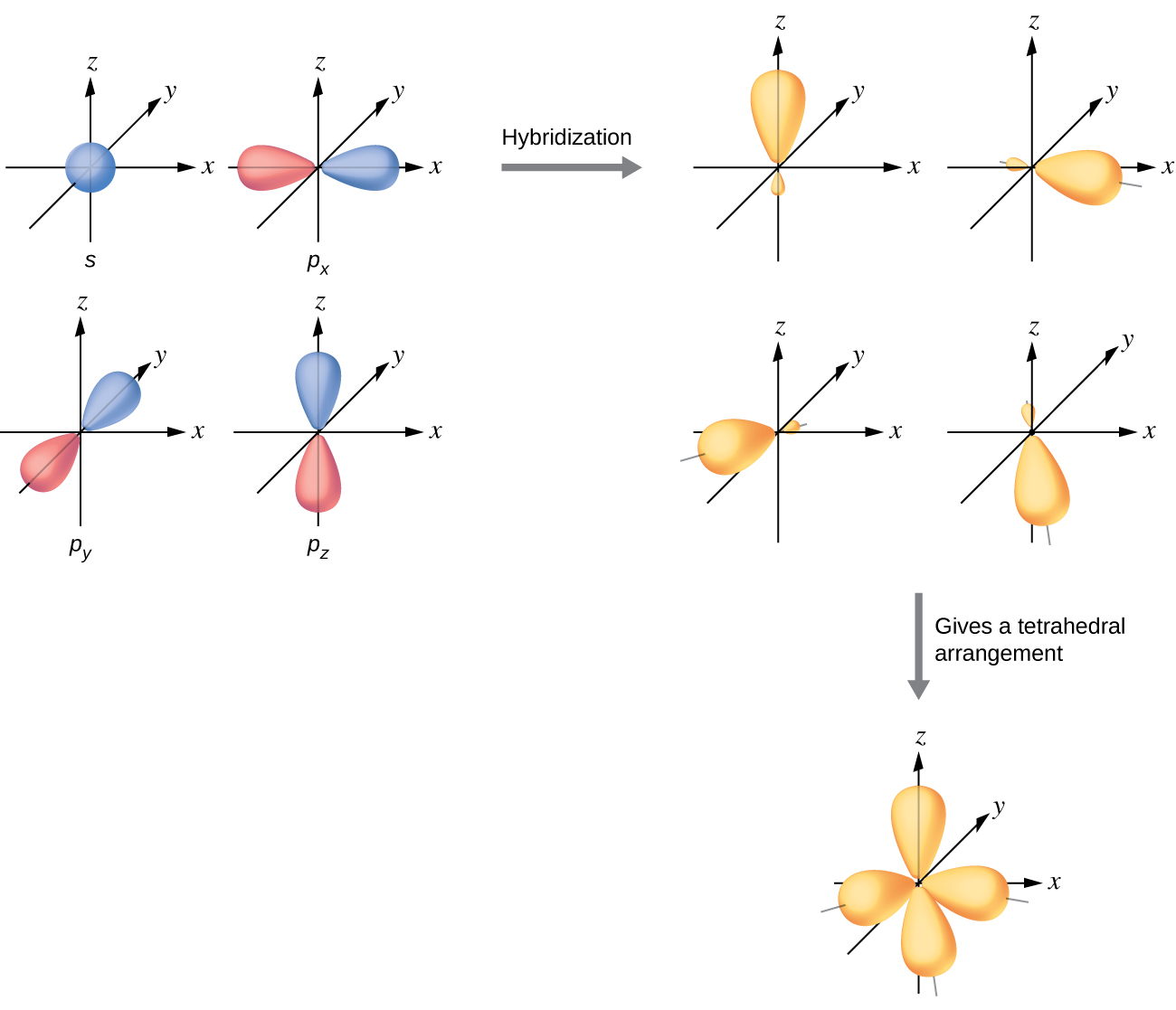
Валентні орбіталі атома, оточені чотиригранним розташуванням сполучних пар і одиноких пар, складаються з безлічі чотирьох гібридних орбіталів sp 3. Гібриди є результатом змішування однієї s орбітальної і всіх трьох p орбіталів, що виробляє чотири однакові sp 3 гібридні орбіталі (рис.\(\PageIndex{10}\)). Кожна з цих гібридних орбіталів вказує на інший кут тетраедра.
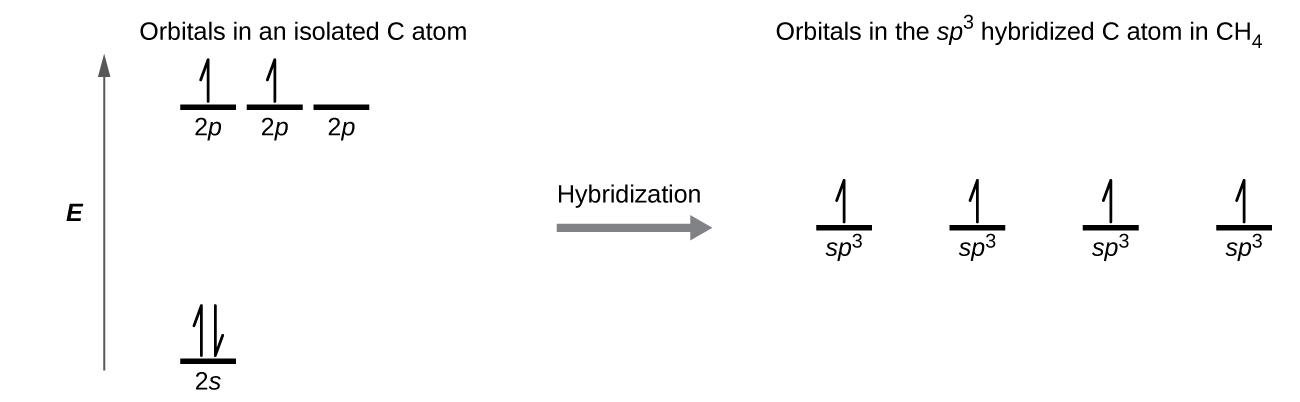
Молекула метану, СН 4, складається з атома вуглецю, оточеного чотирма атомами водню по кутах тетраедра. Атом вуглецю в метані проявляє гібридизацію sp 3. Проілюструємо орбіталі та розподіл електронів в ізольованому атомі вуглецю та в зв'язаному атомі в CH 4 на рис\(\PageIndex{11}\). Чотири валентні електрони атома вуглецю розподілені порівну на гібридних орбіталах, а кожна вуглецева електронна пара з електроном водню при утворенні зв'язків С—Н.
У молекулі метану орбіталь 1 s кожного з чотирьох атомів водню перекривається однією з чотирьох орбіталей sp 3 атома вуглецю, утворюючи сигма-зв'язок (σ). Це призводить до утворення чотирьох сильних, еквівалентних ковалентних зв'язків між атомом вуглецю і кожним з атомів водню для отримання молекули метану, CH 4.
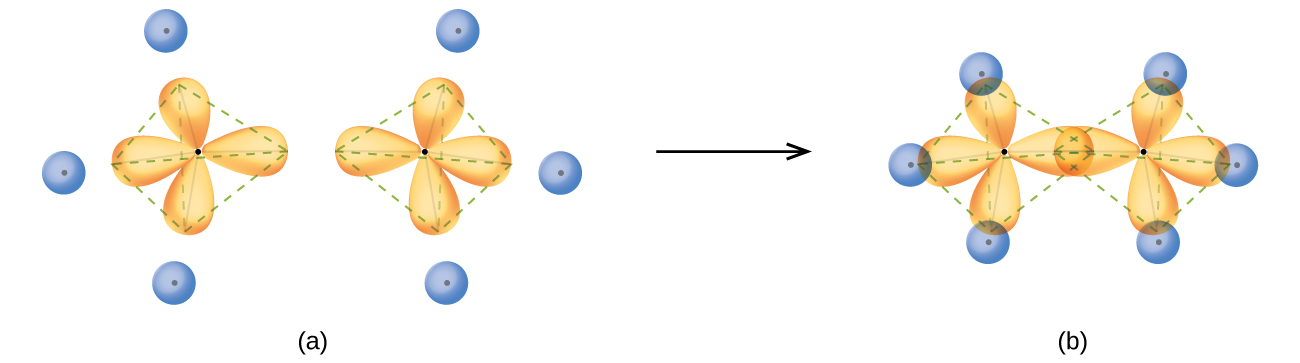
Структура етану, C 2 H 6, подібна до структури метану в тому, що кожен вуглець в етані має чотири сусідніх атома, розташовані по кутах тетраедрону - три атоми водню і один атом вуглецю (рис.\(\PageIndex{10}\)). Однак у етані орбіталі sp 3 одного атома вуглецю перекривається кінець в кінець орбіталлю sp 3 другого атома вуглецю, утворюючи σ зв'язок між двома атомами вуглецю. Кожна з решти гібридних орбіталів sp 3 перекривається s орбіталлю атома водню з утворенням вуглецево-водневих σ зв'язків. Структура і загальний контур склеювальних орбіталей етану наведені на малюнку\(\PageIndex{12}\). Орієнтація двох груп СН 3 не зафіксована відносно один одного. Експериментальні дані показують, що обертання навколо σ зв'язків відбувається легко.
Гібридна орбіта sp 3 також може утримувати одиночну пару електронів. Наприклад, атом азоту в аміаку оточений трьома парами зв'язку і самотньою парою електронів, спрямованих до чотирьох кутів тетраедра. Атом азоту sp 3 гібридизований з однією гібридною орбітою, зайнятою самотньою парою.
Молекулярна структура води узгоджується з чотиригранним розташуванням двох одиноких пар і двох сполучних пар електронів. Таким чином, ми говоримо, що атом кисню sp 3 гібридизований, причому дві гібридні орбіталі зайняті одинокими парами і двома парами зв'язку. Оскільки одинокі пари займають більше місця, ніж склеювальні пари, структури, що містять поодинокі пари, мають кути зв'язку, трохи спотворені від ідеалу. Ідеальні тетраедри мають кути 109,5°, але спостерігаються кути в аміаку (107,3°) та воді (104,5°) трохи менші. Інші приклади гібридизації sp 3 включають cCl 4, pCl 3 та NCl 3.
сп 3 д і сп 3 д 2 гібридизація
Щоб описати п'ять зв'язкових орбіталів у тригональному біпірамідному розташуванні, ми повинні використовувати п'ять атомних орбіталів валентної оболонки (орбіталь s, три орбіталі p та одну з орбіталів d), що дає п'ять sp 3 d гібридні орбіталі. При восьмигранному розташуванні шести гібридних орбіталей ми повинні використовувати шість атомних орбіталів валентної оболонки (орбіталь s, три орбіталі p та дві орбіталі d в валентній оболонці), що дає шість sp 3 d 2 гібридні орбіталі. Ці гібридизації можливі лише для атомів, які мають d орбіталів у своїх валентних підоболонках (тобто не тих, що знаходяться в першому чи другому періоді).

У молекулі пентахлориду фосфору, pCl 5, є п'ять зв'язків P—Cl (таким чином, п'ять пар валентних електронів навколо атома фосфору), спрямованих до кутів тригональної біпіраміди. Ми використовуємо орбіталь 3 s, три орбіталі 3 p та одну з 3 d орбіталів для формування набору п'яти гібридних орбіталів sp 3 d (рис.\(\PageIndex{13}\)), які беруть участь у зв'язках P—Cl. Інші атоми, які проявляють гібридизацію sp 3 d, включають атом сірки в SF 4 і атоми хлору в CLF 3 і в\(\ce{ClF4+}\). (Електрони на атомах фтору опущені для наочності.)
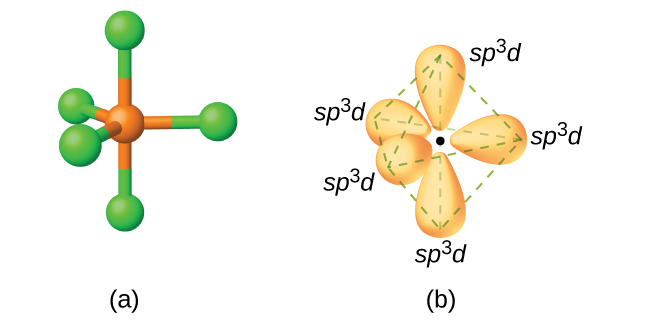
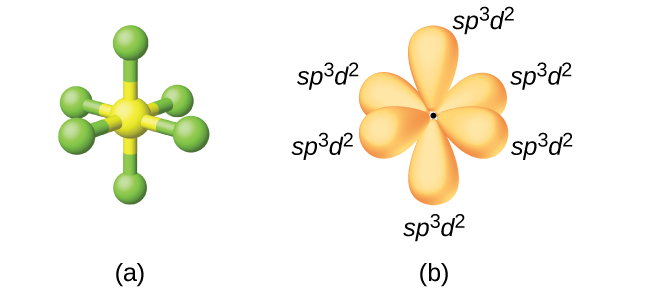
Атом сірки в гексафториду сірки SF 6 проявляє гібридизацію sp 3 d 2. Молекула гексафториду сірки має шість сполучних пар електронів, що з'єднують шість атомів фтору з одним атомом сірки. На центральному атомі немає самотніх пар електронів. Щоб зв'язати шість атомів фтору, орбітальні 3 s, три орбіталі 3 p та два з 3 d орбіталів утворюють шість еквівалентних sp 3 d 2 гібридних орбіталів, кожен спрямований до іншого кута октаедра. Інші атоми, які проявляють гібридизацію sp 3 d 2\(\ce{PCl6-}\), включають атом фосфору в, атом йоду в інтергалогенах\(\ce{IF6+}\), IF 5\(\ce{ICl4-}\),\(\ce{IF4-}\) і атом ксенону в xeF 4.
Призначення гібридних орбіталів центральним атомам
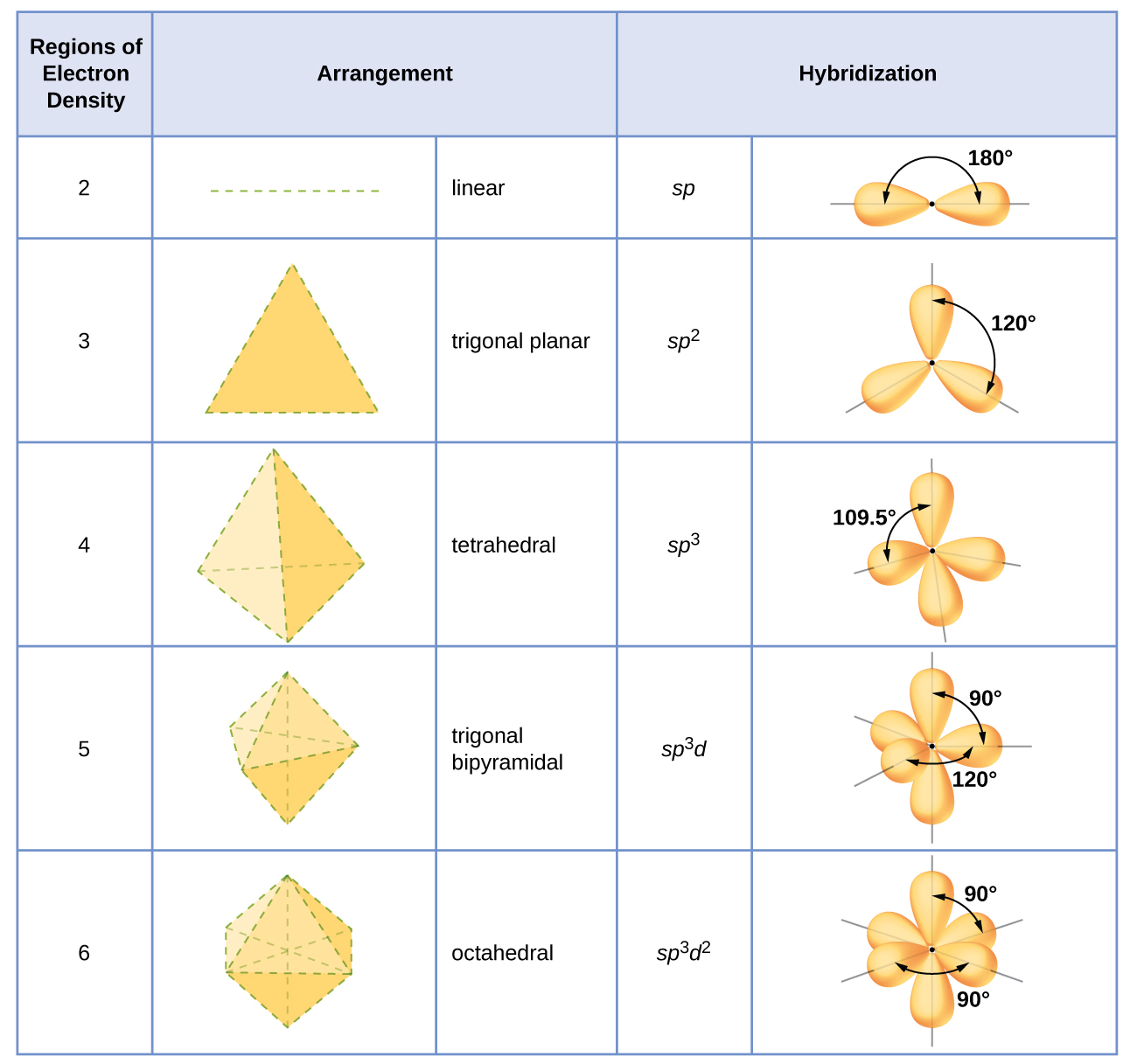
Гібридизація атома визначається виходячи з кількості областей електронної густини, які його оточують. Геометричні розташування, характерні для різних наборів гібридних орбіталей, наведені на рисунку\(\PageIndex{16}\). Ці механізми ідентичні геометрії електронної пари, передбачені теорією VSEPR. Теорія VSEPR передбачає форми молекул, а гібридна орбітальна теорія дає пояснення того, як ці форми формуються. Щоб знайти гібридизацію центрального атома, ми можемо скористатися наступними рекомендаціями:
- Визначте структуру Льюїса молекули.
- Визначте кількість областей електронної щільності навколо атома за допомогою теорії VSEPR, в якій одиночні зв'язки, множинні зв'язки, радикали та одиночні пари рахуються як одна область.
- Призначте набір гібридизованих орбіталей з малюнка\(\PageIndex{16}\), який відповідає цій геометрії.
Важливо пам'ятати, що гібридизація була розроблена для раціоналізації експериментально спостережуваних молекулярних геометрій, а не навпаки.
Модель добре працює для молекул, що містять малі центральні атоми, у яких валентні електронні пари знаходяться близько один до одного в просторі. Однак для більших центральних атомів електронні пари валентность-оболонка знаходяться далі від ядра, і відштовхувань менше. Їх сполуки демонструють структури, які часто не відповідають теорії VSEPR, а гібридизовані орбіталі не потрібні для пояснення спостережуваних даних.
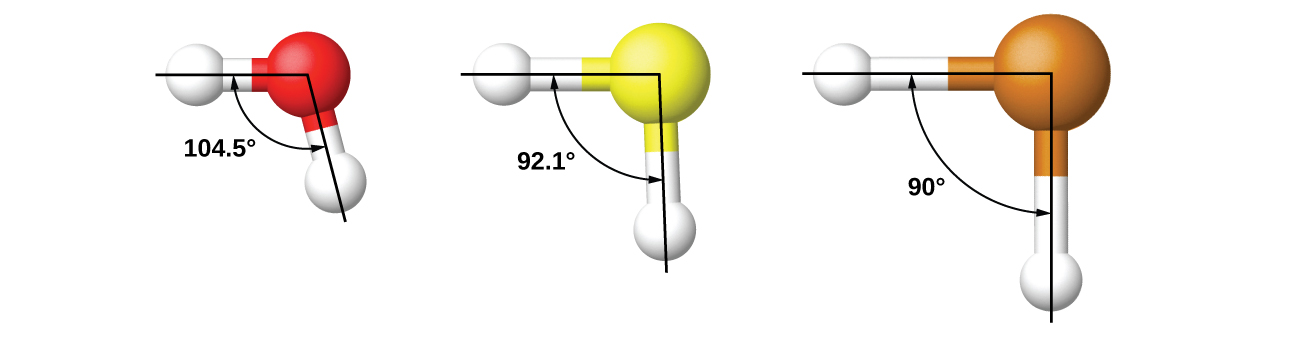
Наприклад, ми обговорили кут зв'язку H—O—H в H 2 O, 104,5°, що більше відповідає гібридним орбіталям sp 3 (109,5°) на центральному атомі, ніж з 2 p орбіталями (90°). Сірка знаходиться в тій же групі, що і кисень, а H 2 S має схожу структуру Льюїса. Однак він має набагато менший кут зв'язку (92,1°), що свідчить про набагато меншу гібридизацію на сірці, ніж кисень. Продовжуючи вниз по групі, телур навіть більший за сірку, а для H 2 Te спостережуваний кут зв'язку (90°) узгоджується з перекриттям орбіталів 5 р, не викликаючи гібридизації. Ми викликаємо гібридизацію там, де необхідно пояснити спостережувані структури.
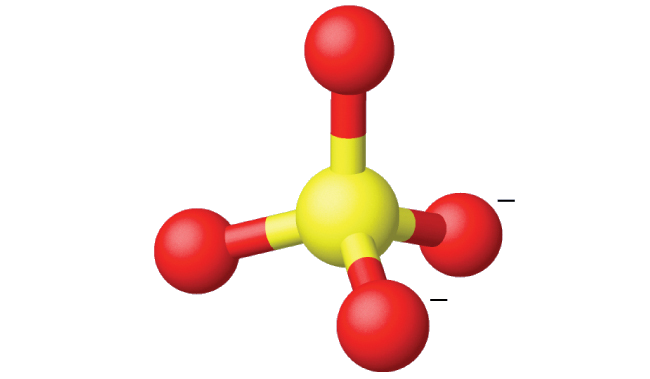
Ammonium sulfate is important as a fertilizer. What is the hybridization of the sulfur atom in the sulfate ion, \(\ce{SO4^2-}\)?
Solution
The Lewis structure of sulfate shows there are four regions of electron density.
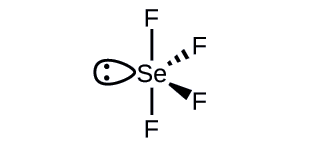
What is the hybridization of the selenium atom in SeF4?
- Answer
-
The selenium atom is sp3d hybridized.
Urea, NH2C(O)NH2, is sometimes used as a source of nitrogen in fertilizers. What is the hybridization of each nitrogen and carbon atom in urea?
Solution
The Lewis structure of urea is
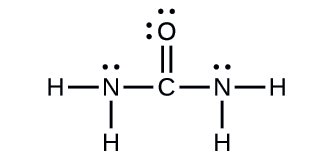
The carbon atom is surrounded by three regions of electron density, positioned in a trigonal planar arrangement. The hybridization in a trigonal planar electron pair geometry is sp2 (Figure \(\PageIndex{16}\)), which is the hybridization of the carbon atom in urea.
Acetic acid, H3CC(O)OH, is the molecule that gives vinegar its odor and sour taste. What is the hybridization of the two carbon atoms in acetic acid?
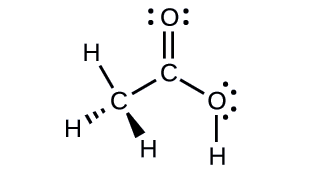
- Answer
-
H3C, sp3; C(O)OH, sp2
Summary
We can use hybrid orbitals, which are mathematical combinations of some or all of the valence atomic orbitals, to describe the electron density around covalently bonded atoms. These hybrid orbitals either form sigma (σ) bonds directed toward other atoms of the molecule or contain lone pairs of electrons. We can determine the type of hybridization around a central atom from the geometry of the regions of electron density about it. Two such regions imply sp hybridization; three, sp2 hybridization; four, sp3 hybridization; five, sp3d hybridization; and six, sp3d2 hybridization. Pi (π) bonds are formed from unhybridized atomic orbitals (p or d orbitals).
Footnotes
- Note that orbitals may sometimes be drawn in an elongated “balloon” shape rather than in a more realistic “plump” shape in order to make the geometry easier to visualize.
Glossary
- hybrid orbital
- orbital created by combining atomic orbitals on a central atom
- hybridization
- model that describes the changes in the atomic orbitals of an atom when it forms a covalent compound
- sp hybrid orbital
- one of a set of two orbitals with a linear arrangement that results from combining one s and one p orbital
- sp2 hybrid orbital
- one of a set of three orbitals with a trigonal planar arrangement that results from combining one s and two p orbitals
- sp3 hybrid orbital
- one of a set of four orbitals with a tetrahedral arrangement that results from combining one s and three p orbitals
- sp3d hybrid orbital
- one of a set of five orbitals with a trigonal bipyramidal arrangement that results from combining one s, three p, and one d orbital
- sp3d2 hybrid orbital
- one of a set of six orbitals with an octahedral arrangement that results from combining one s, three p, and two d orbitals
