7.2: Ковалентне склеювання
- Page ID
- 22626
- Охарактеризуйте утворення ковалентних зв'язків
- Визначити електронегативність і оцінити полярність ковалентних зв'язків
В іонних сполуках електрони переносяться між атомами різних елементів з утворенням іонів. Але це не єдиний спосіб, яким можуть утворюватися з'єднання. Атоми також можуть створювати хімічні зв'язки, обмінюючись електронами між собою. Такі зв'язки називаються ковалентними. Ковалентні зв'язки утворюються між двома атомами, коли обидва мають схожі тенденції до залучення електронів до себе (тобто коли обидва атоми мають однакові або досить схожі енергії іонізації та електронну спорідненість). Наприклад, два атоми водню ковалентно зв'язуються, утворюючи молекулу H 2; кожен атом водню в молекулі H 2 має два електрони, що стабілізують його, даючи кожному атому таку ж кількість валентних електронів, як благородний газ He.
Сполуки, що містять ковалентні зв'язки, проявляють різні фізичні властивості, ніж іонні сполуки. Оскільки тяжіння між молекулами, які є електрично нейтральними, слабкіше, ніж між електрично зарядженими іонами, ковалентні сполуки, як правило, мають набагато нижчі температури плавлення та кипіння, ніж іонні сполуки. Насправді багато ковалентних сполук - це рідини або гази при кімнатній температурі, і в твердих станах вони, як правило, набагато м'якші, ніж іонні тверді речовини. Крім того, тоді як іонні сполуки є хорошими провідниками електрики при розчиненні у воді, більшість ковалентних сполук, будучи електрично нейтральними, є поганими провідниками електрики в будь-якому стані.
Формування ковалентних зв'язків
Неметалеві атоми часто утворюють ковалентні зв'язки з іншими неметалевими атомами. Наприклад, молекула водню, Н 2, містить ковалентний зв'язок між двома своїми атомами водню. Малюнок\(\PageIndex{1}\) ілюструє, чому утворюється ця зв'язок. Починаючи з крайнього правого краю, ми маємо два окремих атома водню з певною потенційною енергією, позначені червоною лінією. Уздовж осі x - відстань між двома атомами. Коли два атоми наближаються один до одного (рухаючись вліво вздовж осі х), їх валентні орбіталі (1 с) починають перекриватися. Поодинокі електрони на кожному атомі водню потім взаємодіють з обома атомними ядрами, займаючи простір навколо обох атомів. Сильне тяжіння кожного спільного електрона до обох ядер стабілізує систему, а потенційна енергія зменшується у міру зменшення відстані зв'язку. Якщо атоми продовжують наближатися один до одного, позитивні заряди в двох ядрах починають відштовхуватися один одного, а потенційна енергія збільшується. Довжина зв'язку визначається відстанню, на якому досягається найменша потенційна енергія.
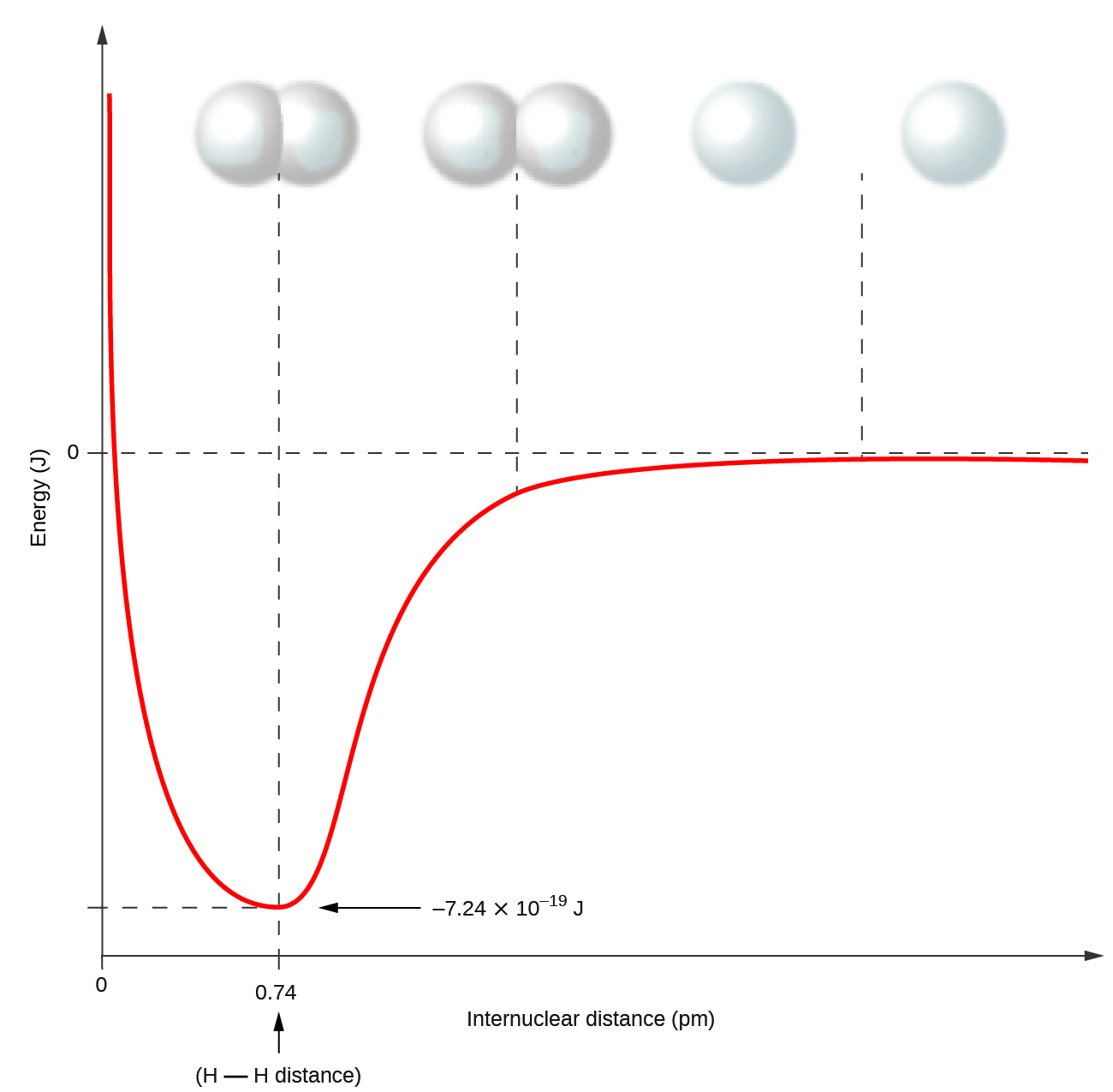
Важливо пам'ятати, що енергія повинна бути додана для розриву хімічних зв'язків (ендотермічний процес), тоді як формування хімічних зв'язків вивільняє енергію (екзотермічний процес). У випадку Н 2 ковалентний зв'язок дуже міцний; необхідно додати велику кількість енергії, 436 кДж, щоб розірвати зв'язки в одному молі молекул водню і змусити атоми відокремлюватися:
\[\ce{H2}(g)⟶\ce{2H}(g)\hspace{20px}ΔH=\mathrm{436\:kJ} \nonumber \]
І навпаки, така ж кількість енергії виділяється, коли один моль молекул Н 2 утворюється з двох моль атомів Н:
\[\ce{2H}(g)⟶\ce{H2}(g)\hspace{20px}ΔH=\mathrm{−436\:kJ} \nonumber \]
Чисті проти полярних ковалентних зв'язків
Якщо атоми, що утворюють ковалентний зв'язок, ідентичні, як в H 2, Cl 2, і інших двоатомних молекулах, то електрони в зв'язку повинні ділитися порівну. Ми називаємо це чистим ковалентним зв'язком. Електрони, що поділяються в чистих ковалентних зв'язках, мають однакову ймовірність знаходження поблизу кожного ядра. У випадку Cl 2 кожен атом починається з семи валентних електронів, а кожен Cl ділить один електрон з іншим, утворюючи одну ковалентну зв'язок:
\[\ce{Cl + Cl⟶Cl2} \nonumber \]
Загальна кількість електронів навколо кожного окремого атома складається з шести незв'язних електронів і двох спільних (тобто зв'язуючих) електронів для восьми загальних електронів, що відповідають кількості валентних електронів в аргоні благородного газу. Оскільки атоми зв'язку ідентичні, Cl 2 також має чистий ковалентний зв'язок.
Коли атоми, пов'язані ковалентним зв'язком, відрізняються, електрони зв'язку діляться, але вже не однаково. Натомість зв'язуючі електрони більше притягуються до одного атома, ніж до іншого, що спричиняє зсув електронної щільності до цього атома. Це нерівномірний розподіл електронів відомий як полярний ковалентний зв'язок, що характеризується частковим позитивним зарядом на одному атомі і частковим негативним зарядом на іншому. Атом, який притягує електрони сильніше, набуває частковий негативний заряд і навпаки. Наприклад, електрони в зв'язку H—Cl молекули хлористого водню проводять більше часу поблизу атома хлору, ніж біля атома водню. Таким чином, в молекулі HCl атом хлору несе частковий негативний заряд, а атом водню має частковий позитивний заряд. \(\PageIndex{2}\)На малюнку показано розподіл електронів в зв'язку H—Cl. Зверніть увагу, що затінена область навколо Cl набагато більше, ніж навколо H. Порівняйте це з малюнком\(\PageIndex{1}\), який показує рівномірний розподіл електронів у неполярному зв'язку H 2.
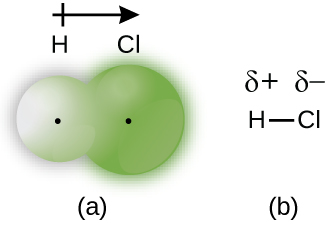
Іноді ми позначаємо позитивні та негативні атоми в полярній ковалентній зв'язку, використовуючи малу грецьку букву «дельта», δ, зі знаком плюс або мінус, щоб вказати, чи має атом частковий позитивний заряд (Δ+) або частковий негативний заряд (δ—). Ця символіка показана для молекули H—Cl на малюнку\(\PageIndex{2b}\).
Електронегативність
Незалежно від того, чи є зв'язок неполярним або полярним ковалентним, визначається властивістю атомів зв'язку, що називається електронегативністю. Електронегативність - це міра тенденції атома притягувати електрони (або електронну щільність) до себе. Він визначає, як розподіляються спільні електрони між двома атомами в зв'язку. Чим сильніше атом притягує електрони в своїх зв'язках, тим більша його електронегативність. Електрони в полярному ковалентному зв'язку зміщуються в бік більш електронегативного атома; таким чином, тим більше електронегативний атом є той, який має частковий негативний заряд. Чим більше різниця в електронегативності, тим більше поляризований розподіл електронів і тим більше часткові заряди атомів.
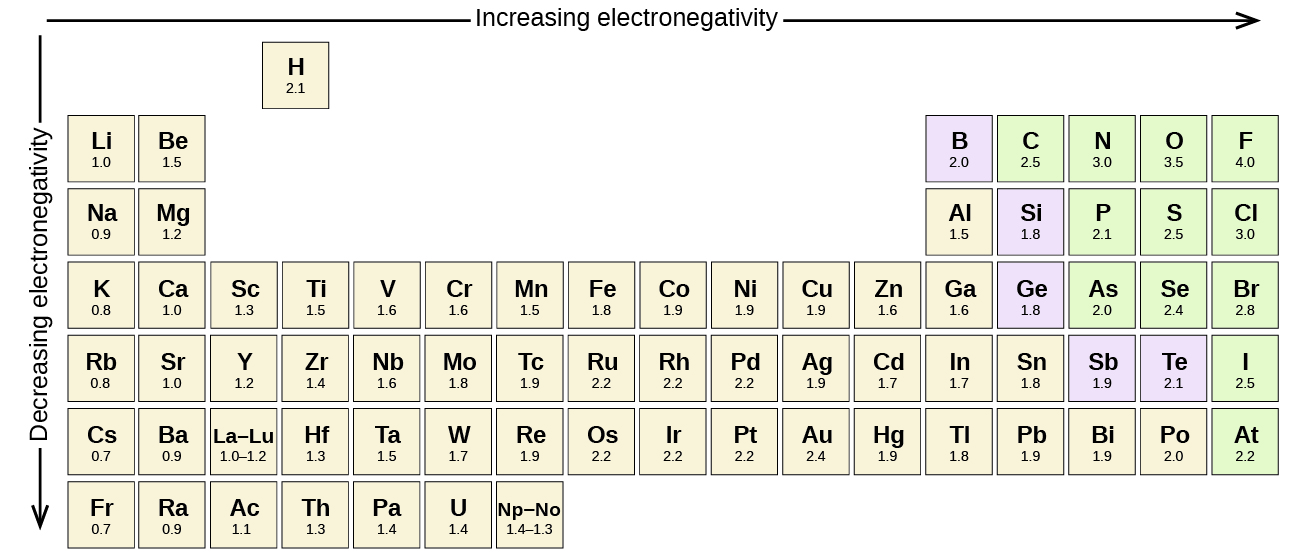
\(\PageIndex{3}\)На малюнку показані значення електронегативності елементів, запропоновані одним з найвідоміших хіміків ХХ століття: Лінусом Полінгом. Загалом, електронегативність збільшується зліва направо через період у періодичній таблиці і зменшується вниз по групі. Таким чином, неметали, які лежать у верхньому правому куті, як правило, мають найвищу електронегативність, причому фтор - самий електронегативний елемент з усіх (EN = 4.0). Метали, як правило, менше електронегативних елементів, а метали групи 1 мають найнижчу електронегативність. Зверніть увагу, що благородні гази виключені з цієї цифри, оскільки ці атоми зазвичай не поділяють електрони з іншими атомами, оскільки вони мають повну валентну оболонку. (Хоча сполуки благородних газів, такі як xEO 2, існують, вони можуть утворюватися лише в екстремальних умовах, і, таким чином, вони не вписуються акуратно в загальну модель електронегативності.)
Лінус Паулінг - єдина людина, яка отримала дві неспільні (індивідуальні) Нобелівські премії: одну за хімію в 1954 році за свою роботу про природу хімічних зв'язків і одну за мир у 1962 році за протидію зброї масового знищення. Він розробив багато теорій і концепцій, які є основоположними для нашого сучасного розуміння хімії, включаючи електронегативність і резонансні структури.

Полінг також сприяв багатьом іншим галузям, крім хімії. Його дослідження серповидноклітинної анемії виявили причину захворювання - наявність генетично успадкованого аномального білка в крові - і проклали шлях до галузі молекулярної генетики. Його робота також мала ключове значення у стримуванні випробувань ядерної зброї; він довів, що радіоактивні наслідки ядерних випробувань становлять ризик для здоров'я населення.
Електронегативність проти спорідненості електронів
Ми повинні бути обережними, щоб не переплутати електронегативність і спорідненість електронів. Електронна спорідненість елемента - це вимірювана фізична величина, а саме енергія, що виділяється або поглинається, коли ізольований атом газової фази набуває електрона, вимірюється в кДж/моль. Електронегативність, з іншого боку, описує, наскільки щільно атом притягує електрони в зв'язку. Це безрозмірна величина, яка обчислюється, а не вимірюється. Полінг вивів перші значення електронегативності шляхом порівняння кількості енергії, необхідної для розриву різних типів зв'язків. Він вибрав довільну відносну шкалу в діапазоні від 0 до 4.
Електронегативність та тип зв'язку
Абсолютне значення різниці електронегативності (ΔEN) двох зв'язаних атомів забезпечує грубу міру полярності, яку слід очікувати в зв'язку, і, таким чином, типу зв'язку. Коли різниця дуже мала або нульова, зв'язок є ковалентним і неполярним. Коли він великий, зв'язок полярний ковалентний або іонний. Абсолютні значення відмінностей електронегативності між атомами в зв'язках H—H, H—Cl та Na—Cl складають 0 (неполярні), 0,9 (полярні ковалентні) та 2,1 (іонні) відповідно. Ступінь, до якої електрони діляться між атомами, варіюється від повністю рівної (чиста ковалентна зв'язок) до зовсім не (іонне зв'язування). \(\PageIndex{4}\)На малюнку показана залежність між різницею електронегативності та типом зв'язку.

Грубе наближення відмінностей електронегативності, пов'язаних з ковалентними, полярними ковалентними та іонними зв'язками, показано на малюнку\(\PageIndex{4}\). Ця таблиця є лише загальним керівництвом, однак, за багатьма винятками. Наприклад, атоми H і F в HF мають різницю електронегативності 1,9, а атоми N і H в NH 3 різницю 0,9, але обидва ці сполуки утворюють зв'язки, які вважаються полярними ковалентними. Так само атоми Na і Cl в NaCl мають різницю електронегативності 2,1, а атоми Mn і I в Mni 2 мають різницю 1,0, але обидві ці речовини утворюють іонні сполуки.
Найкращим керівництвом щодо ковалентного або іонного характеру зв'язку є врахування типів задіяних атомів та їх відносних положень у таблиці Менделєєва. Зв'язок між двома неметалами, як правило, ковалентні; зв'язок між металом і неметалом часто є іонним.
Деякі сполуки містять як ковалентні, так і іонні зв'язки. Атоми в багатоатомних іоні, такі як OH -\(\ce{NO3-}\), і\(\ce{NH4+}\), утримуються полярними ковалентними зв'язками. Однак ці багатоатомні іони утворюють іонні сполуки шляхом об'єднання з іонами протилежного заряду. Наприклад, нітрат калію, KNO 3, містить катіон K + і багатоатомний\(\ce{NO3-}\) аніон. Таким чином, зв'язок в нітраті калію є іонним, що виникає в результаті електростатичного тяжіння між іонами K + і\(\ce{NO3-}\), а також ковалентним між атомами азоту і кисню в\(\ce{NO3-}\).
Полярності зв'язків відіграють важливу роль у визначенні структури білків. Використовуючи значення електронегативності в таблиці A2, організуйте наступні ковалентні зв'язки - всі зазвичай зустрічаються в амінокислотах - в порядку збільшення полярності. Потім позначають позитивні і негативні атоми за допомогою символів Δ+ і δ—:
С—Ч, С—Н, С—О, Н—Ч, О—Ч, —Ч
Рішення
Полярність цих зв'язків збільшується в міру збільшення абсолютного значення різниці електронегативності. Атом з δ— позначенням є більш електронегативним з двох. Таблиця\(\PageIndex{1}\) показує ці зв'язки в порядку збільшення полярності.
| Бонд | ΔEN | полярність |
|---|---|---|
| С—Ч | 0.4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| —Ч | 0.4 | \(\overset{δ−}{\ce S}−\overset{δ+}{\ce H}\) |
| С—Н | 0.5 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce N}\) |
| Н—Ч | 0.9 | \(\overset{δ−}{\ce N}−\overset{δ+}{\ce H}\) |
| С—О | 1.0 | \(\overset{δ+}{\ce C}−\overset{δ−}{\ce O}\) |
| О—Ч | 1.4 | \(\overset{δ−}{\ce O}−\overset{δ+}{\ce H}\) |
Силікони - це полімерні сполуки, що містять, серед іншого, такі типи ковалентних зв'язків: Si—O, Si—C, C—H, C—C, Використовуючи значення електронегативності на малюнку\(\PageIndex{3}\), розташовують зв'язки в порядку збільшення полярності та позначають позитивні і негативні атоми за допомогою символів Δ+ і δ—.
Відповідь
| Бонд | Різниця електронегативності | полярність |
|---|---|---|
| C—C | 0.0 | неполярний |
| С—Ч | 0.4 | \(\overset{δ−}{\ce C}−\overset{δ+}{\ce H}\) |
| Si—C | 0.7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce C}\) |
| Сі—О | 1.7 | \(\overset{δ+}{\ce{Si}}−\overset{δ−}{\ce O}\) |
Резюме
Ковалентні зв'язки утворюються, коли електрони діляться між атомами і притягуються ядрами обох атомів. У чистих ковалентних зв'язках електрони діляться порівну. У полярних ковалентних зв'язках електрони діляться неоднаково, оскільки один атом надає на електрони сильнішу силу тяжіння, ніж інший. Здатність атома притягувати пару електронів в хімічному зв'язку називається його електронегативністю. Різниця в електронегативності між двома атомами визначає, наскільки полярною буде зв'язок. У двоатомній молекулі з двома однаковими атомами немає різниці в електронегативності, тому зв'язок неполярна або чиста ковалентна. Коли різниця електронегативності дуже велика, як це відбувається між металами та неметалами, зв'язок характеризується як іонне.
Глосарій
- довжина зв'язку
- відстань між ядрами двох зв'язаних атомів, при якому досягається найменша потенційна енергія
- ковалентний зв'язок
- зв'язок, що утворюється, коли електрони діляться між атомами
- електронегативність
- схильність атома притягувати електрони в зв'язку до себе
- полярний ковалентний зв'язок
- ковалентний зв'язок між атомами різної електронегативності; ковалентний зв'язок з позитивним кінцем і негативним кінцем
- чистий ковалентний зв'язок
- (також неполярний ковалентний зв'язок) ковалентний зв'язок між атомами ідентичної електронегативності
