22.2: Металеве склеювання
- Page ID
- 24210
Більшість металів мають дуже компактні кристалічні структури за участю або кубічних, центрованих кубічних, або гексагональних близьких упакованих решіток. Таким чином, кожен атом в металі зазвичай оточений 8 або 12 еквівалентними найближчими сусідами. Як кожен атом може бути пов'язаний з такою кількістю своїх побратимів атомів? Хоча є багато електропозитивних атомів для пожертвування електронів, немає електронегативних атомів для їх отримання, і тому іонне з'єднання здається малоймовірним. Звичайне ковалентне зв'язування також може бути виключено. Кожен ковалентний зв'язок вимагав би по одному електрону від кожного атома, а жоден метал не має 12 валентних електронів.
Цінну підказку до характеру склеювання в металах дає їх здатність проводити електрику. Електрони можуть подаватися в один кінець металевого дроту і видалятися з іншого кінця, не викликаючи явних змін у фізико-хімічних властивостях металу. Для обліку цієї свободи руху сучасні теорії металевого зв'язку припускають, що валентні електрони повністю делокалізовані; тобто вони займають молекулярні орбіталі, що належать до металевого кристала в цілому. Ці делокалізовані електрони часто називають електронним газом або електронним морем. Позитивні іони металів, що утворюються втратою цих валентних електронів, можна вважати «плаваючими» у цьому тривимірному морі. Кожен іон утримується на місці за рахунок тяжіння негативно зарядженого електронного моря і відштовхування його побратимів позитивних іонів.
Для того, щоб побачити, як теорія МО може бути застосована до металів, розглянемо спочатку найпростіший випадок - літій. Якщо два атоми літію об'єднані, електрони ядра 1 s залишаються по суті незмінними, оскільки між ними практично немає перекриття. Орбіталі 2s, навпаки, широко перекриваються і виробляють як склеювання, так і антизв'язуючу орбіту. Тільки орбіталь зв'язку буде фактично зайнята двома електронами, як показано на малюнку 1. Дещо вище цих двох орбіталей є група з шести незайнятих орбіталей, що утворюються перекриттям шести 2 р атомних орбіталей (по три на кожному атомі). Припустимо, тепер ми додаємо третій атом до двох вже розглянутих таким чином, щоб сформувати трикутну молекулу формули Li 3. Як показано на малюнку, перекриття трьох орбіталів 2 s виробляє нижчу групу з трьох орбіталей, тоді як перекриття тричі трьох орбіталів 2 р виробляє більш високу групу з дев'яти орбіталей. Знову ж загальна кількість молекулярних орбіталей дорівнює числу атомних орбіталей, з яких вони виведені.
Продовжуючи додавати атоми літію таким чином, ми незабаром досягаємо скупчення атомів літію 25. Ситуація енергетичного рівня для кластера такого розміру є нижчою групою з 25 МО, всі походять від атомних орбіталів 2 s, і вищої групи 75 МО, всі походять від атомних орбіталів 2 р. Зверніть увагу, наскільки тісно рознесені ці енергетичні рівні стали. Це відповідає тенденції до того, щоб енергетичні рівні наближалися, чим більший ступінь делокалізації.
Нарешті, якщо ми додамо достатньо атомів літію до нашого кластера, щоб зробити видимий, вагомий зразок літію, скажімо, 10 20 атомів, відстань між енергією між молекулярними орбіталями стає настільки малим, що неможливо вказати на малюнку або навіть виміряти. Фактично електрон стрибки серед цих рівнів може мати будь-яку енергію в широкій смузі від найнижчого до найвищого. Внаслідок цього цей погляд на електронну структуру в твердих тілах часто називають теорією смуг твердих тіл.
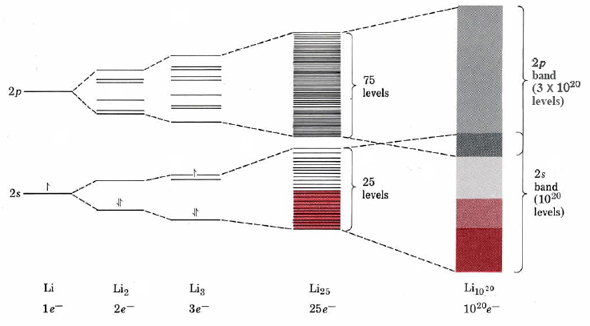
З малюнка також повинно бути зрозуміло\(\PageIndex{1}\), що всі наявні молекулярні орбіталі не повинні бути повністю заповнені електронами. Наприклад, у випадку літію зразок, що містить 10 20 атомів, мав би 10 20 валентних електронів. Оскільки кожен атом матиме одну орбітальну 2 s, а також три орбіталі 2 p, в діапазоні 2 s буде 1 × 10 20 MO і 3 × 10 20 MO в діапазоні 2 р. Якби всі електрони були спарені, для їх утримання потрібно було б лише 0,5 × 10 20 МО найнижчої енергії в діапазоні 2 с. Зверніть увагу, що існує приємна відповідність між наполовину заповненою смугою 2 s макроскопічного зразка та наполовину заповненою орбіталлю 2 s окремого атома Li.
Відповідно до теорії смуг, саме це часткове заповнення обумовлює високу електричну та теплопровідність металів. Якщо до металевого провідника прикладати електричне поле, деякі електрони можуть бути змушені в один кінець, займаючи трохи вищі енергетичні рівні, ніж ті, які вже є. Внаслідок делокалізації ця підвищена електронна енергія доступна по всьому металу. Тому це може призвести до майже миттєвого потоку електронів з іншого кінця провідника.
Аналогічний аргумент стосується передачі теплової енергії. Нагрівання невеликої області в твердому тілі означає збільшення енергії руху атомних ядер і електронів в цій області. Оскільки ядра займають конкретні положення решітки, провідність тепла вимагає передачі енергії між найближчими сусідами. Таким чином, коли край твердого тіла нагрівається, атоми в цій області вібрують більш широко щодо своїх середніх положень решітки.
Вони також спонукають своїх сусідів вібрувати, з часом передаючи тепло внутрішню частину зразка. Цей процес може бути значно прискорено, якщо частина доданої енергії піднімає електрони до більш високої енергії МО в межах неповністю заповненої смуги. Делокалізація електронів дозволяє швидко переносити цю енергію іншим атомним ядрам, деякі з яких можуть бути досить далекі від першоджерела.
Коли енергетична смуга повністю заповнена електронами, механізм, щойно описаний для електричної та теплової провідності, більше не може працювати. У такому випадку ми отримуємо тверду речовину, яка є дуже поганим провідником електрики, або ізолятором. На перший погляд ми можемо очікувати, що Be, Mg та інші лужні землі будуть такими ізоляторами. Оскільки всі атоми цих елементів містять заповнені 2 s підоболонки, ми передбачаємо заповнену смугу 2 s у твердому тілі для всіх них. Те, що це не так, пов'язано з відносно невеликою різницею енергії між рівнями 2 s і 2 p в цих атомах. Як видно з малюнка\(\PageIndex{1}\), це невелике поділ призводить до перекриття між смугами 2 і 2 р. Таким чином електрони можуть легко переміщатися з однієї смуги в іншу і забезпечувати механізм провідності.
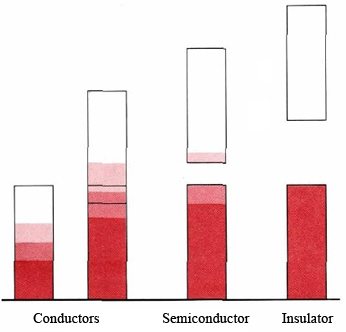
\(\PageIndex{2}\)На малюнку показано чотири різні можливості для смугової структури в твердому тілі. Щоб тверде тіло було провідником, смуга повинна бути або частково заповнена, або повинна перекривати більш високу незаповнену смугу. Коли між смугами є дуже великий енергетичний зазор і нижня смуга заповнена, у нас є ізолятор. Якщо зазор досить малий, ми отримуємо проміжну ситуацію і тверде тіло - напівпровідник. Всі напівметали, знайдені по діагоналі сходів в таблиці Менделєєва, зокрема германій, мають смугову структуру цього типу.
У напівпровіднику ми виявляємо, що зіткнення між атомами та електронами в кристалі іноді досить енергійні, щоб збуджувати електрон у верхню смугу. В результаті завжди є невелика кількість електронів в цій смузі і рівне число дірок (орбіталей, з яких були видалені електрони) в смузі нижчих енергій. Збуджені електрони можуть переносити електричний струм, оскільки їм доступно багато різних рівнів енергії. Так можуть отвори - інші електрони з майже заповненої смуги можуть рухатися вгору або вниз в них, процес, який зменшує або збільшує енергію діри.
У металі електропровідність зменшується з підвищенням температури, оскільки ядра вібрують далі від своїх інших положень і тому частіше заважають рухатися валентні електрони. Точно протилежна поведінка зустрічається для напівпровідників. Зі збільшенням температури все більше електронів збуджуються до смуги провідності вищої енергії, щоб можна було проводити більше струму. Збудження електронів в смузі провідності також може бути здійснено за допомогою фотона, явища, відомого як фотопровідність. Металевий селен часто використовується таким чином в якості фотоелемента в лічильниках світла і «електричних очах».
Електронно-морська модель металів не тільки пояснює їх електричні властивості, але і їх пластичність і пластичність. Коли один шар іонів в електронному морі рухається уздовж одного простору щодо шару під ним, процес ми можемо зображати зображено як:
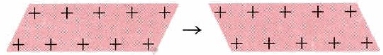
Остаточна ситуація набагато така ж, як і початкова. Таким чином, якщо ми вдаримо по металу молотком, кристали не руйнуються, а просто змінюють свою форму, Це сильно відрізняється від поведінки іонних кристалів.
Електронно-морська модель також дозволяє пояснити, принаймні частково, чому металевий зв'язок помітно міцніший для деяких металів, ніж інші. Хоча лужні метали та деякі лужно-земельні метали можна вирізати ножем, метали, такі як вольфрам, досить тверді, щоб подряпати сам ніж. Хороша ознака того, як міцність металевого з'єднання змінюється залежно від положення в таблиці Менделєєва, дається температурою плавлення.
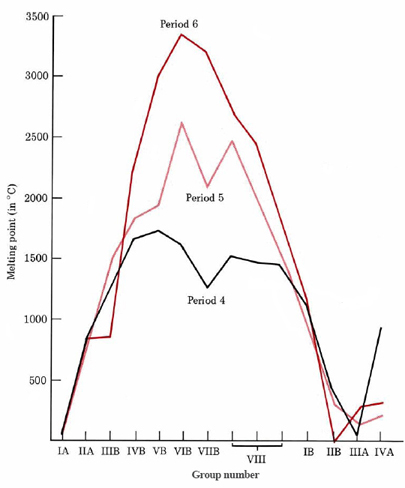
Як видно з малюнка\(\PageIndex{3}\), якщо температура плавлення металів нанесена на номер групи протягом трьох тривалих періодів, відбувається різке збільшення від групи IA до групи VB або VIB, після чого відбувається вирівнювання. Нарешті температура плавлення знову падає до досить низьких значень. Подібна поведінка зустрічається для інших властивостей, таких як температура кипіння, ентальпія плавлення, щільність та твердість.
Початкове збільшення міцності металевого зв'язку при переході від групи IA до VIB можна пояснити кількістю валентних електронів, які метал здатний сприяти електронному морю. Чим більше електронів втрачає атом, тим більшим буде заряд позитивного іона, вбудованого в електронне море, і тим більшою буде щільність імовірності електронів самого електронного моря. Таким чином, чим більше електронів втрачено, тим міцніше іони будуть утримуватися разом. Таким чином, хром з шістьма валентними електронами набагато твердіше, ніж натрій з одним.
Однак ця тенденція не може тривати нескінченно довго. Чим більше електронів видаляється з атома, тим більше енергії потрібно для видалення наступного електрона. Врешті-решт ми виявляємо, що для видалення електрона з металевого ядра потрібно більше енергії, ніж звільняється, помістивши його в електронне море. Міцність склеювання при цьому починає вирівнюватися і з часом знижуватися. Слід зазначити, що міцність металевого зв'язку не залежить виключно від кількості валентних електронів (або періодичного групового числа) елемента. Інші фактори, такі як атомний радіус і тип кристалічної решітки, також важливі. Проте корисно пам'ятати, що температури плавлення та інші властивості, пов'язані з міцністю металевого зв'язку, досягають свого максимуму приблизно в середині кожного перехідного ряду.
