8.5: Колігативні властивості - осмотичний тиск
- Page ID
- 19256
- Визначте напівпроникну мембрану в контексті осмотичного потоку.
- Поясніть, кажучи простою мовою, який фундаментальний процес «рухає» осмотичним потоком.
- Що таке осмотичний тиск, і як воно вимірюється?
- Осмотичний тиск може бути корисним засобом оцінки молекулярної маси речовини, особливо якщо його молекулярна маса досить велика. Поясніть своїми словами, як це працює.
- Що таке зворотний осмос, і яке його основне застосування?
- Поясніть роль осмотичного тиску в збереженні їжі, і наведіть приклад.
- Опишіть роль осмосу в підйомі води в рослині (де знаходиться напівпроникна мембрана?) , і чому це не може бути єдиною причиною у дуже високих дерев.
Осмос - це процес, в якому рідина проходить через мембрану, пори якої дозволяють проходити молекули розчинника, але занадто малі, щоб через них проходили більші молекули розчинених речовин.
Напівпроникні мембрани та осмотичний потік
\(\PageIndex{1}\)На малюнку показана проста осмотична клітина. Обидва відсіки містять воду, але той, що праворуч, також містить розчинену речовину, молекули якої (представлені зеленими колами) занадто великі, щоб пройти через мембрану. Багато штучні і природні речовини здатні виступати в ролі напівпроникних мембран. Стінки більшості рослинних і тваринних клітин потрапляють в цю категорію.
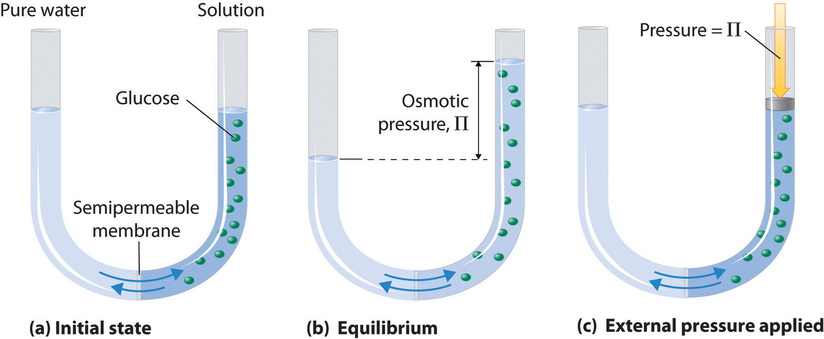
Якщо осередок налаштований так, щоб рівень рідини спочатку був однаковим в обох відсіках, то незабаром ви помітите, що рідина піднімається в лівому відсіку і опускається в праву сторону, вказуючи на те, що молекули води з правого відсіку мігрують через напівпроникну мембрану і в ліве відсік. Ця міграція розчинника відома як осмотичний потік, або просто осмос.
Тенденція виходу речовини з фази зростає з його концентрацією у фазі. Яка сила рухає молекули через мембрану? Це оманливе питання, тому що немає реальної «сили» у фізичному сенсі, крім теплових енергій, якими володіють всі молекули. Осмос є наслідком простої статистики: випадково спрямовані рухи колекції молекул змусять більше залишити область високої концентрації, ніж повернутися до неї; тенденція виходу речовини з фази зростає з його концентрацією у фазі.
Дифузійний та осмотичний потік
Припустимо, ви капніть грудку цукру в чашку чаю, не помішуючи. Спочатку буде дуже висока концентрація розчиненого цукру в нижній частині чашки, а в верхній - дуже низька концентрація. Оскільки молекули знаходяться у випадковому русі, молекул цукру буде переміщатися з області високої концентрації в область низької концентрації, ніж у зворотному напрямку. Рух речовини від області високої концентрації до однієї з низькою концентрацією відомий як дифузія. Дифузія є наслідком градієнта концентрації (який є мірою різниці в тенденції виходу речовини в різних областях розчину).
На окремі молекули дійсно немає особливої сили; дифузія є чисто наслідком статистики. Осмотичний потік - це просто дифузія розчинника через мембрану, непроникну для розчинених молекул. Тепер візьміть два розчини різної концентрації розчинника, і розділіть їх напівпроникною мембраною (рис.\(\PageIndex{2}\)). Будучи напівпроникною, мембрана по суті невидима для молекул розчинника, тому вони дифундують від області високої концентрації до області низьких концентрацій так само, як і раніше. Цей потік розчинника становить осмотичний потік, або осмос.
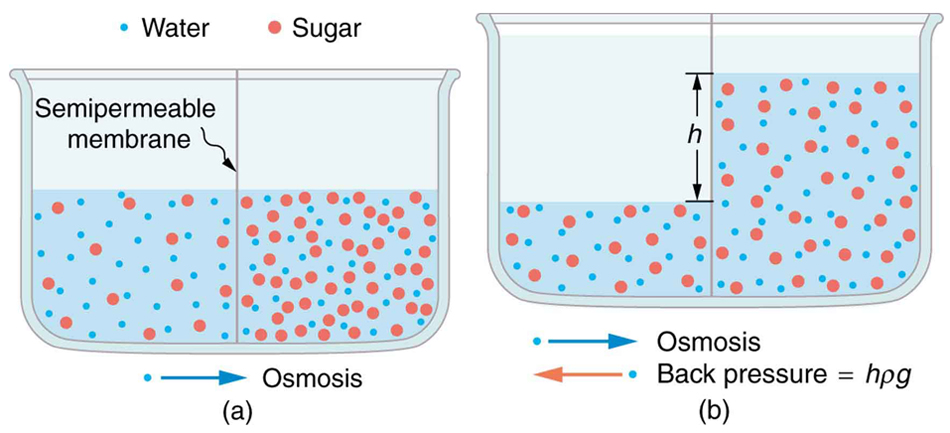
Малюнок\(\PageIndex{2}\): Осмотичний осмотичний потік (а) Два цукрово-водні розчини різної концентрації, розділені напівпроникною мембраною, яка пропускає воду, але не цукор. Осмос буде праворуч, так як вода там менш концентрована. (b) Рівень рідини підвищується до тих пір, поки зворотний тиск ρ gh не дорівнює відносному осмотичному тиску; тоді чиста передача води дорівнює нулю. (CC-BY; OpenStax).
\(\PageIndex{2}\)На малюнку показані молекули води (сині), що вільно проходять в обох напрямках через напівпроникну мембрану, в той час як більші молекули розчинених речовин залишаються в пастці в лівому відсіку, розбавляючи воду і зменшуючи її тенденцію виходу з цієї клітини, порівняно з водою в правій стороні. Це призводить до чистого осмотичного потоку води з правого боку, який триває до тих пір, поки підвищений гідростатичний тиск з лівого боку не підніме тенденцію виходу розведеної води до тієї чистої води в 1 атм, в цей момент досягається осмотична рівновага.
Осмотичний потік - це просто дифузія розчинника через мембрану, непроникну для розчинених молекул.
За відсутності напівпроникної мембрани дифузія триватиме до тих пір, поки концентрації всіх речовин не стануть рівномірними по всій рідкій фазі. З напівпроникною мембраною на місці, і якщо один відсік містить чистий розчинник, цього ніколи не може статися; незалежно від того, скільки рідини протікає через мембрану, розчинник у правій частині завжди буде більш концентрованим, ніж у лівій. Осмос буде тривати нескінченно довго, поки у нас не закінчиться розчинник, або щось інше не зупинить його.
Осмотична рівновага і осмотичний тиск
Одним із способів зупинити осмос є підвищення гідростатичного тиску на стороні розчину мембрани. Цей тиск стискає молекули розчинника ближче один до одного, підвищуючи їх тенденцію виходу з фази. Якщо ми застосуємо достатній тиск (або дозволимо тиску наростати за рахунок осмотичного потоку рідини в закриту область), тенденція виходу молекул розчинника з розчину в кінцевому підсумку підніметься до молекул у чистому розчиннику, і осмотичний потік виникне. Тиск, необхідний для досягнення осмотичної рівноваги, відомий як осмотичний тиск. Зверніть увагу, що осмотичний тиск - це тиск, необхідний для зупинки осмосу, а не для його підтримки.
Осмотичний тиск - це тиск, необхідний для зупинки осмотичного потоку Загальноприйнято говорити, що розчин «має» осмотичний тиск «х атмосфер». Важливо розуміти, що це означає не що інше, як те, що до розчину необхідно прикладати тиск цієї величини, щоб запобігти надходженню чистого розчинника в цей розчин через напівпроникну мембрану, що розділяє дві рідини.
Осмотичний тиск і концентрація розчинених речовин
Голландський вчений Якобус Ван'т Гофф (1852-1911) був одним з гігантів фізичної хімії. Він виявив це рівняння після випадкової зустрічі з другом ботаніка під час прогулянки в парку в Амстердамі; ботанік дізнався, що осмотичний тиск збільшується приблизно на 1/273 для кожного ступеня підвищення температури. Ван Гофф відразу ж схопив аналогію з ідеальним газовим законом. Осмотичний тиск\(\Pi\) розчину, що містить\(n\) молі розчинених частинок в об'ємному розчині,\(V\) задається рівнянням Ван Гоффа:
\[\Pi = \dfrac{nRT}{V} \label{8.4.3}\]
в якому
- \(R\)є газовою постійною (0,0821 л атм моль —1 К —1) і
- \(T\)абсолютна температура.
На відміну від необхідності використання розчиненої молярності для розрахунку впливу нелеткої розчиненої речовини на зміни температури замерзання та кипіння розчину, ми можемо використовувати розчинену молярність для розрахунку осмотичного тиску.
Зверніть увагу, що фракція\(n/V\) відповідає молярності (\(M\)) розчину недисоціаційної розчиненої речовини, або вдвічі більшій молярності повністю дисоційованого розчиненого речовини, такого як\(NaCl\). У цьому контексті молярність відноситься до підсумованої загальної кількості концентрацій всіх розчинених видів. Отже, рівняння\ ref {8.4.3} може бути виражено як
\[\Pi =MRT \label{8.4.3B}\]
Згадуючи, що\(\Pi\) is the Greek equivalent of P, the re-arranged form \(\Pi V = nRT\) з вищевказаного рівняння має виглядати звично. Приблизно в кінці 19 століття було витрачено багато зусиль, щоб пояснити схожість між цим співвідношенням і законом ідеального газу, але насправді рівняння Ван Гоффа виявляється лише дуже грубим наближенням закону реального осмотичного тиску, який значно складніший і був отриманий після формулювання Ван 'т Гоффа. Таким чином, це рівняння дає достовірні результати тільки для надзвичайно розбавлених («ідеальних») розчинів.
Відповідно до рівняння Ван Гоффа, ідеальний розчин, що містить 1 моль розчинених частинок на літр розчинника при 0° С, матиме осмотичний тиск 22,4 атм.
Морська вода містить розчинені солі при загальній іонній концентрації близько 1,13 моль L —1. Який тиск необхідно застосовувати, щоб запобігти осмотичному надходженню чистої води в морську воду через мембрану, проникну тільки для молекул води?
Рішення
Це просте застосування Equation\ ref {8.4.3B}.
\[ \begin{align*} \Pi &= MRT \\[4pt] &= (1.13\; mol /L)(0.0821\; L \,atm \,mol^{–1}\; K^{–1})(298\; K) \\[4pt] &= 27.6\; atm \end{align*}\]
Визначення молекулярної маси за осмотичним тиском
Оскільки всі колігативні властивості розчинів залежать від концентрації розчинника, їх вимірювання може служити зручним експериментальним інструментом для визначення концентрації, а значить і молекулярної маси розчиненої речовини. Осмотичний тиск особливо корисний у цьому плані, оскільки невелика кількість розчиненої речовини призведе до набагато більшої зміни цієї кількості, ніж температура кипіння, температура замерзання або тиск пари. Навіть молярний розчин 10 -6 матиме вимірюваний осмотичний тиск. Визначення молекулярної маси дуже часто проводиться на білках або інших високомолекулярних полімерах. Ці речовини, завдяки своїм великим молекулярним розмірам, як правило, є лише помірно розчинними в більшості розчинників, тому вимірювання осмотичного тиску часто є єдиним практичним способом визначення їх молекулярних мас.
Встановлено, що осмотичний тиск розчину бензолу, що містить 5,0 г полістиролу на літр, становить 7,6 торр при 25°C.
Рішення:
осмотичний тиск:
\[ \begin{align*} \Pi &= \dfrac{7.6\, torr}{760\, torr\, atm^{–1}} \\[4pt] &= 0.0100 \,atm \end{align*} \]
Використовуючи форму рівняння Ван Гоффа (Equation\ ref {8.4.3}), PV = nRT, кількість молів полістиролу дорівнює
n = (0,0100 атм) (1 л) ÷ (0,0821 л атм моль —1 К —1) (298 К) = 4,09 х 10 —4 моль
Молярна маса полістиролу:
(5,0 г) ÷ (4,09 х 10 -4 моль) = 12200 г моль —1.
Експеримент для демонстрації цього досить простий: чистий розчинник вводиться в одну сторону клітини, яка розділена на дві частини напівпроникною мембраною. Полімерний розчин поміщають в іншу сторону, яку укладають і з'єднують з манометром або будь-яким іншим видом манометра. Коли молекули розчинника дифундують у клітинку розчину, тиск накопичується; врешті-решт цей тиск відповідає осмотичному тиску розчину, і система знаходиться в осмотичній рівновазі. Осмотичний тиск зчитується з вимірювального приладу і підставляється в рівняння Ван Гоффа, щоб знайти кількість молів розчиненої речовини.
