8.3: Колігативні властивості - Закон Рауля
- Page ID
- 19295
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Створіть закон Рауля своїми словами, і поясніть, чому це має сенс.
- Що ми маємо на увазі під тенденцією виходу молекули з фази? Як ми можемо це спостерігати чи вимірювати?
- Поясніть, чому висота точки кипіння природно випливає із закону Рауля.
- Пояснити депресію точки замерзання, безумовно, трохи складніше, але ви все ж повинні бути в змозі пояснити, як застосування солі на покритій льодом дорозі може призвести до танення льоду.
Тенденція молекул до виходу з рідкої фази в газову фазу частково залежить від того, наскільки збільшення ентропії може бути досягнуто при цьому. Випаровування молекул розчинника з рідини завжди призводить до великого збільшення ентропії через більшого обсягу, займаного молекулами в газоподібному стані. Але якщо рідкий розчинник спочатку «розбавлений «розчиненою речовиною, його ентропія вже більша для початку, тому кількість, на яке він може збільшитися при надходженні в газову фазу, буде менше. Відповідно, буде менша тенденція до потрапляння молекул розчинника в газову фазу, і тому тиск пари розчину зменшується зі збільшенням концентрації розчиненої речовини і зменшенням концентрації розчинника.
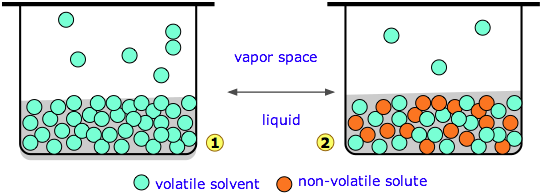
Число 55,5 моль L —1 (= 1000 г L —1 ÷ 18 г моль —1) корисно пам'ятати, якщо ви багато маєте справу з водними розчинами; це являє собою концентрацію води в чистій воді. (Строго кажучи, це моляльна концентрація H 2 O; це лише молярна концентрація при температурі близько 4° C, де щільність води найближча до 1.000 г см —1.)
Діаграма 1 (вгорі зліва) являє собою чисту воду, концентрація якої в рідині 55,5 М. Крихітна частка молекул Н 2 О буде виходити в паровий простір, і якщо верхня частина ємності закрита, тиск водяної пари накопичується до досягнення рівноваги. Як тільки це станеться, молекули води продовжують проходити між рідиною і парою в обох напрямках, але з однаковою швидкістю, тому парціальний тиск Н 2 О в парі залишається постійним при значенні, відомому як тиск пари води при певній температурі.
На малюнку\(\PageIndex{1}\) ми замінили частку молекул води речовиною, яка має нульовий або незначний тиск пари - нелеткою розчиненою речовиною, такою як сіль або цукор. Це призводить до розведення води, зменшення її схильності до виходу і, отже, тиску пари.
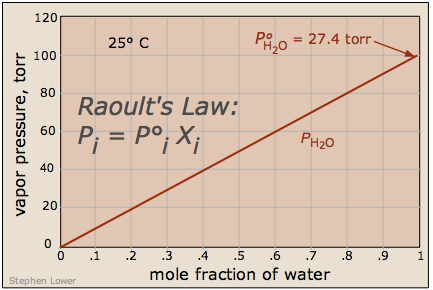
Важливо пам'ятати, що зниження тиску пари такого розчину прямо пропорційно частці [летючих] розчинених молекул в рідині - тобто мольної фракції розчинника. Знижений тиск пари дається законом Рауля (1886 р.):

\[\chi_{solvent} = 1–\chi_{solute}.\]
Оцініть тиск пари 40% (Вт/Вт) розчину звичайного тростинного цукру (С 22 О 11 Н 22, 342 г моль —1) у воді. Тиск пари чистої води при цій конкретній температурі становить 26,0 торр.
Рішення
100 г розчину містить (40 г) ÷ (342 г моль —1) = 0,12 моль цукру і (60 г) ÷ (18 г моль —1) = 3,3 моль води. Мольтова частка води в розчині становить
\[ \dfrac{3.3}{3.3 + 12} = 0.96\]
а тиск його пари складе 0,96 × 26,0 торр = 25,1 торр.
Тиск пари води при 10° С становить 9,2 торр. Оцініть тиск пари при цій температурі розчину, приготованого шляхом розчинення 1 моль CaCl 2 в 1 л води.
Рішення
Кожен моль CaCl 2 дисоціює на один моль Са 2 + і дві молі Cl 1—, даючи в цілому три молі розчинених частинок. Кротова частка води в розчині буде
\[ \dfrac{55.5}{3 + 55.5} = 0.95\]
Тиск пари складе 0,95 × 9,2 торр = 8,7 торр.
Оскільки сума всіх мольних фракцій в суміші повинна бути одиницею, то з цього випливає, що чим більше молів розчиненого речовини, тим менше буде мольна фракція розчинника. Також, якщо розчиненою речовиною є сіль, яка дисоціює на іони, то частка молекул розчинника буде ще менше.
