Вступ до твердих тіл
- Page ID
- 24480
Навички для розвитку
- Пов'язати різні типи твердих тіл з 3 основними типами склеювання
- Опишіть деякі властивості твердих тіл
Тверді речовини - одна з найцікавіших і важливих тем у загальній хімії, оскільки вони важливі для багатьох речей. Ми використовуємо тверді речовини як будівельні матеріали, щоб виготовляти інструменти всіх видів, виготовляти комп'ютерні чіпи, накопичувачі енергії, сонячні батареї, каталізатори... Практично вся технологія залежить від властивостей твердих речовин.
Типи твердих тіл
Ми можемо класифікувати тверді речовини різними способами. Найпоширеніший спосіб - за типом склеювання. Існує три основних види склеювання. Поки ми зосередилися на ковалентному зв'язку. Існує два типи ковалентних твердих речовин: молекулярні і ковалентно-мережеві. Молекулярні тверді речовини складаються з ковалентних молекул, а тверді речовини утримуються разом силами Ван дер Ваальса між молекулами. Ці молекулярні тверді речовини зазвичай мають низькі температури плавлення і їх легко зламати, оскільки сили між молекулами слабкі. Тверді тіла ковалентної мережі відрізняються тим, що немає окремих молекул: все тверде тіло утримується разом ковалентними зв'язками між атомами. Наприклад, в алмазі кожен атом С робить 4 ковалентних зв'язку з 4 іншими атомами С в чотиригранному розташуванні. Тверді речовини ковалентної мережі зазвичай мають високі температури плавлення і відносно тверді, оскільки вони утримуються дуже міцними зв'язками. Алмаз - найтвердіший відомий матеріал, тому що зв'язки C-C є одними з найсильніших відомих одиночних зв'язків. (Чи могли б ви зробити ковалентну мережу твердою, використовуючи ще більш міцні зв'язки?)
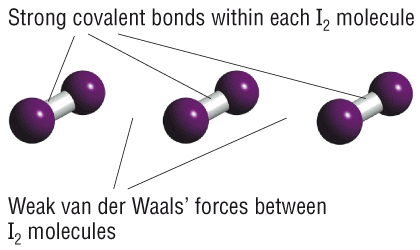

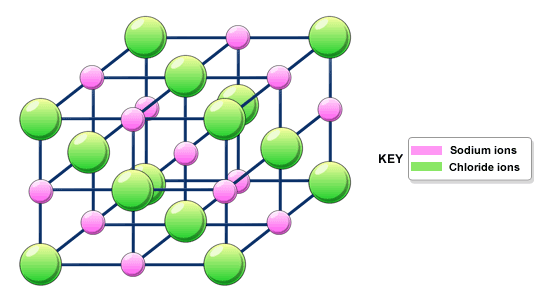
Ми також трохи поговорили про іонне склеювання. В основному, ви, напевно, знаєте, що більшість іонних матеріалів - це тверді речовини при кімнатній температурі, і вони виготовлені з іонів, таких як катіон металу та неметалевий аніон. Іонні тверді речовини утримуються між собою сильними електростатичними (закон Кулона) силами між іонами, тому вони зазвичай тверді і мають високі температури кипіння.
Існує також багато твердих речовин, які знаходяться на кордоні між ковалентним та іонним: вони виготовлені з металів та неметалів, але важливі як ковалентне, так і іонне з'єднання. Сюди входить більшість гірських порід, мінералів і кераміки. Наприклад, сапфір, ще один з найтвердіших матеріалів, - оксид алюмінію.

Нарешті, є металеве склеювання. Металевий зв'язок - це свого роду ковалентне з'єднання, оскільки воно передбачає спільне використання електронів. Найпростішою моделлю металевого зв'язку є модель «моря електронів», яка уявляє, що атоми сидять в морі валентних електронів, які делокалізовані (розкидані) по всіх атомах. Оскільки між окремими атомами немає специфічних зв'язків, метали є більш гнучкими, ніж тверді тіла ковалентної мережі. Атоми можуть рухатися, і електронне море буде тримати їх разом. Деякі метали дуже тверді і мають дуже високі температури плавлення, а інші м'які і мають низькі температури плавлення. Це приблизно залежить від кількості валентних електронів, які утворюють море.
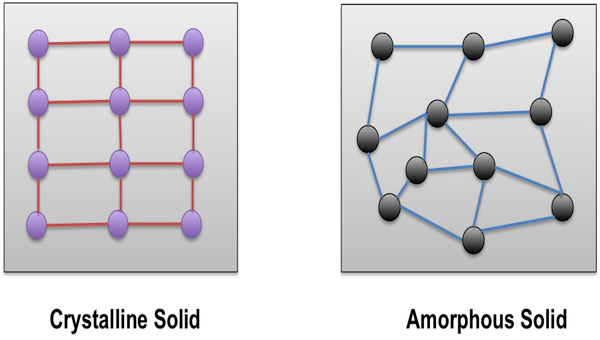
Існують насправді і деякі інші типи твердих речовин. Один із способів розділити тверді речовини на категорії - це кристалічний або аморфний. Кристалічні тверді речовини мають впорядковані розташування атомів або іонів. Аморфні (що означає «без форми») тверді речовини мають дезорганізовані домовленості. Метали, іонні тверді речовини, ковалентна мережа та молекулярні тверді речовини зазвичай є принаймні кристалічними та впорядкованими, хоча вони ніколи не є повністю досконалими. Кристалічні тверді речовини часто мають грані або грані (плоскі поверхні під певними кутами), як і більшість дорогоцінних каменів, які використовуються для виготовлення ювелірних виробів. Важливим видом аморфних матеріалів є полімери, до складу яких входить більшість пластмас. Полімери, як правило, виготовляються з дійсно довгих, худих ковалентних молекул, які заплутані між собою. Вони часто гнучкі. Є також аморфні камені, такі як опал (який зазвичай полірується до округлої форми, тому що він не робить приємних граней).
Ми також можемо класифікувати тверді речовини за їх розміром. Наноматеріали - тверді речовини, які мають дуже малі розміри. Наноматеріали можуть бути виготовлені з металевих або ковалентно-сітчастих матеріалів, але через своїх невеликих розмірів вони мають різні властивості.
Властивості твердих тіл
Коли ви читаєте про тверді речовини, подумайте про те, як структура пов'язана з важливими властивостями твердих речовин, які визначають, як ми можемо її використовувати. Тут ми опишемо деякі з цих властивостей.
Для конструкційних матеріалів (матеріалів, які ми використовуємо для побудови, підтримки, захисту) міцність і твердість можуть бути дуже важливими. Твердість означає, наскільки легко змінити форму матеріалу, наприклад, розтягуючи або вм'ятивши його, або наскільки він еластичний при зіткненні. Міцність матеріалів означає, наскільки добре вони протистоять прикладеним силам, таким як стиснення або розтягування. Це важливо, якщо ви хочете побудувати міст або будівлю, наприклад. Ми опишемо тверді речовини як крихкі, якщо вони розбиваються на шматки, такі як іонні або ковалентні тверді речовини. Метали зазвичай не розбиваються на шматки, але вони можуть розтягуватися на дроти (пластичність) і бути товчені в листи (ковкість).
Провідність - ще один важливий вид властивості. Чи проводять матеріали електрику? Якщо так, то скільки? Вони проводять звук або тепло, і наскільки добре? Ми також можемо знати про реакційну здатність твердих тіл. Чи є вони інертними (нереактивними) при високій температурі в кислоті? Чи каталізують (прискорюють) певні реакції на своїх поверхнях? Чи поглинають вони або випромінюють світло, і якщо так, то при якій енергії? Вони магнітні? Вони пористі (повні крихітних отворів)? Всі ці властивості можуть бути важливі для різних застосувань.
Валентність і тверді речовини
Коли ви читаєте про тверді речовини, може бути корисно згадати ідеї про валентність, які ми обговорювали раніше. Різні атоми мають різну кількість валентних електронів, що визначає, скільки електронів вони зазвичай втрачають або набирають, і скільки зв'язків вони зазвичай складають. Інший спосіб подумати про це - з координаційним числом, який є тим, скільки інших атомів взаємодіє з одним атомом. У молекулах координаційні числа зазвичай досить низькі, як 1-4. У іонних твердих тілах кожен іон може мати 2-8 сусідів. У металах кожен атом може мати 12 сусідів. Стабільне координаційне число атома або іона залежить від ситуації, і від того, скільки електронів йому потрібно. Щоб сформувати ковалентно-мережеве тверде тіло, принаймні деякі атоми у формулі повинні складати багато зв'язків (наприклад, вуглецю або кремнію, який зазвичай робить 4 зв'язку). Ви не можете створити хорошу мережу лише з атомами, які утворюють 2 зв'язки, тому що ви не можете мати гілок. У молекулярних твердих тілах всі зв'язки знаходяться всередині молекули. У металах, щоб отримати електрони, які вони хочуть, оскільки вони починаються з меншою кількістю валентних електронів, вони зазвичай мають високі координаційні числа, що вимагає, щоб вони мали певні структури.
дефекти
Дійсно важливою темою в твердих тілах є дефекти або місця, де розташування атомів не є ідеальним. Всі приклади конкретної молекули абсолютно однакові, тому що якщо один з атомів інший або розташування інше, це буде інша молекула. Але тверді речовини можуть бути в основному однією формулою та структурою, з деякими домішками або місцями, де структура не є точно впорядкованою. Насправді тверді речовини завжди мають дефекти. Багато найважливіших властивостей твердих тіл залежать від дефектів, як-от наявність декількох атомів різних типів, або відсутнього атома тощо Тому пам'ятайте, що іноді об'ємний опис (як більша частина твердого тіла) насправді не є найважливішою частиною. Найважливішою частиною може бути рідкісне місце, де кілька атомів не знаходяться на своїх місцях. Це може зробити тверді речовини дуже заплутаними для вивчення!