Ефективний ядерний заряд
- Page ID
- 24549
Навички для розвитку
- Поясніть різницю між ядерним зарядом і ефективним ядерним зарядом
Причиною приєднання електронів до атомів є закон Кулона тяжіння між позитивно зарядженим ядром і негативно зарядженими електронами. Без ядерного заряду, що тримається за електрони, у них не було б причин залишатися на орбіталах поблизу ядер. Так що має сенс, що енергія орбіталей і їх розмір залежать від ядерного заряду. Наприклад, еквівалентні орбіталі стають нижчими за енергією і меншими (більша щільність ближче до ядра), коли ядерний заряд збільшується. (Якщо ви хочете побачити, де ядерний заряд знаходиться в орбітальних рівняннях, перейдіть за цим посиланням і натисніть на орбітальну; потім прокрутіть вниз, щоб побачити рівняння. Z eff - ефективний ядерний заряд.)
Є 2 причини, чому електрон може не витрачати стільки часу насправді поруч з ядром, хоча є привабливість. Одним з них є момент імпульсу. Пам'ятайте з фізики, що кутовий момент - це в основному імпульс в напрямку «навколо центру», помножений на r, відстань від центру. Таким чином, якщо електрон знаходиться «в» ядрі, r = 0, а момент імпульсу дорівнює 0. Пам'ятайте також друге квантове число - це квантове число моментного моменту, яке відповідає орбіталям s, p, d і f. Для s орбіталей, = 0, а момент імпульсу дорівнює нулю, тому електрон може бовтатися в ядрі. Для інших форм (p, d, f) момент імпульсу не дорівнює нулю, і є вузол біля ядра. Так що тільки орбіталі можуть бовтатися прямо біля ядра.
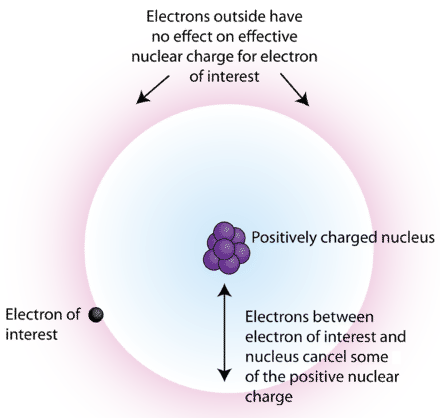
Інша причина, по якій електрон не зможе наблизитися до ядра, полягає в тому, що інші електрони. Електрони відштовхують один одного, і через принцип виключення в кожній орбіті може бути тільки 2 електрона. Тому подумайте про літій, елемент 3. Його перші 2 електрони знаходяться в 1с. Третій електрон - через 2с. Оскільки основне квантове число більше, електрон 2s зазвичай знаходиться далі від ядра, ніж електрони 1s. Це означає, що часто електрони 1s знаходяться між електроном 2s і ядром. Це означає, що загальний кулонівський потяг, який відчувається електроном 2s, менший, ніж ви б обчислили, використовуючи лише ядерний заряд і відстань, тому що існує також електронно-електронне відштовхування. Це і є основою ефективного ядерного заряду. Через електронно-електронні відбиття зовнішні електрони в багатоелектронному атомі відчувають менше тяжіння до ядра, тому вони відчувають, що ядерний заряд менший, ніж він є насправді. Так що ефективний ядерний заряд завжди менше, ніж реальний ядерний заряд.
Ефективний ядерний заряд залежить від типу електрона. Електрони в s орбіталів, навіть 4s або 5s, все ще проводять деякий час прямо біля ядра, і коли вони там, вони відчувають повний ядерний заряд, тому в середньому електрони s відчувають ядерний заряд ближче до фактичного ядерного заряду. Електрони на орбіталах d або f насправді не наближаються до ядра, тому вони дійсно блокуються або екрануються внутрішніми електронами. Вони відчувають менший ефективний ядерний заряд, ніж s електрони. А електрони в p орбіталів знаходяться між ними.
Зазвичай, якщо ви робите будь-який розрахунок орбіталей для багатоелектронних атомів, ви будете використовувати ефективний ядерний заряд замість фактичного ядерного заряду. Розмір і енергія орбіталів будуть залежати від ефективного ядерного заряду, а не від фактичного ядерного заряду. Розмір і енергія орбіталів визначає деякі дуже важливі хімічні властивості, включаючи розмір елемента (як атома, іона або в молекулі) і те, наскільки легко він втрачає або отримує електрони. Електрони займають більшу частину простору в атомі, тому розмір орбіти вказує вам розмір. Втрата електронів вимагає енергії, за допомогою якої вони пов'язані, яка приблизно така ж, як і орбітальна енергія. Додавання електронів працює лише в тому випадку, якщо орбітальна, куди вони підуть, нижча енергія, ніж звідки вони прийшли.
Зовнішнє посилання
- Ефективний ядерний заряд (10 хв)