Парціальний тиск
- Page ID
- 24529
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \) \( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)\(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\) \(\newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\) \( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\) \( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\) \( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\) \( \newcommand{\Span}{\mathrm{span}}\)
Навички для розвитку
- Визначення парціального тиску за допомогою математичних рівнян
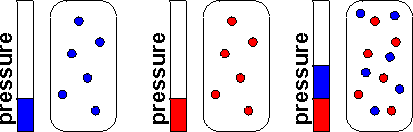
Що робити, якщо у нас суміш різних газів? Ми можемо знати, скільки кожного з них є. Мольову частку конкретного газу А можна визначити як число молів А, поділене на загальну кількість молів газу:
\[x_{A} = \frac{n_{A}}{n_{total}}\]
Тоді ми можемо визначити парціальний тиск А як
\[p_{A} = x_{A}P\]
Це працює для реальних або ідеальних газів. Парціальний тиск часто використовується для опису концентрацій газів. Якщо газ ідеальний, то парціальний тиск - це той самий тиск, який би зробив газ, якби всі інші компоненти суміші там не було, тому що
\[p_{A} = \frac{n_{A}RT}{V}\]
У реальному газі це може бути неправдою, оскільки різні гази можуть взаємодіяти трохи по-різному.