1.2: Цільова та нецільова токсичність
- Page ID
- 24607
Пройшовши цей урок, ви зможете:
- Обговоріть відмінності між цілеспрямованою та нецільовою токсичністю.
- Поясніть, як поглинання, розподіл, і метаболізм токсиканта може впливати на його вплив в організмі.
- Обговоріть типи взаємодій, які можуть відбуватися між токсикантом та його молекулою мішені, і як вони впливають на господаря.
- Поясніть важливість біоактивації в патофізіології ацетамінофен-токсикозу.
токсиканти
 1. Токсичні ефекти виникають, коли кінцевий токсикант реагує з молекулою господаря, клітиною або тканиною, викликаючи вторинну серію подій, що призводять до токсичної травми.
1. Токсичні ефекти виникають, коли кінцевий токсикант реагує з молекулою господаря, клітиною або тканиною, викликаючи вторинну серію подій, що призводять до токсичної травми.
2. Кінцевим токсикантом може бути оригінальний ксенобіотик, якому піддавався господар, метаболіт вихідного ксенобіотика, реактивні форми, породжені вихідним ксенобіотиком або його метаболітом, або зміненою або незміненою ендогенною сполукою.
3. Деякі токсиканти можуть взаємодіяти з будь-якою сполукою, з якою вони стикаються, тоді як інші токсиканти надають свою дію, взаємодіючи з конкретними ділянками (мішенями) на молекулах.
4. Визначено типи взаємодії токсикантів та їх мішеней: ковалентне зв'язування, нековалентне зв'язування, перенесення електронів, абстрагування водню, ферментативні реакції.
Ковалентне зв'язування
Ковалентне зв'язування утворює практично незворотні зв'язки між молекулою токсиканта та мішенню; утворюється молекула-токсикант-мішень називається аддуктом. Ковалентне зв'язування відбувається найчастіше, коли електрофільні (що шукають електрон) сполуки з'єднуються з нуклеофільними (електрондонуючими) сполуками. Нуклеофільні сполуки рясні в біологічних системах і включають клітинні макромолекули, такі як білки, нуклеїнові кислоти та фосфоліпіди.
Ковалентне зв'язування токсикантів з клітинними білками може пригнічувати життєво важливі ферментні реакції, змінювати функцію білка, пригнічувати або стимулювати мембранні рецептори або пошкоджувати мембранні білки. Ковалентне зв'язування токсикантів з нуклеїновими кислотами, такими як РНК і ДНК, може пригнічувати або змінювати синтез білка або викликати мутації ДНК, які можуть призвести до клітинної дисфункції або канцерогенезу. Ковалентне зв'язування токсикантів з фосфоліпідами може призвести до прямого пошкодження клітинних або органельних мембран або може спровокувати перекисне окислення ліпідів, про що піде мова далі.
Вплив знеболюючого препарату ацетамінофен є найпоширенішою причиною травми печінки, спричинених наркотиками, у людей, що становить 30 000 госпіталізацій та приблизно 1200 трансплантацій печінки, що проводяться щороку в Сполучених Штатах. Більшість випадків ацетамінофен-індукованої травми печінки є результатом випадкових або навмисних передозувань. Однак певні фактори ризику можуть збільшити ймовірність розвитку травми печінки при терапевтичних дозах ацетамінофену. Ці фактори ризику включають хронічне споживання алкоголю, прийом наркотиків або трав, які змінюють рівень або шляхи антиоксидантів печінки, недоїдання або підвищення віку з подальшим порушенням або зниженням нормальних метаболічних шляхів печінки, а також наявність хронічних захворювань печінки (наприклад, вірусний гепатит).
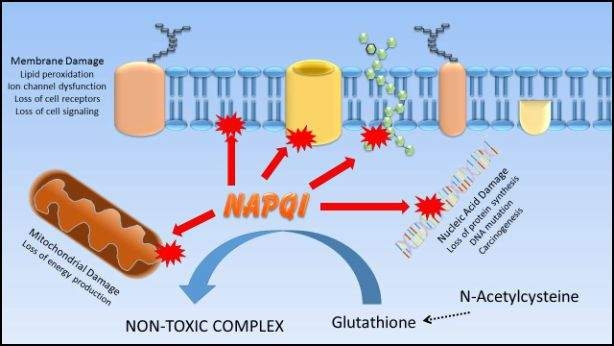
Сам по собі ацетамінофен не викликає травми печінки. За звичайних обставин ацетамінофен перетворюється в печінці переважно в нетоксичні метаболіти, які потім виводяться з організму. Однак близько 10% ацетамінофену біоактивується ферментами CYP450 до токсичного метаболіту під назвою N-ацетил-P-бензохінонеймін (NAPQI); за звичайних обставин печінка може нейтралізувати NAPQI шляхом зв'язування його з молекулою антиоксиданту глутатіону. Однак у ситуаціях передозування або коли рівень глутатіону низький (як при хронічних захворюваннях печінки або неправильному харчуванні) кількість утвореного NAPQI перевищує здатність глутатіону зв'язувати його, і замість цього NAPQI ковалентно зв'язується з макромолекулами в гепатоциті, викликаючи гепатоцелюлярні травми і смерть. Лікування передозування ацетамінофену часто включає введення антиоксидантів та попередників глутатіону, таких як N-ацетилцистеїн, у спробі забезпечити альтернативні молекули, з якими NAPQI може зв'язуватися.
Нековалентне зв'язування токсикантів з молекулами-мішенями передбачає утворення відносно слабких водневих або іонних зв'язків. Через відносно слабких зв'язків, що утворилися, нековалентне зв'язування, як правило, оборотне. Нековалентне зв'язування зазвичай спостерігається з токсикантами, які взаємодіють з клітинними мембранними рецепторами, внутрішньоклітинними рецепторами, деякими ферментними системами та мембранними іонними каналами. Нековалентний зв'язок з цими структурами може призвести до надмірно- або під стимуляцією нормальної функції. Ці взаємодії можуть призвести до зміни міжклітинної та внутрішньоклітинної сигналізації, дисфункції органел, зміни функції ферментів, втручання в нормальний рух гомеостатичних іонів, загальної клітинної дисфункції або загибелі клітин.
Перенесення електронів
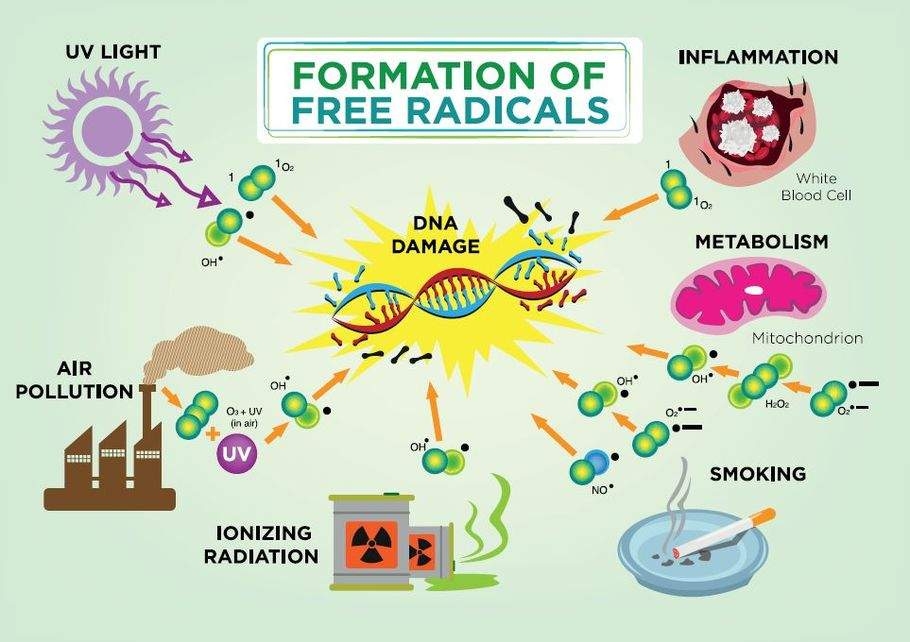 Перенесення електронів може призвести до окислення деяких ендогенних макромолекул, змінюючи їх функцію. Наприклад, хімічні речовини, які окислюють двовалентне залізо (Fe 2 +) до заліза (Fe 3 +) у молекулі гемоглобіну, викликають стан, званий метгемоглобінемією, що призводить до зниження здатності гемоглобіну в еритроцитах доставляти кисень до тканин організму. Перенесення електронів може призвести до утворення радикалів, високореактивних атомів або молекул з непарними електронами, які можуть зв'язуватися та пошкоджувати клітинні молекули та структури. Вільні радикали, отримані киснем («вільні», оскільки вони не прикріплені до більших молекул), такі як іон супероксиду (• O 2-) та гідроксильний радикал (HO•), виробляються під час нормальних фізіологічних процесів, але при їх надлишку можуть спричинити значні пошкодження клітин через їх здатність до самовизначення увічнити. Антиоксиданти, присутні в живих організмах, допомагають пом'якшити цей «ефект сніжної кулі», даруючи електрони, не утворюючи радикальних видів. Важливі антиоксиданти, присутні в клітині, включають супероксиддисмутазу, каталазу, вітамін А та глутатіон.
Перенесення електронів може призвести до окислення деяких ендогенних макромолекул, змінюючи їх функцію. Наприклад, хімічні речовини, які окислюють двовалентне залізо (Fe 2 +) до заліза (Fe 3 +) у молекулі гемоглобіну, викликають стан, званий метгемоглобінемією, що призводить до зниження здатності гемоглобіну в еритроцитах доставляти кисень до тканин організму. Перенесення електронів може призвести до утворення радикалів, високореактивних атомів або молекул з непарними електронами, які можуть зв'язуватися та пошкоджувати клітинні молекули та структури. Вільні радикали, отримані киснем («вільні», оскільки вони не прикріплені до більших молекул), такі як іон супероксиду (• O 2-) та гідроксильний радикал (HO•), виробляються під час нормальних фізіологічних процесів, але при їх надлишку можуть спричинити значні пошкодження клітин через їх здатність до самовизначення увічнити. Антиоксиданти, присутні в живих організмах, допомагають пом'якшити цей «ефект сніжної кулі», даруючи електрони, не утворюючи радикальних видів. Важливі антиоксиданти, присутні в клітині, включають супероксиддисмутазу, каталазу, вітамін А та глутатіон.
перекисне окислення ліпідів
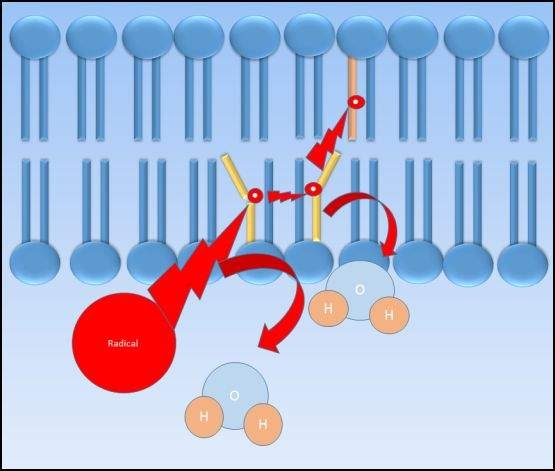
Вилучення водню, спричинене токсикантами, з мембранних фосфоліпідів може викликати перекисне окислення ліпідів, що призводить до пошкодження мембрани, що призводить до витоку та/або загибелі клітин. Перекисне окислення ліпідів відбувається, коли електрофільна сполука краде електрон з мембранного фосфоліпідного, виробляючи радикал жирної кислоти. Цей радикал жирної кислоти відносно нестабільний і легко реагує з молекулярним киснем для отримання пероксил-жирної кислоти радикал. Радикал пероксильної жирної кислоти потім реагує з іншою жирною кислотою, виробляючи ще один перекис ліпідів та радикал жирної кислоти, який продовжує цикл у механізмі ланцюгової реакції типу. Коли вони присутні в достатній кількості, антиоксиданти, такі як вітамін Е, можуть допомогти припинити перекисне окислення ліпідів.
Деякі токсиканти діють ферментативно з молекулами-мішенями, надаючи свої несприятливі ефекти. Рицин, токсин з рослини рицини, ферментативно гідролізує зв'язок в молекулі рибосомальної РНК, тим самим блокуючи синтез білка. Багато отрути змії містять різноманітні ферменти, які можуть руйнувати клітини і тканини організму; наприклад, гіалуронідаза розщеплює сполучну тканину шляхом гідролізу гіалуронової кислоти, незамінного полісахариду в сполучній тканині.
Нецільова токсичність
Не всі токсичні ефекти опосередковані шляхом безпосередньої дії токсиканту на місце пошкодження. Деякі токсиканти надають свою дію, змінюючи біологічне мікросередовище уражених клітин або тканин, і отримана травма може бути віддалена від місця токсикантної дії. Наприклад, токсичні алкалоїди ріжків, що виробляються грибком Claviceps purpurea, діють на кровоносні судини, викликаючи звуження судин, що призводить до зниження кровообігу та гангрени кінцівок. Інші токсиканти можуть надавати свій вплив лише фізично присутнім, як коли інертні гази, такі як метан, витісняють кисень у навколишньому середовищі, що призводить до асфіксії. Деякі ксенобіотики можуть осаджуватися у вигляді кристалів в ниркових канальцях, що призводить до механічного пошкодження канальцевого епітелію, що призводить до травми нирок.
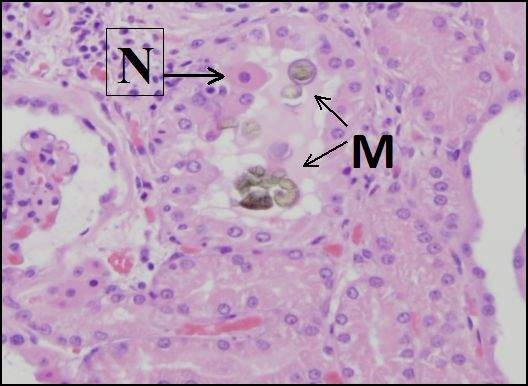 Малюнок\(\PageIndex{3}\): Осадження кристалів меламін-цианурової кислоти (М) викликає механічне пошкодження клітин в дистальних канальцях собачої нирки. Від базальної мембрани відірвалася некротична (мертва) клітина (N). Забруднення меламіном корму для домашніх тварин спричинило травму нирок сотень собак та котів у 2007 році. (Надано Каліфорнійським університетом, анатомічна патологія Девіса.)
Малюнок\(\PageIndex{3}\): Осадження кристалів меламін-цианурової кислоти (М) викликає механічне пошкодження клітин в дистальних канальцях собачої нирки. Від базальної мембрани відірвалася некротична (мертва) клітина (N). Забруднення меламіном корму для домашніх тварин спричинило травму нирок сотень собак та котів у 2007 році. (Надано Каліфорнійським університетом, анатомічна патологія Девіса.)
Тема 2: Ключові моменти
У цьому розділі ми розглянули наступні основні моменти:
- 1: Токсиканти можуть взаємодіяти з молекулами господаря цілеспрямовано або нецілеспрямовано.
- Цільові взаємодії включають ковалентне і нековалентне зв'язування, перенесення електронів, абстрагування водню та ферментативні реакції.
- 2: Ковалентний зв'язок молекул токсиканта та мішені утворюють аддукти, які можуть спричинити фізичне або функціональне пошкодження макромолекул, таких як білки та нуклеїнові кислоти.
- Ковалентне зв'язування метаболіту ацетамінофену, NAPQI, з макромолекулами в гепатоцитах може призвести до важкого пошкодження печінки, що вимагає трансплантації печінки.
- 3: Нековалентне зв'язування між молекулами токсиканта та мішені утворюють відносно слабкі, оборотні зв'язки.
- 4: Перенесення електронів може призвести до утворення самоувічнених радикалів, які можуть завдати значної шкоди клітинним структурам.
- Антиоксиданти, такі як супероксиддисмутаза, зв'язують вільні радикали і допомагають запобігти увічненню утворення вільних радикалів.
- 5: Перекисне окислення ліпідів починається з вилучення водню з мембранних фосфоліпідів, що призводить до утворення радикалів жирних кислот і пошкодження мембран.
- 6: Токсиканти можуть діяти як ферменти, пошкоджуючи клітинні або тканинні структури або перешкоджаючи нормальній клітинній функції.
- 7: Нецільові взаємодії включають зміни в біологічному мікросередовищі клітин і тканин та порушення нормальної функції шляхом фізичної обструкції або механічних пошкоджень.
1. Електрофільні сполуки зв'язуються з нуклеофільними сполуками з утворенням аддуктів є прикладом того, який тип цільової токсичності:
Ковалентне зв'язування
Нековалентне зв'язування
ферментативні реакції
- Відповідь
-
Ковалентне зв'язування
2. Порівняно з ковалентним зв'язуванням токсиканту з його молекулою мішені, нековалентні зв'язки мають тенденцію бути:
Сильніше
Аналогічної міцності
слабкіше
- Відповідь
-
слабкіше
3. Антиоксиданти пом'якшують пошкодження клітин, передаючи електрони ________.
- Відповідь
-
вільних радикалів
4. Зв'язування метаболіту ацетамінофену NAPQI з клітинною ДНК є прикладом:
Освіта вільних радикалів
Формування аддукта
перекисне окислення ліпідів
Ферментативна деградація
- Відповідь
-
Формування аддукта
5. Механічне ураження нирок, спричинене осадженням кристалів всередині ниркових канальців, є прикладом ________
- Відповідь
-
Нецілеспрямована токсичність