9.3: Хімія води
Деякі хімічні та біохімічні явища, що відбуваються у воді, проілюстровані на малюнку 9.4. 2 Фізично, показаний водойма стратифікований протягом літніх місяців з більш теплим, менш щільним епілімніон плаває над більш холодним, більш щільним гіполімніоном, з невеликим змішуванням між ними. Епілімніон контактує з атмосферою і має значний вміст розчиненого кисню. Тому в епілімніоні переважають окислені неорганічні види. Гіполімніон є аноксичним, оскільки мікроорганізми споживають весь розчинений в ньому O 2 і він не контактує з атмосферою. У гіполімніоні переважають знижені неорганічні види. Основним фактором хімії цієї системи є біохімічне фотосинтетичне виробництво органічної речовини, представленої {CH 2 O}. Органічна речовина є біохімічним відновником і при зануренні в гіполініон окислюється опосередкованими мікроорганізмами процесами, які, наприклад, зменшують NO 3 - і SO 4 2- до NH 4 + і H 2 S відповідно. Дві важливі мікробно опосередковані окислювально-відновні реакції {CH 2 O} - це реакція з розчиненим O 2,
(CH2O)+O2→CO2+H2O
який виснажує розчинений кисень у воді, роблячи гіполімніон аноксичним та метановим бродінням,
2(CH2O)→CH4+CO2
який виробляє горючий газ метану. Здатність {CH 2 O} реагувати з розчиненим O 2 є мірою потенціалу води виснажуватися киснем, необхідним рибам та іншим водним організмам, і виражається як біохімічна потреба в кисні, БПК, важлива якість води параметр.
Фотосинтетичне біохімічне виробництво біомаси призводить до деяких важливих хімічних реакцій. Як показано на малюнку 9.4, водорості використовують розчинений HCO 3 - іон як джерело вуглецю і при цьому виробляють карбонатний іон, CO 3 2-. Дві додаткові реакції карбонатного іона показані на малюнку 9.4. Одним з них є його реакція гідролізу з молекулами H 2 O назад до HCO 3 - з виробленням OH - іона. Це робить воду основною, важливою водною кислотно-лужною реакцією. Друга реакція карбонату полягає в тому, що при розчиненому Ca 2 + утворюється тверда CaCo 3, важлива реакція опадів у воді, яка відповідала за утворення великих відкладень вапняку.
Всі основні окислювально-відновні реакції в природній воді здійснюються мікроорганізмами, які виступають в ролі каталізаторів і витягують енергію, що виділяється реакціями. Прикладом, показаним на малюнку 9.4, є біохімічне відновлення SO 4 2- до H 2 S., в якому сульфат діє як окислювач для окислення біомаси ({CH 2 O}) за відсутності молекулярного O 2. Проходячи в гіполімніоні і відкладеннях, ця реакція відповідає за неприємний запах сірководню в деяких водоймах і болотах.
Ще одним важливим явищем в природних водах і стічних водах є утворення хелатів металів, в яких іони металів пов'язані в двох і більше місцях органічними речовинами. Гумінові речовини, що утворюються в результаті часткового біодеградації біомаси, є складними великими органічними молекулами з численними ароматичними кільцевими структурами, що містять кисень у функціональних групах, включаючи карбоксил (-CO2H) та фенольний гідроксил (-OH). Ці групи можуть втратити Н+виробляти негативно заряджені групи, здатні зв'язуватися з іонами металів, як показано нижче для хелювання Fe 2 + іон:
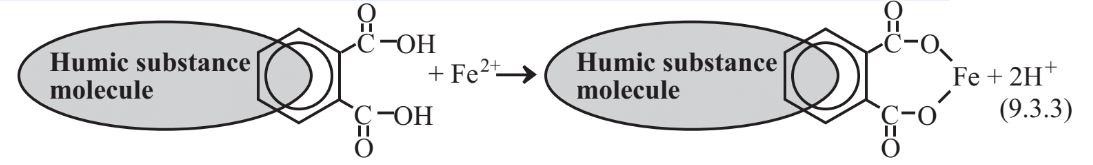
Найважливішими гуміновими речовинами у воді є нижньомолекулярні фульвокислоти. Ці види, як правило, хелат Fe 2 + іон виробляють жовтий матеріал, який називається gelbstoffe (німецька означає «жовтий матеріал.)» Іони металів, пов'язані з фульвокислотою, важко видалити з води, і, оскільки залізо є дуже небажаною домішкою води, для видалення хелатного заліза можуть знадобитися кардинальні заходи, такі як руйнування фульвокислоти хлором.
Фазові взаємодії у водній хімії
Малюнок 9.4 ілюструє процес обміну розчинених розчинених речовин у воді з відкладеннями. Взаємодія між водою та твердою, газовою та іншими рідкими фазами дуже важлива у водній хімії. Водні біохімічні процеси передбачають обмін матеріалами між водним розчином і клітинами мікроорганізмів. Наприклад, коли відбувається фотосинтез у воді (рис. 9.4), розчинений HCO 3 - іон переноситься в клітину плаваючого фотосинтетичного фітопланктону для перетворення в біомасу. Як продукт цієї реакції газоподібний О 2 виділяється з клітини, частина його розчиняється у воді, а частина плаває до вершини у вигляді бульбашок O 2. Як зазначалося вище, іон CO 3 2-, що утворюється як побічний продукт фотосинтезу, реагує з розчиненим іоном Ca 2 + з отриманням твердого CaCo 3. Зворотний процес відбувається, коли бактеріально вироблений розчинений вуглекислий газ реагує з твердим карбонатом кальцію.
CO2(aq)+H2O+CaCO3(s)→Ca2+(aq)+2HCO−3(aq)
покласти іон кальцію і бікарбонатний іон в розчин. Обидва ці види мають важливе значення у воді. Іон Са 2 + відповідає за жорсткість води, названий за схильність до утворення опадів з мильними аніонами, які марні для очищення, а HCO 3 - це лужність води, здатність нейтралізувати кислоти.
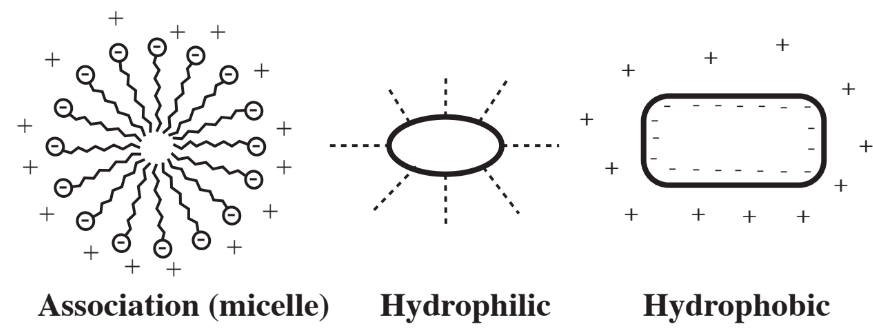
Особливий вид фази, що взаємодіє з водою, складається з колоїдних частинок, які представляють собою дуже дрібні частинки розміром близько мікрометра, які зважуються у воді. Існує три види колоїдних частинок, як показано на малюнку 9.5. Багато значущих матеріалів існують як колоїдні частинки у воді, включаючи бактеріальні та водорості клітини, глинисті мінерали, мило та різноманітні забруднювачі. Поведінка колоїдів є проміжною між поведінкою справжніх розчинів та сипучих матеріалів, таких як у відкладах. На таку поведінку сильно впливає дуже високе співвідношення поверхні до об'єму колоїдів. Агрегація колоїдних частинок є важливим і часто складним аспектом очищення води, наприклад, при відстоюванні та відділенні мікроорганізмів, що беруть участь у біологічній очистці стічних вод.
Кислотно-лужні явища у воді
Природна вода майже завжди містить кислоти, здатні виділяти іон Н +, і може містити розчинні речовини, які можуть приймати іон Н + і, таким чином, діяти як основи. Найпоширенішим кислотним речовиною у воді є розчинений СО 2, який може потрапляти в воду з атмосфери або в більш високих концентраціях як продукт мікробного розпаду органічної речовини. Розчинений вуглекислий газ виробляє іон Н + наступною реакцією з водою:
CO2(aq)+H2O⇆H++HCO−3
Подвійні стрілки позначають, що реакція оборотна. Оскільки вуглекислий газ є слабкою кислотою, рівновага реакції лежить зліва, що виражається наступною константою дисоціації кислоти, в якій pK a1 = -LogK a1:
\Ka1=[H+][HCO−3][CO2]=4.45×10−7pKa1=6.35
HCO 3 - іон також може втратити H +:
HCO−3⇆H++CO2−3
Ka2=[H+][CO2−3][HCO−3]=4.69×10−11pKa2=10.33
В іншому випадку чиста вода в рівновазі з повітрям містить деяку кількість розчиненого СО 2 з атмосфери, що становить 390 частин на мільйон СО 2 за обсягом. Розрахунки розчинності можуть бути використані для того, щоб показати, що концентрація розчиненого вуглекислого газу у воді, [CO 2 (aq)], в рівновазі з повітрям становить 1,276 × 10 -5 М (моль/літр). Коли кожен СО 2 вступає в реакцію з Н 2 О, виробляються один Н + і один НСО 3. Заміна в рівноважну константу вираження Рівняння 9.3.6 призводить до [Н +] =2,38×10 -6 М, рН = 5,62, трохи більш кислий, ніж нейтральний рН 7. Тому дощова вода від природи слабокисла. Природна вода з рН менше 5,62 ймовірно містить забруднюючу сильну кислоту, найчастіше H 2 SO 4 від кислотних дощів.
Велика частина води, яка контактувала з геосферою, містить лужність, здатність реагувати з іоном Н + і нейтралізувати кислотність. Як правило, лужність обумовлена наявністю HCO 3 - іона, який зазнає наступну реакцію з іоном H +:
HCO−3+H+→CO2+H2O
Лужність зазвичай вводять у воду реакцією розчиненого СО 2 з мінералом CaCo 3, як показано в Реакція 9.3.4. Через наявність лужності більшість природних вод, таких як ті, що використовуються для постачання муніципальних систем водопостачання, є трохи основними з рН близько 8, а не є слабокислими, як дощова вода.
