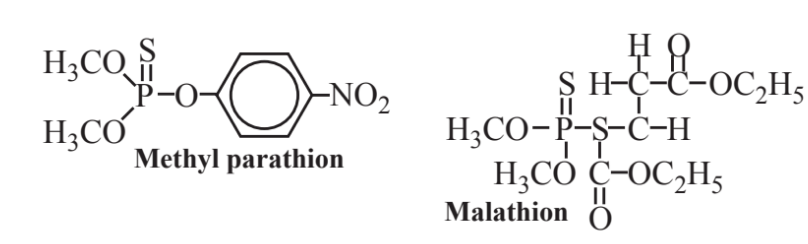6.4: Функціональні групи
- Page ID
- 18868
Численні елементи крім вуглецю і водню зустрічаються в органічних сполуках. Вони містяться в функціональних групах, які визначають різні класи органічних сполук. Група −NH 2 в аніліні та групи -OH у фенолі, згадані вище, є прикладами функціональних груп. Одне і те ж органічне з'єднання може містити дві і більше функціональних груп. Серед елементів, загальних у функціональних групах, є O, N, Cl, S та P. Тут немає місця для обговорення всіх можливих функціональних груп та класів органічних сполук, які вони визначають. Наведено кілька важливих прикладів, щоб дати уявлення про різноманітність органічних сполук з різними функціональними групами. Інші приклади зустрічаються пізніше в тексті.
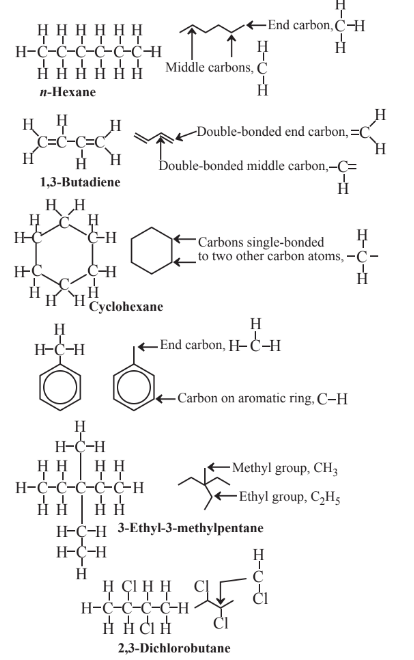
Використовуючи лінії для представлення органічних структурних формул, кути, де лінії перетинаються, а кінці ліній представляють атоми С, і кожна лінія означає ковалентний зв'язок (2 спільних електронів). Зрозуміло, що кожен атом С в кінці однієї лінії має 3 атома Н приєднані, кожен атом С а перетин 2 ліній має приєднані 2 атоми С, кожна C на перетині 3 ліній має 1 H приєднаних, а перетин 4 ліній позначає атом С без приєднаних атомів H. Кілька рядків
Кисневі органічні сполуки
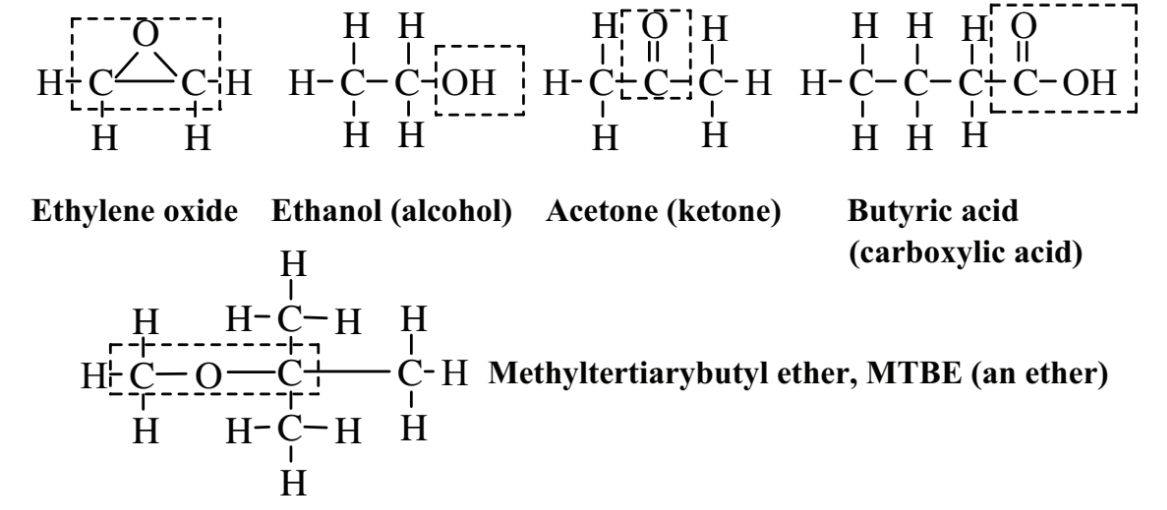
На малюнку 6.4 показані кілька важливих класів органічних сполук, які містять кисень. Етиленоксид - це солодко пахне, безбарвний, легкозаймистий, вибухонебезпечний газ. Це епоксид, що характеризується атомом кисню, що з'єднує два атоми вуглецю, які також пов'язані між собою. Оксид етилену токсичний і використовується як стерилізатор і фумігант, а також як хімічний проміжний продукт. Через токсичність і горючості цієї сполуки практика зеленої хімії намагається уникати його утворення і використання. Етанол, який зустрічається в алкогольних напоях, являє собою спирт, клас з'єднання, в якому група -ОН пов'язана з алканом або алкеном (приєднання групи -ОН до молекули ароматичного вуглеводню дає фенольне з'єднання). Ацетон - це кетон, клас сполук, який має функціональну групу C = O в середині вуглеводневого ланцюга. Ацетон є відмінним органічним розчинником і відносно безпечним. Масляна кислота, яка зустрічається в вершковому маслі, являє собою органічну карбонову кислоту, всі з яких містять функціональну групу,
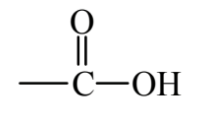
який може виділяти характерний для кислот іон H+. Метилтретіарбутиловий ефір, MTBE, є прикладом ефіру, в якому атом О з'єднує атоми 2 С. Коли високотоксичний тетраетилсвинець був поетапно виведений з бензину як октанового підсилювача, MTBE був обраний як замінник. Згодом було виявлено, що він є особливо шкідливим забруднювачем води, і його використання було значною мірою заборонено
Група C = O в середині органічної молекули характерна для кетонів. Коли ця група розташована в кінці молекули, а вуглець також пов'язаний з Н, з'єднання є альдегідом. Два найнижчих альдегіди - формальдегід і ацетальдегід,

з яких найбільш широко виробляється формальдегід. Незважаючи на багато застосувань, формальдегід не має характеристик зелених хімічних речовин, оскільки це летюча, токсична, шкідлива речовина. Формальдегід, як правило, викликає гіперчутливість (алергію) у людей, які вдихають пари або шкіра яких піддається впливу на нього.
Реакція алкоголю і органічної кислоти,
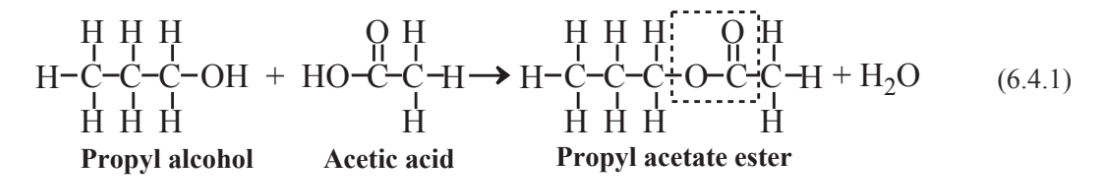
виробляє важливий вид органічної сполуки, званої ефірами. Характеристика зв'язку ефірів окреслена пунктирною коробкою в структурі пропілацетату вище. Велика кількість природних ефірів, вироблених рослинами, відзначається своїми приємними запахами. Наприклад, пропілацетат надає грушам їх приємний запах. Інші фруктові запахи через ефіри включають метилбутират, яблуко; етилбутират, ананас; і метилбензоат, стиглі ківі.
Органоазотні сполуки
метиламін,
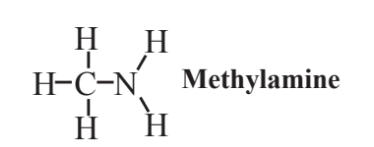
є найпростішим з амінів, сполук, в яких атом N пов'язаний з вуглеводневою групою. В аміні атом N може бути пов'язаний з атомами 2 Н, або один або обидва ці атоми Н можуть бути замінені вуглеводневими групами, а також. Хоча він широко використовується в хімічному синтезі, оскільки немає відповідних замінників, метиламін, безумовно, не сумісний з практикою зеленої хімії. Це тому, що він є легкозаймистим і токсичним. Є сильним подразником шкіри, очей та слизових оболонок дихальних шляхів. Він має шкідливий запах і є значним фактором запаху тухлої риби. Відповідно до репутації амінів як взагалі неприємних сполук, інший амін, путресцин, надає гнилої м'якоті свій характерний запах.
Багато органоазотні сполуки містять кисень, а також. Одним з таких з'єднань є нітрометан.

використовується в хімічному синтезі і в якості палива в деяких гоночних автомобілей. Як видно з наведеної вище структурної формули, нітрогрупа, -NO 2, є функціональною групою в цій сполуці та споріднених нітросполуках. Інший клас органоазотних сполук, які також містять кисень, складається з нітрозамінів або N-нітрозосполук, які займали видне місце в історії зеленої хімії, перш ніж вона була визначена як така. Це сполуки, які мають функціональну групу N-N = O, які викликають занепокоєння, оскільки кілька відомих канцерогенів (агентів, що викликають рак). Найбільш відомим з них є диметилнітрозамін, показаний нижче:
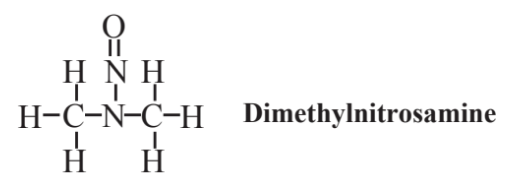
Ця сполука використовувалася як промисловий розчинник і використовувалася в ріжучих оліях. Однак працівники, які зазнали його впливу, страждали пошкодженням печінки і розвинулася жовтяниця, і з'єднання, а також інші нітрозаміни виявилися канцерогеном. Ряд інших нітрозамінів пізніше були виявлені в промислових матеріалах і в якості побічних продуктів харчової переробки та консервації. Через їх потенціал як канцерогенів, нітрозамінів уникають у практиці зеленої хімії.
Ганогалогенідні сполуки
Органогалогеніди, показані на малюнку 6.5, є органічними сполуками, які містять галогени - F, Cl, Br або I - але зазвичай хлор, на алканах, алкенах або ароматичних молекулах. Органогалогеніди широко виробляються та розповсюджуються для різних застосувань, включаючи промислові розчинники, хімічні проміжні продукти, охолоджуючі рідини, пестициди та інші програми. Вони здебільшого екологічно стійкі і через свою схильність до накопичення в жировій (жировій) тканині схильні піддаватися біоакумуляції та біомагніфікації в організмах
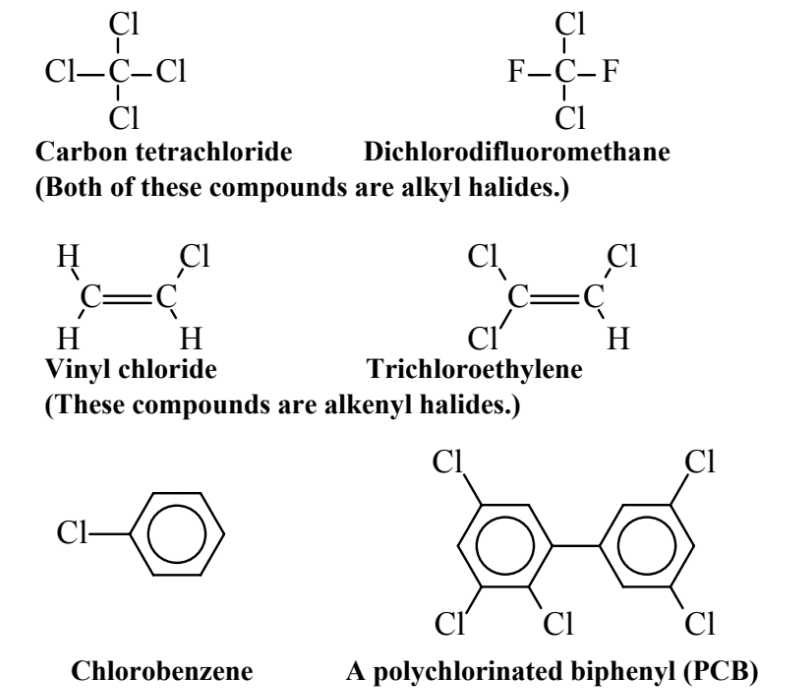
Тетрахлорметан вуглецю утворюється, коли всі чотири атоми Н на метані, CH 4, замінюються Cl. Ця сполука колись широко використовувалася і навіть продавалася громадськості як розчинник для видалення плям і в вогнегасниках, де важка пара CcL 4 душить пожежі. Згодом було виявлено, що він дуже токсичний, спричиняючи серйозні пошкодження печінки, і його використання суворо обмежено. Дихлордифторметан є видатним членом хлорфторуглеродного класу сполук, в народі відомий як фреони. Розроблені як холодоагенти, ці сполуки особливо нереактивні та нетоксичні. Однак, як обговорювалося в главі 10, вони виявилися непорушними в нижній атмосфері, зберігаючись на дуже великих висотах в стратосфері, де хлор, що розщеплюється з них ультрафіолетовим випромінюванням, руйнує стратосферний озон. Так що виробництво хлорфторуглеродів зараз заборонено. Вінілхлорид, органогалогенідна сполука на основі алкену, широко використовується для виготовлення полівінілхлоридних полімерів та труб. На жаль, це відомий людський канцероген, тому вплив людини на нього сильно обмежений. Трихлоретилен - відмінний органічний розчинник, який є негорючим. Він використовується як розчинник для сухого очищення та для знежирення виготовлених деталей, а раніше використовувався для екстракції їжі, особливо для кави без кофеїну. Хлорбензол - найпростіший ароматичний хлорганохлорид. Окрім використання у виробництві інших хімічних речовин, він служить розчинником і рідиною для передачі тепла. Він надзвичайно стійкий, а його руйнування є загальним випробуванням на ефективність сміттєспалювальних установок для небезпечних відходів. Показана сполука поліхлорованого дифенілу (PCB) є однією з 209 сполук PCB, які можуть бути утворені шляхом заміни від 1 до 10 атомів Cl на основний вуглецевий скелет біфенілу (два-бензол-кільця). Ці сполуки особливо стабільні та стійкі, що призводить до їх використання в електрообладнанні, особливо в якості охолоджуючих рідин у трансформаторах та промислових конденсаторах, як гідравлічних рідин та інших застосувань. Їх надзвичайна екологічна наполегливість призвела до їх заборони. Відкладення в нью-йоркській річці Гудзон сильно забруднені друкованими платами, які (на той час легально) скидалися або просочилися в річку від виробництва електрообладнання з 1950-х до 1970-х років.
З обговорення вище очевидно, що багато органогалогенідних сполук, безумовно, не є зеленими через їх стійкість і біологічні ефекти. Багато зусиль у розробці зеленої хімії було присвячено пошуку замінників галогенідних органічних сполук. Договір Організації Об'єднаних Націй 2001 року, сформульований приблизно 90 країн у Стокгольмі, Швеція, позначив «брудну десятку» 12 галогенідних сполук, що викликають особливе занепокоєння, як стійкі органічні забруднювачі (СОЗ); інші сполуки згодом були додані до цього списку.
Органосірка і фосфорорганічні сполуки
Ряд органосірки та фосфорорганічних сполук були синтезовані для різних цілей, включаючи пестицидні застосування. Поширений клас сірчаноорганічних сполук складається з тіолів, найпростішим з яких є метанетіол:
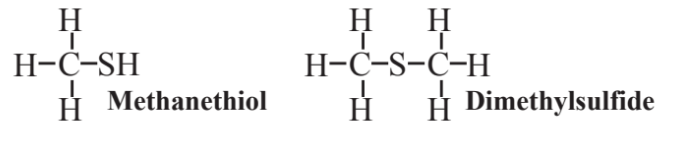
Як і у випадку з іншими тіолами, які містять групу -SH, це з'єднання відзначається своїм неприємним запахом. Тіоли додають в природний газ, щоб їх запах міг попередити про витоки газу. Диметилсульфід, також показаний вище, - це летюча сполука, що виділяється в атмосферу мікроорганізмами, що мешкають в океані, в таких кількостях, що становить найбільший потік сірковмісних парів із Землі в атмосферу.
Серед найбільш видатних фосфорорганічних сполук є фосфороргнати, як показано метилпаратіон і малатіон (нижче). Ці сполуки є одночасно інсектицидами і містять сірку, а також фосфор. Паратіон був розроблений протягом 1940-х років і колись широко використовувався як інсектицид замість ДДТ, оскільки паратіон дуже біологічно розкладається, тоді як ДДТ не є і піддається біоакумуляції та біомагніфікації в екосистемах. На жаль, паратіон має високу токсичність для людей та інших тварин, і деякі людські смертельні випадки стали наслідком впливу на нього. Як і інші фосфороргнати, він пригнічує ацетилхолінестеразу - фермент, необхідний для нервової функції (той же спосіб дії, що і його смертельні двоюрідні брати, «нервовий газ» військові отрути, такі як зарин). Через свою токсичність паратіон зараз заборонений до загального застосування. Малатіон використовується на своєму місці і лише близько 1/100 настільки ж токсичний, як паратіон для ссавців, оскільки вони - хоча і не комахи - мають ферментні системи, які можуть його зруйнувати.